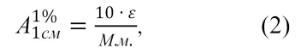Оптическая плотность раствора
Колориметрия
Из оптических методов анализа в практике аналитических лабораторий наиболее широко применяются колориметрические методы (от лат. color — цвет и греч. μετρεω — измеряю). Колориметрические методы основаны на измерении интенсивности светового потока, прошедшего через окрашенный раствор.
В колориметрическом методе используются химические реакции, сопровождающиеся изменением цвета анализируемого раствора. Измеряя светопоглощение такого окрашенного раствора или сравнивая полученную окраску с окраской раствора известной концентрации, определяют содержание окрашенного вещества в испытуемом растворе.
Существует зависимость между интенсивностью окраски раствора и содержанием в этом растворе окрашенного вещества. Эта зависимость, называемая основным законом светопоглощения (или законом Бугера—Ламберта—Бера), выражается уравнением:
I = I0 10 — ε c l
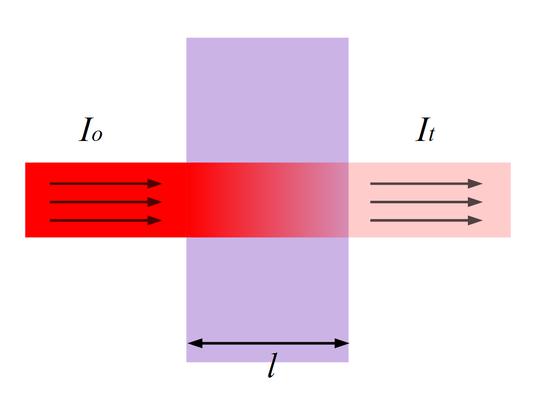
где I — интенсивность света, прошедшего через раствор; I0 — интенсивность падающего на раствор света; ε- коэффициент светопоглощения, постоянная величина для каждого окрашенного вещества, зависящая от его природы; С — молярная концентрация окрашенного вещества в растворе; l — толщина слоя светопоглощающего раствора, см.
Физический смысл этого закона можно выразить следующим образом. Растворы одного и того же окрашенного вещества при одинаковой концентрации этого вещества и толщине слоя раствора поглощают равное количество световой энергии, т. е. светопоглощение таких растворов одинаковое.
Для окрашенного раствора, заключенного в стеклянную кювету с параллельными стенками, можно сказать, что по мере увеличения концентрации и толщины слоя раствора его окраска увеличивается, а интенсивность света I, прошедшего через поглощающий раствор, уменьшается по сравнению с интенсивностью падающего света I0.
Рис.1 Прохождение света через кювету с исследуемым раствором.
Оптическая плотность раствора.
Если прологарифмировать уравнение основного закона светопоглощения и изменить знаки на обратные, то уравнение принимает вид:
Величина 
A = ε C l
Из этого уравнения вытекает, что оптическая плотность раствора прямо пропорциональна концентрации окрашенного вещества и толщине слоя раствора.
Другими словами, при одинаковой толщине слоя раствора данного вещества оптическая плотность этого раствора будет тем больше, чем больше в нем содержится окрашенного вещества. Или, наоборот, при одной и той же концентрации данного окрашенного вещества оптическая плотность раствора зависит только от толщины его слоя. Отсюда может быть сделан следующий вывод: если два раствора одного и того же окрашенного вещества имеют различную концентрацию, одинаковая интенсивность окраски этих растворов будет достигнута при толщинах их слоев, обратно пропорциональных концентрациям растворов. Этот вывод очень важен, так как на нем основаны некоторые методы колориметрического анализа.
Таким образом, чтобы определить концентрацию (С) окрашенного раствора, необходимо измерить его оптическую плотность (A). Чтобы измерить оптическую плотность, следует измерить интенсивность светового потока.
Интенсивность окраски растворов можно измерять различными методами. Различают субъективные (или визуальные) методы колориметрии и объективные (или фотоколориметрические).
Визуальными называются такие методы, при которых оценку интенсивности окраски испытуемого раствора делают невооруженным глазом.
При объективных методах колориметрического определения для измерения интенсивности окраски испытуемого раствора вместо непосредственного наблюдения пользуются фотоэлементами. Определение в этом случае проводят в специальных приборах — фотоколориметрах, откуда и метод получил название фотоколориметрического.
Визуальные методы
К визуальным методам относятся:
1) метод стандартных серий;
2) метод дублирования (колориметрическое титрование);
3) метод уравнивания.
Метод стандартных серий. При выполнении анализа методом стандартных серий интенсивность окраски анализируемого окрашенного раствора сравнивают с окрасками серии специально приготовленных стандартных растворов (при одинаковой толщине поглощающего слоя).
Растворы в колориметрии обычно имеют интенсивную окраску, поэтому имеется возможность определять весьма небольшие концентрации или количества веществ. Однако это может сопровождаться определенными трудностями: так навески для приготовления серии стандартных растворов могут быть очень малы. Для преодоления этих трудностей готовят стандартный раствор А достаточно высокой концентрации, например 1 мг/мл. После этого путем разбавления из раствора А готовят стандартный раствор В значительно меньшей концентрации, а из него в свою очередь готовят серию стандартных растворов.
Для этого в пробирки или кюветы одинакового размера и одинакового цвета стекла пипеткой добавляются необходимые объемы растворов реагентов в нужной последовательности. Порции растворов определяемого вещества целесообразно добавлять из бюретки, т.к. их объемы будут различны для обеспечения различных концентраций в серии стандартных растворов. При этом начальный раствор должен содержать все компоненты, кроме определяемого вещества (нулевой раствор). В исследуемый раствор добавляют растворы необходимых реагентов. Все растворы доводят до постоянного объема, а затем визуально сравнивают интенсивность окраски исследуемого раствора с растворами серии стандартных растворов. Возможно совпадение интенсивности окраски с каким-либо раствором серии. Тогда считается, сто исследуемый раствор имеет такую же концентрацию или содержит столько же определяемого вещества. Если же интенсивность окраски покажется промежуточной между соседними растворами серии, концентрация или содержание определяемого компонента считают средним арифметическим между растворами серии.
Колориметрическое титрование (метод дублирования). Этот метод основан на сравнении окраски анализируемого раствора с окраской другого раствора— контрольного. Для приготовления контрольного раствора готовят раствор, содержащий все компоненты исследуемого раствора, за исключением определяемого вещества, и все употреблявшиеся при подготовке пробы реактивы, и к нему добавляют из бюретки стандартный раствор определяемого вещества. Когда этого раствора будет добавлено столько, что интенсивности окраски контрольного и анализируемого раствора уравняются, считают, что в анализируемом растворе содержится столько же определяемого вещества, сколько его было введено в контрольный раствор.
Метод уравнивания.Этот метод основан на уравнивании окрасок анализируемого раствора и раствора с известной концентрацией определяемого вещества — стандартного раствора. Существуют два варианта выполнения колориметрического определения этим методом.
По первому варианту уравнивание окрасок двух растворов с разной концентрацией окрашенного вещества проводят путем изменения толщины слоев этих растворов при одинаковой силе проходящего через растворы светового потока. При этом, несмотря на различие концентраций анализируемого и стандартного растворов, интенсивность светового потока, проходящего через оба слоя этих растворов, будет одинакова. Соотношение между толщинами слоев и концентрациями окрашенного вещества в растворах в момент уравнивания окрасок будет выражаться уравнением:
где l1 — толщина слоя раствора с концентрацией окрашенного вещества C1, а l2-толщина слоя раствора с концентрацией окрашенного вещества C2.
В момент равенства окрасок отношение толщин слоев двух сравниваемых растворов обратно пропорционально отношению их концентраций.
На основании приведенного уравнения, измерив толщину слоев двух одинаково окрашенных растворов и зная концентрацию одного из этих растворов, легко можно рассчитать неизвестную концентрацию окрашенного вещества в другом растворе.
Для измерения толщины слоя, через который проходит световой поток, можно применять стеклянные цилиндры или пробирки, а при более точных определениях специальные приборы — колориметры.
По второму варианту, для уравнивания окрасок двух растворов с различной концентрацией окрашенного вещества, через слои растворов одинаковой толщины пропускают световые потоки различной интенсивности.
В этом случае оба раствора имеют одинаковую окраску, когда отношение логарифмов интенсивностей падающих световых потоков равно отношению концентраций.
В момент достижения одинаковой окраски двух сравниваемых растворов, при равной толщине их слоев, концентрации растворов прямо пропорциональны логарифмам интенсивностей падающего на них света.
По второму варианту определение может быть выполнено только с помощью колориметра.
Теоретические основы определения оптической плотности раствора
Любая частица, будь то молекула, атом или ион, в результате поглощения кванта света переходит на более высокий уровень энергетического состояния. Чаще всего осуществляется переход из основного в возбужденное состояние. Это вызывает появление в спектрах определенных полос поглощения.
Поглощение излучения приводит к тому, что при пропускании его через вещество интенсивность этого излучения снижается при увеличении количества частиц вещества, обладающего некоторой оптической плотностью. Этот метод исследования предложил В. М. Севергин еще в 1795 году.
Наилучшим образом этот метод годится для реакций, где определяемое вещество способно переходить в окрашенное соединение, что вызывает изменение окраски исследуемого раствора. Измерив его светопоглощение или сравнив окраску с раствором известной концентрации, несложно найти процент содержания вещества в растворе.
Основной закон светопоглощения
Суть фотометрического определения заключается в двух процессах:
- перевод определяемого вещества в поглощающее электромагнитные колебания соединение;
- замер интенсивности поглощения этих самых колебаний раствором исследуемого вещества.
Изменения в интенсивности потока света, проходящего через светопоглощающее вещество, будут вызываться также потерями света из-за отражения и рассеяния. Чтобы результат был достоверным, проводят параллельные исследования по замеру параметров при той же толщине слоя, в идентичных кюветах, с тем же растворителем. Так снижение интенсивности света зависит главным образом от концентрации раствора.
Уменьшение интенсивности света, пропущенного через раствор, характеризуют коэффициентом светопропускания (также принято называть его пропусканием) Т:
- I — интенсивность света, пропущенного через вещество;
- I0 — интенсивность падающего пучка света.
Таким образом, пропускание показывает долю непоглощенного светового потока, проходящего через изучаемый раствор. Обратный алгоритм значения пропускания называют оптической плотностью раствора (D): D = (-lgT) = (-lg) * (I / I0) = lg * (I0 / I).
Это уравнение показывает, какие параметры являются главными для исследования. К ним относится длина волны света, толщина кюветы, концентрация раствора и оптическая плотность.
Закон Бугера-Ламберта-Бера
Он является математическим выражением, отображающим зависимость уменьшения интенсивности монохроматического потока света от концентрации светопоглощающего вещества и толщины жидкостного слоя, через который он пропущен:
I = I0 * 10 -ε·С·ι , где:
- ε — коэффициент поглощения света;
- С — концентрация вещества, моль/л;
- ι —толщина слоя анализируемого раствора, см.
Преобразовав, эту формулу можно записать: I / I0 = 10 -ε·С·ι .
Суть закона сводится к следующему: различные растворы одного и того же соединения при равной концентрации и толщине слоя в кювете поглощают одинаковую часть падающего на них света.
Прологарифмировав последнее уравнение, можно получить формулу: D = ε * С * ι.
Очевидно, что оптическая плотность напрямую зависит от концентрированности раствора и толщины его слоя. Становится ясен физический смысл молярного коэффициента поглощения. Он равен D для одномолярного раствора и при толщине слоя в 1 см.
Ограничения применения закона
Этот раздел включает следующие пункты:
- Он справедлив исключительно для монохроматического света.
- Коэффициент ε связан с показателем преломления среды, особенно сильные отклонения от закона могут наблюдаться при анализе высококонцентрированных растворов.
- Температура при измерении оптической плотности должна быть постоянной (в рамках нескольких градусов).
- Световой пучок должен быть параллельным.
- рН среды должен быть постоянным.
- Закон применим для веществ, светопоглощающими центрами которых являются частицы одного вида.
Методы определения концентрации
Стоит рассмотреть метод градуировочного графика. Для его построения готовят ряд растворов (5-10) с различной концентрацией исследуемого вещества и замеряют их оптическую плотность. По полученным значениям выстраивают график зависимости D от концентрации. График является прямой линией, идущей от начала координат. Он позволяет легко определить концентрацию вещества по результатам проведенных измерений.
Также существует метод добавок. Применяется реже, чем предыдущий, но позволяет проанализировать растворы сложного состава, поскольку учитывает влияние дополнительных компонентов. Суть его состоит в определении оптической плотности среды Dx, содержащей определяемое вещество неизвестной концентрации Сх, с повторным анализом того же раствора, но с добавлением определенного количества исследуемого компонента (Сст). Величину Сх находят, используя расчеты или графики.
Условия проведения исследования
Чтобы фотометрические исследования давали достоверный результат, необходимо соблюдать несколько условий:
- реакция должна заканчиваться быстро и полностью, избирательно и воспроизводимо;
- окраска образующегося вещества должна быть устойчива во времени и не изменяться под действием света;
- исследуемое вещество берут в количестве, которого достаточно для перевода его в аналитическую форму;
- замеры оптической плотности проводят в том интервале длин волн, при котором различие в поглощении исходных реагентов и анализируемого раствора наибольшее;
- светопоглощение раствора сравнения принято считать оптическим нулем.
Способы расчета концентрации по величине аналитического сигнала
СПОСОБЫ РАСЧЕТА КОНЦЕНТРАЦИИ ПО ВЕЛИЧИНЕ АНАЛИТИЧЕСКОГО СИГНАЛА
МЕТОД ГРАДУИРОВОЧНОГО ГРАФИКА
Пример 1. При измерении оптической плотности в одинаковых условиях (длина волны 340 нм, толщина поглощающего слоя – 1,00 см) растворов калия дихромата с разной концентрацией хрома (мкг/мл) получены следующие результаты:
Изобразите примерный вид градуировочного графика; методом наименьших квадратов рассчитайте обратное уравнение градуировочного графика с = bA + а; определите концентрацию хрома (мкг/мл) в растворе Х, имеющем оптическую плотность 0,480.
Рассчитайте массу хрома (мг) в анализируемой пробе, если ее растворили в присутствии концентрированной серной кислоты в воде дистиллированной в мерной колбе объёмом 50,00 мл (раствор Х).
1. Расчет методом наименьших квадратов
2. Расчет с помощью программы Excel
длина волны 340 нм
Ответ: с = 115,72А — 8,8397 (r = 0,9941); масса хрома в пробе 2,34 мг
Пример 2. При измерении оптической плотности в одинаковых условиях (длина волны 400 нм, толщина поглощающего слоя – 1,00 см) растворов никеля (II) нитрата с разной концентрацией никеля (мг/мл) получены следующие результаты:
Изобразите примерный вид градуировочного графика; методом наименьших квадратов рассчитайте обратное уравнение градуировочного графика с = bA + а; определите концентрацию никеля (мг/мл) в растворе Х, имеющем оптическую плотность 0,350.
Рассчитайте массу никеля (мг) в анализируемой пробе, если ее количественно перенесли в мерную колбу объёмом 25,00 мл и развели водой дистиллированной в присутствии азотной кислоты до метки (раствор Х).
1. Расчет методом наименьших квадратов
2. Расчет с помощью программы Excel
Ответ: с = 42,495А — 3,8535 (r = 0,9986); масса никеля 275 мг
Пример 3. При измерении оптической плотности в одинаковых условиях (длина волны 620 нм, толщина поглощающего слоя – 1,00 см) растворов меди (II) в виде аммиачного комплекса с разной концентрацией меди (мкг/мл) получены следующие результаты:
Изобразите примерный вид градуировочного графика; методом наименьших квадратов рассчитайте обратное уравнение градуировочного графика с = bA; определите концентрацию меди (мкг/мл) в растворе Х, имеющем оптическую плотность 0,150.
Рассчитайте массу меди (мкг) в анализируемой пробе, если ее количественно перенесли в мерную колбу объёмом 25,00 мл и до метки развели водой дистиллированной в присутствии избытка аммиака (раствор Х).
1. Расчет методом наименьших квадратов
2. Расчет с помощью программы Excel
2. Расчет с помощью программы Excel
Ответ: с = 34,595А (r = 0,9985); масса меди 130 мкг.
МЕТОД ОДНОГО СТАНДАРТНОГО РАСТВОРА
Измеряют величину аналитического сигнала (yст) для раствора с известной концентрацией вещества (сст). Затем измеряют величину аналитического сигнала (yx) для раствора с неизвестной концентрацией вещества (сx). Такой способ расчёта можно использовать в том случае, если зависимость аналитического сигнала от концентрации описывается линейным уравнением без свободного члена. Концентрация вещества в стандартном растворе должна быть такой, чтобы величины аналитических сигналов, полученных при использовании стандартного раствора и раствора с неизвестной концентрацией вещества, были бы как можно ближе друг к другу.
ПРИМЕР 1. При фотометрическом определении концентрации нитрит-ионов с помощью реактива Грисса (раствора сульфаниловой кислоты и α-нафтиламина в разбавленной уксусной кислоте) было установлено, что раствор с концентрацией нитрит-ионов 2,00 мкг/мл имеет в соответствующих условиях оптическую плотность 0,300. Рассчитайте концентрацию нитрит-ионов в растворе (мкг/мл), оптическая плотность которого в таких же условиях равна 0,250. Зависимость оптической плотности от содержания аналита линейна и проходит через начало координат.
Ответ: 1,67 мкг/мл
МЕТОД ДВУХ СТАНДАРТНЫХ РАСТВОРОВ
(метод ограничивающих растворов)
Измеряют величины аналитических сигналов для стандартных растворов с двумя разными концентрациями вещества, одна из которых (с1) меньше предполагаемой неизвестной концентрации (сx), а вторая (с2) – больше. Его используют, если зависимость аналитического сигнала от концентрации описывается линейным уравнением, не проходящим через начало координат.
Пример 1. Раствор с концентрацией никеля (II) 12,00 мг/мл имеет оптическую плотность 0,350 нм, а с концентрацией 16,00 мг/мл – 0,440. Определите концентрацию никеля (мг/мл) в растворе с оптической плотностью 0,380 (все измерения проводились в одинаковых условиях: длина волны 400 нм, толщина поглощающего слоя – 1,00 см, раствор в азотной кислоте).
Ответ: 13,33 мг/мл
Используют при анализе сложных матриц, когда матричные компоненты оказывают влияний на величину аналитического сигнала и невозможно точно скопировать матричный состав образца, в случае линейной зависимости, проходящей через начало координат.
Вначале измеряют величину аналитического сигнала (yx) для пробы с неизвестной концентрацией вещества. Затем к данной пробе прибавляют некоторое точное количество определяемого вещества (стандарта) и снова измеряют величину аналитического сигнала (yдоб). Концентрацию определяемого компонента в анализируемой пробе (без учета разбавления) рассчитывают по формуле:
Для учета разбавления раствора используем формулу:
ПРИМЕР 1. Раствор с неизвестной концентрацией вещества имел оптическую плотность 0,300. К 5,00 мл такого раствора прибавили 2,00 мл раствора с концентрацией этого же вещества 40,0 мг/л. Оптическая плотность полученного раствора при измерении её в таких же условиях оказалась равна 0,500. Рассчитайте концентрацию вещества (мг/л) в исходном растворе.
1 способ: пропорционально
2 способ: преобразуем составленную пропорцию в приведенную ранее формулу
ПРИМЕР 2. Оптическая плотность раствора с неизвестным содержанием вещества равна 0,400. При добавлении к анализируемому раствору 10,0 мкг этого же вещества оптическая плотность увеличилась до 0,500. Рассчитайте массу определяемого вещества (мкг) в исходном растворе.
1 способ: пропорционально
2 способ: преобразуем составленную пропорцию в приведенную ранее формулу
источники:
http://fb.ru/article/378024/teoreticheskie-osnovyi-opredeleniya-opticheskoy-plotnosti-rastvora
http://pandia.ru/text/80/260/2737.php
Стр. 2
плотности воды при 20 град. С (в г/ куб. см с учетом плотности
воздуха); 0,0012 - плотность воздуха при 20 град. С и
барометрическом давлении 1011 гПа (760 мм рт. ст.).
Метод 2. Применяют в случае определения плотности жидкостей с
точностью до 0,01. Испытуемую жидкость помещают в цилиндр и при
температуре жидкости 20 град. С осторожно опускают в нее чистый
сухой ареометр, на шкале которого предусмотрена ожидаемая величина
плотности. Ареометр не выпускают из рук до тех пор, пока не станет
очевидным, что он плавает; при этом необходимо следить, чтобы
ареометр не касался стенок и дна цилиндра. Отсчет производят через
3-4 мин после погружения по делению на шкале ареометра,
соответствующему нижнему мениску жидкости (при отсчете глаз должен
быть на уровне мениска).
Примечания. 1. Определение плотности сильнолетучих веществ
ареометром не допускается.
2. В случае определения темноокрашенных жидкостей отсчет
производят по верхнему мениску.
Метод 3. Применяют для определения плотности твердых жиров и
воска. Точно взвешивают пустой пикнометр, затем взвешивают тот же
пикнометр, наполненный дистиллированной водой, температура которой
20 град. С. После этого воду удаляют и пикнометр высушивают. Все
операции проводят, соблюдая условия, указанные в методе 1.
В пикнометр вливают при помощи пипетки или небольшой воронки с
тонкооттянутым концом расплавленный жир или воск в таком
количестве, чтобы он занимал 1/3 - 1/2 объема пикнометра.
Пикнометр ставят на один час без пробки в горячую воду, затем
охлаждают до 20 град. С и взвешивают; доводят до метки
дистиллированной водой при 20 град. С, вытирают насухо и вновь
взвешивают. В обеих фазах и на поверхности их раздела не должно
быть пузырьков воздуха.
Величину плотности вычисляют по следующей формуле:
(m2 - m) 0,99703
"ро20" = -------------------- + 0,0012,
(m1 + m2) - (m + m3)
где m - масса пустого пикнометра в граммах; m1 - масса
пикнометра с дистиллированной водой в граммах; m2 - масса
пикнометра с жиром в граммах; m3 - масса пикнометра с жиром и
водой в граммах.
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ СПИРТА
В ФАРМАЦЕВТИЧЕСКИХ ПРЕПАРАТАХ
В круглодонную колбу вместимостью 200-250 мл отмеривают точное
количество жидкости. При содержании спирта в жидкости до 20% для
определения берут 75 мл жидкости, если жидкость содержит от 20 до
50% - 50 мл, от 50% и выше - 25 мл; жидкость перед перегонкой
разбавляют водой до 75 мл.
Для равномерного кипения в колбу с жидкостью помещают
капилляры, пемзу или кусочки прокаленного фарфора. Если жидкость
при перегонке сильно пенится, то добавляют фосфорную или серную
кислоту (2-3 мл), хлорид кальция, парафин или воск (2-3 г).
Приемник (мерную колбу вместимостью 50 мл) помещают в сосуд с
холодной водой, собирают около 48 мл отгона, доводят его
температуру до 20 град. С и добавляют воды до метки. Отгон должен
быть прозрачным или слегка мутным.
Плотность отгона определяют пикнометром и по
алкоголеметрическим таблицам находят соответствующее содержание
спирта в процентах по объему <*>.
--------------------------------
<*> См. с. 303.
Содержание спирта в препарате (X) в процентах по объему
вычисляют по формуле:
50а
Х= ---
б
где 50 - объем отгона в миллилитрах; а - содержание спирта в
процентах по объему; б - объем исследуемого препарата, взятый для
отгона, в миллилитрах.
Если испытуемая жидкость содержит летучие вещества - эфир,
эфирные масла, хлороформ, камфору, летучие кислоты или основания,
свободный йод и др., ее предварительно обрабатывают.
При содержании в жидкости эфира, эфирных масел, хлороформа,
камфоры к ней добавляют в делительной воронке равный объем
насыщенного раствора натрия хлорида и такой же объем петролейного
эфира. Смесь взбалтывают в течение 3 мин. После разделения слоев
спиртоводный слой сливают в другую делительную воронку и
обрабатывают таким же образом половинным количеством петролейного
эфира. Спиртоводный слой сливают в колбу для отгона, а соединенные
эфирные жидкости взбалтывают с половинным количеством насыщенного
раствора натрия хлорида, потом присоединяют к жидкости,
находящейся в колбе для отгона.
Если жидкость содержит менее 30% спирта, то высаливание
производят не раствором, а 10 г сухого натрия хлорида.
При содержании летучих кислот их нейтрализуют раствором щелочи,
при содержании летучих оснований - фосфорной или серной кислотой.
Жидкости, содержащие свободный йод, перед дистилляцией
обрабатывают цинковой пылью или рассчитанным количеством сухого
натрия тиосульфата до обесцвечивания. Для связывания летучих
сернистых соединений прибавляют несколько капель раствора едкого
натра.
Определение содержания спирта в настойках проводят также по
температуре кипения.
Прибор для количественного определения спирта в настойках
состоит из сосуда для кипячения 1, трубки 2 с боковым отростком,
холодильника 3 и ртутного термометра 4 с ценой деления 0,1 град. С
и пределом шкалы от 50 до 100 град. С (рис. 4) <*>.
--------------------------------
<*> Рис. 4. Прибор для количественного определения спирта в
настойках (объяснение в тексте). (Рисунок не приводится).
В сосуд для кипячения наливают 40 мл настойки и для
равномерного кипения помещают капилляры, пемзу или кусочки
прокаленного фарфора. Термометр помещают в приборе таким образом,
чтобы ртутный шарик выступал над уровнем жидкости на 2-3 мм.
Нагревают на сетке с помощью электроплитки мощностью 200 Вт или
газовой горелки. Когда жидкость в колбе начнет закипать, с помощью
реостата в 2 раза уменьшают напряжение, подаваемое на плитку.
Через 5 мин после начала кипения, когда температура становится
постоянной или ее отклонение не превышает +/- 0,1 град. С, снимают
показания термометра. Полученный результат приводят к нормальному
давлению. Если показания барометра отличаются от 1011 гПа (760 мм
рт. ст.), вносят поправку на разность между наблюдаемым и
нормальным давлением 0,04 град. С на 1,3 гПа (1 мм рт. ст.). При
давлении ниже 1011 гПа поправку прибавляют к установленной
температуре, при давлении выше 1011 гПа поправку вычитают.
Содержание спирта в настойке определяют при помощи таблицы.
Пример. Температура кипения настойки пустырника 80,9 град. С,
атмосферное давление 1000 гПа (752 мм рт. ст.), разность давлений
1011 - 1000 = 11 гПа (760 - 752 = 8 мм рт. ст.). Поправка
составляет: 0,04 град. С х 8 = 0,32 град. С. К найденной
температуре кипения прибавляют поправку: (80,9 + 0,32) град. С. По
таблице этой температуре кипения соответствует 66% спирта.
Определение концентрации спирта в водно - спиртовых смесях
по температуре кипения при давлении 1011 гПа
(760 мм рт. ст.)
------------T---------T-----------T---------T-----------T---------¬
¦Температура¦% спирта ¦Температура¦% спирта ¦Температура¦% спирта ¦
¦ кипения, ¦по объему¦ кипения, ¦по объему¦ кипения, ¦по объему¦
¦ град. С ¦ ¦ град. С ¦ ¦ град. С ¦ ¦
+-----------+---------+-----------+---------+-----------+---------+
¦ 99,3 ¦ 1 ¦ 86,4 ¦ 28 ¦ 82,3 ¦ 55 ¦
¦ 98,3 ¦ 2 ¦ 86,1 ¦ 29 ¦ 82,2 ¦ 56 ¦
¦ 97,4 ¦ 3 ¦ 85,9 ¦ 30 ¦ 82,1 ¦ 57 ¦
¦ 96,6 ¦ 4 ¦ 85,6 ¦ 31 ¦ 82,0 ¦ 58 ¦
¦ 96,0 ¦ 5 ¦ 85,4 ¦ 32 ¦ 81,9 ¦ 59 ¦
¦ 95,1 ¦ 6 ¦ 85,2 ¦ 33 ¦ 81,8 ¦ 60 ¦
¦ 94,3 ¦ 7 ¦ 85,0 ¦ 34 ¦ 81,7 ¦ 61 ¦
¦ 93,7 ¦ 8 ¦ 84,9 ¦ 35 ¦ 81,6 ¦ 62 ¦
¦ 93,0 ¦ 9 ¦ 84,6 ¦ 36 ¦ 81,5 ¦ 63 ¦
¦ 92,5 ¦ 10 ¦ 84,4 ¦ 37 ¦ 81,4 ¦ 64 ¦
¦ 92,0 ¦ 11 ¦ 84,3 ¦ 38 ¦ 81,3 ¦ 65 ¦
¦ 91,5 ¦ 12 ¦ 84,2 ¦ 39 ¦ 81,2 ¦ 66 ¦
¦ 91,1 ¦ 13 ¦ 84,1 ¦ 40 ¦ 81,1 ¦ 67 ¦
¦ 90,7 ¦ 14 ¦ 83,9 ¦ 41 ¦ 81,0 ¦ 68 ¦
¦ 90,5 ¦ 15 ¦ 83,8 ¦ 42 ¦ 80,9 ¦ 69 ¦
¦ 90,0 ¦ 16 ¦ 83,7 ¦ 43 ¦ 80,8 ¦ 70 ¦
¦ 89,5 ¦ 17 ¦ 83,5 ¦ 44 ¦ 80,7 ¦ 71 ¦
¦ 89,1 ¦ 18 ¦ 83,3 ¦ 45 ¦ 80,6 ¦ 72 ¦
¦ 88,8 ¦ 19 ¦ 83,2 ¦ 46 ¦ 80,5 ¦ 73 ¦
¦ 88,5 ¦ 20 ¦ 83,1 ¦ 47 ¦ 80,4 ¦ 74 ¦
¦ 88,1 ¦ 21 ¦ 83,0 ¦ 48 ¦ 80,3 ¦ 75 ¦
¦ 87,8 ¦ 22 ¦ 82,9 ¦ 49 ¦ 80,2 ¦ 76 ¦
¦ 87,5 ¦ 23 ¦ 82,8 ¦ 50 ¦ 80,1 ¦ 77 ¦
¦ 87,2 ¦ 24 ¦ 82,7 ¦ 51 ¦ 80,0 ¦ 78 ¦
¦ 87,1 ¦ 25 ¦ 82,6 ¦ 52 ¦ 79,9 ¦ 79 ¦
¦ 86,8 ¦ 26 ¦ 82,5 ¦ 53 ¦ 79,8 ¦ 80 ¦
¦ 86,6 ¦ 27 ¦ 82,4 ¦ 54 ¦ 79,7 ¦ 81 ¦
¦ 79,6 ¦ 82 ¦ 79,3 ¦ 86 ¦ 78,85 ¦ 90 ¦
¦ 79,5 ¦ 83 ¦ 79,2 ¦ 87 ¦ 78,8 ¦ 91 ¦
¦ 79,45 ¦ 84 ¦ 79,1 ¦ 88 ¦ 78,7 ¦ 92 ¦
¦ 79,4 ¦ 85 ¦ 79,0 ¦ 89 ¦ ¦ ¦
L-----------+---------+-----------+---------+-----------+----------
ОПРЕДЕЛЕНИЕ ПОКАЗАТЕЛЯ ПРЕЛОМЛЕНИЯ
(РЕФРАКТОМЕТРИЯ)
Показателем преломления (n) называют отношение скорости
распространения света в вакууме к скорости распространения света в
испытуемом веществе. Это абсолютный показатель преломления. На
практике определяют так называемый относительный показатель
преломления, т.е. отношение скорости распространения света в
воздухе к скорости распространения света в испытуемом веществе.
Показатель преломления зависит от температуры и длины волны
света, при которой проводят определение. В растворах показатель
преломления зависит также от концентрации вещества и природы
растворителя.
Рефрактометрия применяется для установления подлинности и
чистоты вещества. Метод применяют также для определения
концентрации вещества в растворе, которую находят по графику
зависимости показателя преломления от концентрации. На графике
выбирают интервал концентраций, в котором соблюдается линейная
зависимость между коэффициентом преломления и концентрацией. В
этом интервале концентрацию можно вычислить по формуле:
n - n0
X = ------,
F
где Х - концентрация раствора; n - показатель преломления
раствора; n0 - показатель преломления растворителя при той же
температуре; F - фактор, равный величине прироста показателя
преломления при увеличении концентрации на 1% (устанавливается
экспериментально).
Приборы, применяемые для определения показателя преломления,
называются рефрактометрами. Определение проводится при температуре
(20 +/- 0,3) град. C и длине волны линии D спектра натрия (589,3
нм). Показатель преломления, определенный при таких условиях,
20
обозначается индексом n .
D
Современные приборы откалиброваны таким образом, что отсчеты,
полученные по их шкалам, соответствуют показателям преломления для
D линии натрия, поэтому при проведении измерений следует соблюдать
указания в отношении соответствующего источника света, приведенные
в инструкции к приборам.
Обычно измерения показателя преломления проводят на
рефрактометрах типа Аббе, в основу которых положено явление
полного внутреннего отражения при прохождении светом границы
раздела двух сред с разными показателями преломления.
Диапазон измеряемых показателей преломления при измерении в
проходящем свете 1,3-1,7.
Точность измерения показателя преломления должна быть не ниже
-4
+/- 2 x 10 .
Могут быть использованы рефрактометры других типов с такой же
или большей точностью.
Рефрактометры юстируют по эталонным жидкостям, прилагаемым к
20
приборам, или дистиллированной воде, для которой n = 1,3330.
D
ОПРЕДЕЛЕНИЕ ОПТИЧЕСКОГО ВРАЩЕНИЯ
(ПОЛЯРИМЕТРИЯ)
Оптическое вращение - это способность вещества вращать
плоскость поляризации при прохождении через него поляризованного
света.
В зависимости от природы оптически активного вещества вращение
плоскости поляризации может иметь различное направление и
величину. Если от наблюдателя, к которому направлен свет,
проходящий через оптически активное вещество, плоскость
поляризации вращается по часовой стрелке, то вещество называют
правовращающим и перед его названием ставят знак "+", если же
плоскость поляризации вращается против часовой стрелки, то
вещество называют левовращающим и перед его названием ставят знак
"-".
Величину отклонения плоскости поляризации от начального
положения, выраженную в угловых градусах, называют углом вращения
и обозначают греческой буквой "альфа". Величина угла вращения
зависит от природы оптически активного вещества, длины пути
поляризованного света в оптически активной среде (чистом веществе
или растворе) и длины волны света. Для растворов величина угла
вращения зависит от природы растворителя и концентрации оптически
активного вещества. Величина угла вращения прямо пропорциональна
длине пути света в оптически активной среде, т.е. толщине слоя
оптически активного вещества или его раствора. Влияние температуры
в большинстве случаев незначительно.
Для сравнительной оценки способности различных веществ вращать
плоскость поляризации света вычисляют величину удельного вращения
["альфа"]. Удельное вращение - это константа оптически активного
вещества. Удельное вращение ["альфа"] определяют расчетным путем
как угол поворота плоскости поляризации монохроматического света
на пути длиной в 1 дм в среде, содержащей оптически активное
вещество, при условном приведении концентрации этого вещества к
значению, равному 1 г/мл.
Если нет специальных указаний, определение оптического
вращения проводят при температуре 20 град. С и при длине волны
линии D спектра натрия (589,3 нм). Соответствующую величину
20
удельного вращения обозначают ["альфа"] . Иногда для измерения
D
используют зеленую линию спектра ртути с длиной волны 546,1 нм.
При определении ["альфа"] в растворах оптически активного
вещества необходимо иметь в виду, что найденная величина может
зависеть от природы растворителя и концентрации оптически
активного вещества. Замена растворителя может привести к изменению
["альфа"] не только по величине, но и по знаку. Поэтому, приводя
величину удельного вращения, необходимо указывать растворитель и
выбранную для измерения концентрацию раствора.
Величину удельного вращения рассчитывают по одной из следующих
формул.
Для веществ, находящихся в растворе:
"альфа" 100
["альфа"] = -----------, (1)
lc
где "альфа" - измеренный угол вращения в градусах; l - толщина
слоя в дециметрах; с - концентрация раствора, выраженная в граммах
вещества на 100 мл раствора.
Для жидких веществ:
"альфа"
["альфа"] = -------, (2)
l"рo"
где "альфа" - измеренный угол вращения в градусах; l - толщина
слоя в дециметрах; "рo" - плотность жидкого вещества в граммах на
1 мл.
Удельное вращение определяют либо в пересчете на сухое
вещество, либо из высушенной навески, о чем в частных статьях
должно быть соответствующее указание.
Измерение величины угла вращения проводят либо для оценки
чистоты оптически активного вещества, либо для определения его
концентрации в растворе. Для оценки чистоты вещества по уравнению
(1) или (2) рассчитывают величину его удельного вращения
["альфа"]. Концентрацию оптически активного вещества в растворе
находят по формуле:
"альфа"100
c = -----------. (3)
["альфа"]l
Поскольку величина ["альфа"] постоянна только в определенном
интервале концентраций, возможность использования формулы (3)
ограничивается этим интервалом.
Измерение угла вращения проводят на поляриметре, позволяющем
определить величину угла вращения с точностью +/- 0,02 град.
Предназначенные для измерения угла вращения растворы или жидкие
вещества должны быть прозрачными. При измерении прежде всего
следует установить нулевую точку прибора или определить величину
поправки с трубкой, заполненной чистым растворителем (при работе с
растворами) или с пустой трубкой (при работе с жидкими
веществами). После установки прибора на нулевую точку или
определения величины поправки проводят основное измерение, которое
повторяют не менее 3 раз.
Для получения величины угла вращения "альфа" показания прибора,
полученные при измерениях, алгебраически суммируют с ранее
найденной величиной поправки.
ОПРЕДЕЛЕНИЯ, ОСНОВАННЫЕ НА ИЗМЕРЕНИИ
ПОГЛОЩЕНИЯ ЭЛЕКТРОМАГНИТНОГО ИЗЛУЧЕНИЯ
Фотометрические методы анализа основаны на избирательном
поглощении электромагнитного излучения анализируемым веществом и
служат для исследования строения, идентификации и количественного
анализа светопоглощающих соединений. В зависимости от используемой
аппаратуры в фотометрическом анализе различают
спектрофотометрические методы - анализ по поглощению веществами
монохроматического излучения; колориметрические и
фотоколориметрические - анализ по поглощению веществами
немонохроматического излучения.
Определения, связанные с измерением поглощения
электромагнитного излучения, основаны на двух законах. Закон
Бугера - Ламберта связывает поглощение с толщиной слоя
поглощающего вещества и выражается соотношением <*>:
-------------------------------
<*> Приведенные обозначения соответствуют ГОСТу 7601-78.
J -kb
--- = 10 ; (1)
J0
J0
lg ---- = kb, (2)
J
где J0 - интенсивность излучения, падающего на вещество; J -
интенсивность излучения, прошедшего через вещество; b - толщина
слоя вещества в сантиметрах; k - показатель поглощения <*> -
величина, обратная той толщине слоя, проходя через который поток
излучения ослабляется в 10 раз.
-------------------------------
<*> В литературе эта величина часто называется коэффициентом
погашения или коэффициентом экстинкции.
Закон Бера связывает поглощение с концентрацией поглощающего
вещества и обычно применяется для растворов:
k ="каппа"c, (3)
где с - концентрация раствора; "каппа" - показатель поглощения
раствора, концентрация которого равна единице.
На практике обычно используется объединенный закон Бугера -
Ламберта - Бера в виде:
J0
lg ---- ="каппа"cb. (4)
J
J0
Величина lg ----- носит название оптической плотности и
J
обозначается буквой D.
Величина "каппа" является специфической физической константой
для каждого вещества и может быть использована для целей
идентификации. Знание величины "каппа" позволяет определить
содержание данного вещества в растворах неизвестной концентрации
на основе измерения оптической плотности D.
Объединенный закон Бугера - Ламберта - Бера вполне справедлив
только для монохроматического излучения, поэтому строгим является
его применение в спектрофотометрии. В фотоколориметрии, где
измерения проводятся с помощью светофильтров, выделяющих
сравнительно узкий интервал длин волн, этот закон применим лишь с
большим или меньшим приближением в зависимости от степени
постоянства величины D в данном интервале длин волн.
СПЕКТРОФОТОМЕТРИЯ
Спектрофотометрия используется для идентификации соединений,
исследования состава, строения и количественного анализа
индивидуальных веществ и многокомпонентных систем. Кривая
зависимости поглощения (функция поглощения) от длины волны или
волнового числа называется спектром поглощения вещества и является
специфической характеристикой данного вещества.
В спектрофотометрических методах применяют спектрофотометры -
приборы, позволяющие проводить анализ как окрашенных, так и
бесцветных соединений по избирательному поглощению
монохроматического излучения в видимой, ультрафиолетовой и
инфракрасной областях спектра. Природа полос поглощения в
ультрафиолетовой и видимой областях спектра связана с различными
электронными переходами в поглощающих молекулах и ионах
(электронные спектры); в инфракрасной области она связана с
колебательными переходами и изменением колебательных состояний
ядер, входящих в молекулу поглощающего вещества (колебательные
спектры).
Распространенная в настоящее время аппаратура позволяет
измерять ультрафиолетовые спектры в области от 190 до 380 нм,
видимые - от 380 до 780 нм, инфракрасные спектры - от 780 до 40000
нм (40 мкм).
СПЕКТРОФОТОМЕТРИЯ В УЛЬТРАФИОЛЕТОВОЙ
И ВИДИМОЙ ОБЛАСТЯХ
Спектрофотометрические измерения в ультрафиолетовой и видимой
областях чаще всего проводят для растворов, хотя такие измерения
могут быть проведены и для веществ, находящихся в парообразном,
жидком и твердом состоянии.
Образец анализируемого вещества при спектрофотометрических
определениях обычно растворяют в соответствующем растворителе. Для
этих областей пригодны многие растворители, в том числе вода,
спирты, хлороформ, низшие углеводороды, эфиры, разведенные
растворы аммиака, едкого натра <*>, хлористоводородной или серной
кислоты. Следует использовать растворители, не содержащие
примесей, поглощающих в данной спектральной области; для
спектрофотометрии выпускаются специальные растворители,
гарантирующие отсутствие примесей.
--------------------------------
<*> Согласно принятой в стране терминологии (Химический
энциклопедический словарь, изд. Советская энциклопедия, М., 1983),
едкий натр называется гидроксид натрия, а едкое кали - гидроксид
калия.
Спектрофотометрический анализ по непосредственному измерению
оптической плотности может быть проведен для веществ, обладающих
лишь определенными особенностями строения (ароматические
соединения, соединения с сопряженными кратными связями, соединения
ряда металлов и др.).
Некоторые анализируемые вещества необходимо предварительно
перевести в соединение, поглощающее излучение.
Для определения концентрации растворов спектрофотометрическим
путем используется закон Бугера - Ламберта - Бера в форме:
1
c = --------- D. (5)
"каппа"b
В ряде случаев даже при использовании монохроматического
излучения могут наблюдаться отклонения от закона Бугера - Ламберта
- Бера, обусловленные процессами диссоциации, ассоциации и
комплексообразования. При наличии таких отклонений следует
пользоваться не формулой (5), а экспериментально найденной
зависимостью оптической плотности от концентрации.
Измерения оптической плотности D в ультрафиолетовой и видимой
области проводятся на фотоэлектрических спектрофотометрах.
Основными частями этих приборов являются: источник излучения
(лампа накаливания для видимой области, газоразрядная водородная
или дейтериевая лампа ультрафиолетовой области), монохроматор,
диспергирующая система которого основана на использовании
кварцевой призмы или дифракционной решетки, кюветное отделение, в
котором располагаются кюветы с исследуемыми веществами, приемное и
фотометрическое устройство для сравнительной оценки интенсивности
световых потоков J0 и J, основанное на использовании
фотоэлементов.
Измерительная шкала спектрофотометра проградуирована в
J
процентах пропускания Т (т.е. ---- 100) и в величинах оптической
J0 J0
плотности D (т.е. lg ----), а шкала длин волн или волновых чисел -
J
-1
в нанометрах или в см соответственно.
В процессе измерения на пути выходящего из монохроматора пучка
излучения определенной длины волны поочередно устанавливается
нулевой раствор (растворитель или раствор, содержащий те же
вещества, что и исследуемый, за исключением анализируемого
компонента), для которого Т = 100%, D = 0 и исследуемый раствор.
Для снижения величины ошибки при определении D концентрация
раствора и толщина слоя его подбираются такими, чтобы D в
исследуемой спектральной области находилось в пределах от 0,2 до
0,7. В зависимости от способности вещества к поглощению это обычно
достигается при использовании концентраций от 0,01 до 0,00001%
(кюветы с толщиной слоя 10 мм).
Показатель поглощения "каппа" вычисляют на основании измеренной
оптической плотности D для растворов с известной концентрацией по
формуле:
1
"каппа" = ----- D. (6)
cb
Концентрация "с" может быть выражена в молях на 1 л или в
граммах на 100 мл раствора. В зависимости от этого по формуле (6)
вычисляют молярный показатель поглощения или удельный показатель
поглощения.
Молярный показатель поглощения ("эпсилон") представляет собой
оптическую плотность одномолярного раствора вещества при толщине
1%
слоя 10 мм; удельный показатель поглощения (E ) - оптическую
1 см
плотность раствора, содержащего 1 г вещества в 100 мл раствора при
той же толщине слоя. Переход от удельного показателя поглощения к
молярному осуществляется по формуле:
1% M
"эпсилон" = E ----, (7)
1 см 10
где М - молекулярная масса.
1%
Если известно значение "каппа" (в форме "эпсилон" или E ),
1 см
определяютко нцентрацию исследуемых растворов по величине
оптической плотности D, пользуясь формулой (5) (при условии
подчинения закону Бера).
Для идентификации веществ в ультрафиолетовой области спектра
рекомендуется применять регистрирующие спектрофотометры.
При измерениях на разных спектрофотометрах значения характерных
длин волн могут отличаться на +/-2 нм. Если отличие превышает
указанный предел, то необходимо провести калибровку шкалы длин
волн.
При количественных определениях целесообразно использовать
такие полосы поглощения, которые отвечают следующим условиям:
1) данная полоса должна быть по возможности свободна от
наложения полос поглощения других компонентов анализируемой
системы;
2) выбранная полоса должна обладать достаточно высоким
показателем поглощения ("каппа") для индивидуального соединения.
Такие полосы называются аналитическими.
При анализе используют максимум или минимум полосы поглощения и
не следует производить измерения на участках крутого спада или
подъема кривой.
Для многокомпонентных систем выделение аналитических полос для
каждого отдельного компонента становится затруднительным, тогда
количественные определения могут быть произведены путем измерения
оптической плотности при нескольких значениях длин волн и решения
системы линейных уравнений, связывающих суммарную величину
оптической плотности смеси при данной длине волны с величиной
оптической плотности для каждого индивидуального компонента.
Например, для системы двух окрашенных веществ, спектры
поглощения которых накладываются друг на друга, определение
концентраций с1 и с2 раствора ведется при двух длинах волн по
уравнениям:
D = "эпсилон1" c1b + "эпсилон2" c2b;
"лямбда1" "лямбда1" "лямбда1"
(8)
D = "эпсилон1" c1b + "эпсилон2" c2b;
"лямбда2" "лямбда2" "лямбда2"
где D и D - измеренные экспериментально
"лямбда1" "лямбда2"
оптические плотности смеси двух веществ при длинах волн "лямбда1"
и "лямбда2"; "эпсилон1" и "эпсилон1" - молярные
"лямбда1" "лямбда2"
коэффициенты поглощения одного вещества при длинах волн "лямбда1"
и "лямбда2"; "эпсилон2" и "эпсилон2" - молярные
"лямбда1" "лямбда2"
коэффициенты поглощения второго вещества при длинах волн "лямбда1"
и "лямбда2"; b - толщина слоя вещества в сантиметрах.
Значения молярных коэффициентов поглощения определяют
экспериментально, измеряя оптические плотности стандартных
растворов каждого вещества при "лямбда1" и "лямбда2". Систему
уравнений (8) решают относительно двух неизвестных концентраций с1
и с2.
Относительная ошибка спектрофотометрических определений
индивидуальных соединений обычно не превышает 2%, при анализе
смесей ошибка определения возрастает.
В ряде случаев для идентификации и количественного определения
веществ методом спектрофотометрии требуется сравнение с
химическими стандартными образцами.
Для проверки пропускания шкалы спектрофотометров используют
стандартный образец бихромата калия. Ниже приводятся допустимые
значения оптической плотности раствора стандартного образца
бихромата калия, содержащего 60,06 мг в 1000 мл раствора серной
кислоты (0,005 моль/л), при толщине слоя 10 мм.
-------------------------------T--------T-------T-------T--------¬
¦ Длина волны ("лямбда"), нм ¦ 235 ¦ 257 ¦ 313 ¦ 350 ¦
+------------------------------+--------+-------+-------+--------+
¦ Оптическая плотность ¦ 0,748 ¦ 0,845 ¦ 0,292 ¦ 0,640 ¦
L------------------------------+--------+-------+-------+---------
СПЕКТРОФОТОМЕТРИЯ В ИНФРАКРАСНОЙ ОБЛАСТИ
Поглощением в инфракрасной области обладают молекулы, дипольные
моменты которых изменяются при возбуждении колебательных движений
ядер. Инфракрасные спектры могут быть получены в различных
агрегатных состояниях веществ и используются для идентификации,
количественного анализа, а также для исследования строения
молекул.
Измерения проводят на однолучевых и двухлучевых инфракрасных
спектрофотометрах, снабженных диспергирующими системами в виде
призм и диффракционных решеток.
Наиболее часто используется спектральная область от 2,5 до 20
-1
мкм (4000 - 500 см ).
Каждый инфракрасный спектр характеризуется серией полос
поглощения, максимумы которых определяются волновым числом
"эпсилон" или длиной волны "лямбда" и интенсивностью максимумов
поглощения.
-1
Волновое число "ни", измеряемое в обратных сантиметрах (см ),
4
10
определяется из соотношения "ни" = --------, где "лямбда" - длина
"лямбда"
волны в микрометрах (мкм).
Обычно при записи спектра на оси абсцисс откладывается в
-1
линейной шкале значение волнового числа "ни" (в см ), на оси
ординат - величина пропускания Т (в %).
Подготовку образцов к снятию инфракрасных спектров проводят по
следующим методикам.
1. Для твердых веществ. а) Пасты: тщательно смешивают 10-20 мг
твердого вещества с 1-2 каплями иммерсионной жидкости (вазелиновое
масло, полифторуглеводород, гексахлорбутадиен и др.),
приготовленную пасту сдавливают между двумя пластинками из NaCl
(или KBr) и помещают в спектрофотометр для измерения. Во второй
канал прибора помещают слой иммерсионной жидкости между
пластинками NaCl (или КВr).
б) Диски с KBr: навеску твердого вещества (1-3 мг) тщательно
смешивают в вибромельнице или в ступке со спектроскопически чистым
бромидом калия (150-200 мг) и смесь прессуют при давлении 7,5-10
т/кв. см в течение 2-5 мин. под вакуумом 2-3 мм рт. ст.
Спектр полученного образца снимают относительно воздуха или
относительно диска, приготовленного из чистого КВr, помещенного во
второй канал прибора.
2. Для жидких веществ. Тонкую пленку жидкости зажимают между
пластинками из NaCl (или КВr) или используют кюветы с малой
толщиной слоя (0,01-0,05 мм). Во второй канал прибора помещают
чистую пластинку NaCl (или КВr) удвоенной толщины или
соответствующие пустые кюветы.
3. Растворы. Раствор исследуемого образца (жидкого или
твердого) в подходящем органическом растворителе (обычно
используемые концентрации приблизительно 0,5-1,5%) вводят в кювету
с толщиной слоя 0,1-1 мм. Спектр раствора снимают относительно
чистого растворителя.
В качестве растворителей наиболее часто применяют
четыреххлористый углерод и хлороформ.
Применение инфракрасных спектров для исследования строения
веществ основано главным образом на использовании
характеристических полос поглощения (полосы, связанные с
колебаниями функциональных групп или связей в молекулах). Такими
характеристическими полосами поглощения обладают группы -ОН, -NH2,
_
-NO2, =C=O, -C=N и др.
Идентификация лекарственного вещества может быть проведена
путем сопоставления ИК-спектра исследуемого вещества с аналогичным
спектром его стандартного образца или с его стандартным спектром.
В первом случае ИК-спектры снимают последовательно на одном и том
же приборе в одинаковых условиях (агрегатное состояние образца,
концентрация вещества, скорость регистрации и т.п.).
Во втором случае следует строго руководствоваться условиями,
приведенными для стандартного спектра (концентрация вещества,
степень пропускания для основных полос и т.п.).
Обычно используют ИК-спектры, снятые с таблетками бромида калия
или с пастами (суспензиями) в вазелиновом масле.
Сопоставление ИК-спектров рекомендуется начинать с анализа
характеристических полос, которые обычно хорошо проявляются на
спектрах, и лишь при их совпадении сопоставляют низкочастотную
область.
-1
Для низкочастотного интервала 1350-400 см характерен
специфический набор полос, который называют областью "отпечатков
пальцев".
Полное совпадение полос поглощения в ИК-спектрах
свидетельствует об идентичности вещества. Полиморфные модификации
одного и того же вещества могут давать различные спектры. В этом
случае для проверки идентичности сопоставляют спектры их растворов
или, растворив каждое вещество в одном и том же растворителе,
упаривают растворитель досуха и сравнивают спектры твердых
остатков.
Наряду с положением полос поглощения существенной
характеристикой веществ является интенсивность полос поглощения,
которая может быть охарактеризована в спектрах величиной
показателя поглощения ("каппа") или величиной интегральной
интенсивности поглощения (А), равной площади огибаемой кривой
поглощения.
Интенсивности поглощения могут быть использованы для
установления строения вещества и для количественного анализа.
Колориметрия
Колориметрический метод основан на визуальном сравнении
интенсивностей окрасок растворов разных концентраций при помощи
несложных приборов: колориметрических пробирок, цилиндров с
кранами, колориметров и фотометров. В колориметрии не требуется
соблюдение закона Бера. Измерения проводят посредством следующих
операций:
а) окрашенную пробу и стандарт разбавляют в сосудах одинакового
диаметра до совпадения окрасок (метод уравнивания);
б) уравнивают окраски исследуемого окрашенного раствора с
раствором, содержащим все вещества, за исключением анализируемого,
добавляя к нему раствор этого вещества в известной концентрации
(колориметрическое титрование);
в) готовят набор стандартов с различной концентрацией вещества
и подбирают совпадение окрасок пробы и одного из стандартов (метод
стандартных серий).
Фотоколориметрия
Фотоколориметрический метод основан на измерении степени
поглощения немонохроматического света испытуемым веществом с
помощью фотоэлектроколориметров. Для определения концентраций
растворов фотоколориметрическим методом пользуются формулой (5).
Величину "каппа" и "каппа"b определяют путем проведения серии
предварительных измерений для растворов с известной концентрацией
исследуемого вещества.
_
При отсутствии линейной зависимости между "с" и D для
определения "с" следует пользоваться калибровочными графиками,
построенными для каждого определяемого вещества.
Наиболее распространенными являются две принципиальные схемы
фотоэлектроколориметров:
1) схема прямого действия с одним фотоэлементом,
предусматривающая измерение оптической плотности по силе фототока,
регистрируемой гальванометром;
2) дифференциальная схема с двумя фотоэлементами, рассчитанная
на попадание пучков света, проходящих соответственно через
испытуемый и нулевой растворы, на два разных фотоэлемента.
Фототоки уравнивают с помощью потенциометра (электрическая
компенсация) или диафрагмы, уменьшающей интенсивность одного из
световых пучков (оптическая компенсация).
По шкале потенциометра или диафрагмы отсчитывают оптическую
плотность в момент равенства фототоков, когда стрелка
регистрирующего гальванометра находится на нуле.
Относительная ошибка фотоколориметрических методов обычно не
превышает 3%, колориметрических - 5%.
Дифференциальная спектрофотометрия
и фотоколориметрия
Дифференциальный метод анализа используют для повышения
точности спектрофотометрических и фотоколориметрических измерений
при определении высоких концентраций веществ (от 10 до 100%).
Сущность метода заключается в измерении светопоглощения
анализируемого раствора относительно раствора сравнения,
содержащего определенное количество испытуемого вещества; это
приводит к изменению рабочей области шкалы прибора и снижению
относительной ошибки анализа до 0,5-1%.
Если рассматривать прохождение лучей света одинаковой
интенсивности через три кюветы, которые содержат растворитель с0 и
растворы с различной концентрацией испытуемого вещества c1 и с2,
причем с1 < с2, то интенсивность излучения прошедшего через
раствор поглощающего вещества с концентрацией с1, относительно
раствора сравнения может быть записана выражением
-kbc1
J1 = J0 x 10 , (9)
а для раствора с концентрацией с2:
-kbc2
J2 = J0 x 10 . (10)
Отношение интенсивности света, прошедшего через растворы
концентрации с2 и с1, именуемое "относительной пропускаемостью",
будет равно:
-kbc2
J2 J0 x 10 -kb(с2 - с1) -kb"ДЕЛЬТА"с
-- = ------------- = 10 = 10 ; (11)
-kbc1
J1 J0 x 10
J1
Спектроскопические
методы анализа основаны на избирательном
поглощении электромагнитного излучения
анализируемым веществом и служат для
исследования строения, идентификации
и количественного определения
светопоглощающих соединений.
В
зависимости от используемой аппаратуры
в фармацевтическом анализе различают
следующие методы анализа, основанные
на поглощении электромагнитного
излучения и испускании света:
—
спектрофотометрия в ультрафиолетовой
(УФ) и видимой областях;
—
спектрофотометрия в инфракрасной (ИК)
области;
—
атомно-эмиссионная и атомно-абсорбционная
спектроскопия (АЭС и ААС);
—
флуориметрия;
—
спектроскопия ядерного магнитного
резонанса (ЯМР).
Ряд
длин волн, для которых проводятся
измерения методами абсорбционной
спектрофотометрии, охватывает спектральную
область от коротких длин волн в УФ-области
до ИК-области. Для удобства отнесений
этот спектральный ряд делится на
следующие диапазоны длин волн: УФ (от
190 до 380 нм), видимый (от 380 до 780 нм), ИК (от
0,78 до 400 мкм).
12.1. Спектрофотометрия в ультрафиолетовой и
ВИДИМОЙ
ОБЛАСТЯХ (ОФС 42-0042-07)
Уменьшение
величины монохроматического излучения,
проходящего через гомогенную поглощающую
среду, количественно описывается законом
Бугера-Ламберта-Бера:
log10(1/T)
= A = эпсилон x c x b,
(1)
где:
T
— пропускание; T — I/I ;
o
I
— интенсивность прошедшего монохроматического
излучения;
I
— интенсивность падающего монохроматического
излучения;
o
эпсилон
— молярный показатель поглощения;
c
— молярная концентрация вещества в
растворе;
b
— длина оптического пути или толщина
слоя, в сантиметрах.
Величина
log10(1/T) носит название оптической
плотности, обозначается буквой A и
является измеряемой величиной. В
отсутствии других физико-химических
факторов измеренная оптическая плотность
(A) пропорциональна концентрации вещества
в растворе (c) и толщине слоя (b).
1%
Величина
A представляет собой удельный показатель
поглощения, т.е.
1
см
оптическую
плотность раствора вещества с
концентрацией 10 г/л (1 г/100 мл)
1%
в
кювете с толщиной слоя 1 см. Величины
A и эпсилон связаны
1
см
соотношением:
1%
10 x эпсилон
A
= ————-, (2)
1
см М.м.
где
М.м. — молекулярная масса исследуемого
вещества.
Измерение
оптической плотности. Если нет других
указаний в частной статье, измерение
оптической плотности проводят при
указанной длине волны с использованием
кювет с толщиной слоя 1 см и при температуре
(20 +/- 1) град. C по сравнению с тем же
растворителем или той же смесью
растворителей, в которой растворено
вещество. При измерении оптической
плотности раствора при данной длине
волны оптическая плотность кюветы с
растворителем, измеренная против воздуха
при той же длине волны, не должна превышать
0,4 и желательно, чтобы она была менее
0,2. Для снижения величины ошибки при
определении оптической плотности
концентрация раствора (а иногда и толщина
слоя) подбираются таким образом, чтобы
оптическая плотность в исследуемой
спектральной области находилась в
пределах от 0,2 до 0,8.
Спектр
поглощения представляют таким образом,
чтобы оптическая плотность или ее
некоторая функция были приведены по
оси ординат, а длина волны или некоторая
функция длины волны — по оси абсцисс.
Если
в частной статье для максимума поглощения
указывается только одна длина волны,
то это означает, что полученное значение
максимума не должно отличаться от
указанного более чем на +/- 2 нм.
Приборы.
Спектрофотометры, предназначенные для
измерений в ультрафиолетовой и видимой
областях спектра, состоят из оптической
системы, выделяющей монохроматическое
излучение в области от 190 до 780 нм и
обеспечивающей его прохождение через
образец, и устройства для измерения
оптической плотности.
Основными
частями этих приборов являются: источник
излучения, диспергирующий прибор (призма
или решетка), щель для выделения полосы
длин волн, кюветы для образцов, детектор
излучаемой энергии, встроенные усилители
и измерительные приборы.
Проверка
шкалы длин волн в УФ и видимой области.
Точность калибровки прибора по шкале
длин волн в спектральном ряду проверяют
по приведенным в табл. 12.1.1 спектральным
линиям водородной (Hбета) или дейтериевой
(Dбета) разрядной лампы, линиям паров
ртути (Hg) кварцево-ртутной дуговой лампы,
а также по максимумам поглощения раствора
гольмия перхлората (Ho) (готовый реактив
для калибровки спектрофотометра
представляет собой 4% раствор гольмия
оксида в 1,4 М растворе хлорной кислоты).
Допустимое отклонение составляет +/- 1
нм для ультрафиолетовой и +/- 3 нм для
видимой области.
Таблица
12.1.1
Спектральные
линии для проверки шкалы длин волн
|
241,15 |
404,66 |
|
253,7 |
435,83 |
|
287,15 |
486,0 |
|
302,25 |
486,1 |
|
313,16 |
536,3 |
|
334,15 |
546,07 |
|
361,5 |
576,96 |
|
365,48 |
579,07 |
Шкала
длин волн может быть калибрована также
при помощи подходящих стеклянных
фильтров, которые имеют фиксированные
полосы поглощения в видимой и УФ-областях,
а также стандартных стекол, содержащих
дидим (смесь празеодима и неодима), и
стекол, содержащих гольмий.
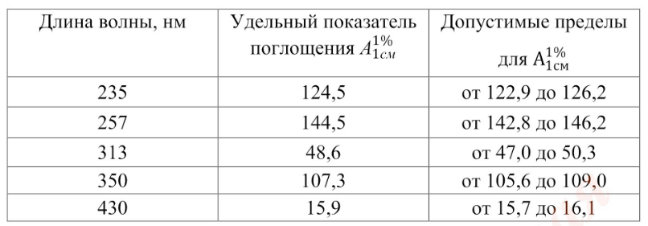
Проверка
шкалы оптической плотности. Для
проверки шкалы оптической
плотности
используют стандартные неорганические
стеклянные фильтры или
раствор
калия дихромата при длинах волн,
указанных в табл. 12.1.2, где для
каждой
длины волны приведено точное
значение удельного показателя
1%
поглощения
A и допустимые пределы.
1
см
Раствор
калия дихромата готовят следующим
образом:
от
57,0 до 63,0 мг (точная навеска) калия
дихромата, предварительно высушенного
до постоянной массы при температуре
130 град. C, растворяют в 0,005 М растворе
серной кислоты и доводят объем раствора
тем же растворителем до 1000 мл.
Таблица
12.1.2
Удельный
показатель поглощения стандартов при
различных
длинах волн
┌─────────────────────┬─────────────────────────┬─────────────────────────┐
│ Длина
волны, в │ Удельный показатель │
Допустимые пределы │
│ нанометрах
│ поглощения │ 1%
│
│ │ 1%
│ для A │
│ │ A
│ 1 см │
│ │ 1
см │ │
├─────────────────────┼─────────────────────────┼─────────────────────────┤
│ 235
│ 124,5 │ От 122,9 до 126,2 │
├─────────────────────┼─────────────────────────┼─────────────────────────┤
│ 257
│ 144,5 │ От 142,8 до 146,2 │
├─────────────────────┼─────────────────────────┼─────────────────────────┤
│ 313
│ 48,6 │ От 47,0 до 50,3 │
├─────────────────────┼─────────────────────────┼─────────────────────────┤
│ 350
│ 107,3 │ От 105,6 до 109,0 │
└─────────────────────┴─────────────────────────┴─────────────────────────┘
Предельный
уровень рассеянного света. Рассеянный
свет может быть обнаружен при данной
длине волны с использованием соответствующих
фильтров или растворов: например,
оптическая плотность раствора 12 г/л
калия хлорида в кювете с толщиной слоя
1 см при 200 нм при использовании воды в
качестве раствора сравнения должна
быть больше 2.
Разрешающая
способность (для качественного анализа).
Если есть указание в частной статье,
определяют разрешающую способность
спектрофотометра следующим образом.
Записывают спектр 0,02% (об/об) раствора
толуола в гексане. Минимально допустимое
значение отношения оптической плотности
в максимуме поглощения при 269 нм к
оптической плотности в минимуме
поглощения при 266 нм указывают в частной
статье.
Ширина
спектральной щели (для количественного
анализа). В случае использования
спектрофотометра с изменяемой шириной
спектральной щели при выбранной длине
волны возможны погрешности, связанные
с шириной этой щели. Для их исключения
ширина щели должна быть малой по сравнению
с полушириной полосы поглощения (шириной
на половине оптической плотности) и в
то же время должна быть максимально
велика для получения высокого значения
интенсивности падающего монохроматического
излучения (Io). Таким образом, ширина щели
должна быть такой, чтобы дальнейшее ее
уменьшение не изменяло величину
измеряемой оптической плотности.
Кюветы.
Допустимые отклонения в толщине слоя
используемых кювет должны быть не более
+/- 0,005 см. Кюветы, предназначенные для
испытуемого раствора и раствора
сравнения, должны иметь одинаковое
пропускание (или оптическую плотность)
при заполнении одним и тем же растворителем.
В противном случае это различие следует
учитывать.
Требования
к растворителям. Для определений,
производимых в ультрафиолетовой и
видимой областях, образец анализируемого
вещества растворяют в соответствующем
растворителе, который должен быть
оптически прозрачным в используемой
области длин волн. Для этих областей
длин волн пригодны многие растворители,
в том числе вода, спирты, хлороформ,
низшие углеводороды, эфиры и разбавленные
растворы сильных кислот и щелочей.
Идентификация
Абсорбционную
спектрофотометрию в ультрафиолетовой
и видимой областях спектра применяют
для определения подлинности лекарственных
средств путем:
—
сравнения спектров поглощения испытуемого
раствора и раствора стандартного
образца; в указанной области спектра
должно наблюдаться совпадение положений
максимумов, минимумов, плеч и точек
перегиба;
—
указания положений максимумов, минимумов,
плеч и точек перегиба; расхождение между
наблюдаемыми и указанными длинами волн
в максимумах и минимумах поглощения не
должно обычно превышать +/- 2 нм.
Возможны
и другие варианты применения, оговоренные
в частных фармакопейных статьях.
Количественное
определение
Определение
концентрации веществ спектрофотометрическим
методом основано на использовании
закона Бугера-Ламберта-Бера в форме:
A
C
= ———-, (3)
1%
A
x b
1
см
где:
C
— концентрация вещества в г/100 мл;
A
— оптическая плотность испытуемого
раствора;
1%
A
— удельный показатель поглощения
вещества;
1
см
b
— толщина поглощающего слоя, в сантиметрах.
В
ряде случаев даже при использовании
монохроматического излучения могут
наблюдаться отклонения от закона
Бугера-Ламберта-Бера, обусловленные
процессами диссоциации, ассоциации и
комплексообразования. Поэтому
предварительно следует проверить
линейность зависимости оптической
плотности раствора от концентрации в
аналитической области. При наличии
отклонений от линейной зависимости
следует пользоваться не формулой (3), а
экспериментально найденной зависимостью.
Обычно
определение концентрации
спектрофотометрическим методом проводят
с использованием стандартного образца.
Расчет концентрации основан на
использовании уравнения:
C
A
—
= —, (4)
C
A
o
o
где:
C
и C — концентрации испытуемого раствора
и раствора стандартного
o
образца соответственно;
A
и A — оптические плотности испытуемого
раствора и раствора
o
стандартного образца соответственно.
Вначале
измеряют оптическую плотность раствора
стандартного образца, приготовленного,
как указано в частной фармакопейной
статье, затем проводят измерение
оптической плотности испытуемого
раствора. Второе измерение проводят
сразу после первого, с использованием
той же кюветы, в тех же экспериментальных
условиях.
Метод
с использованием стандартного образца
является более точным и надежным.
Возможность применения значения
удельного показателя поглощения в
каждом конкретном случае следует
обосновывать. Обычно метод с использованием
значения удельного показателя поглощения
применим при допусках содержания
анализируемого вещества не менее +/- 10%
от номинального содержания.
Многокомпонентный
спектрофотометрический анализ
Многокомпонентный
спектрофотометрический анализ (анализ
смесей) применяют для одновременного
количественного определения нескольких
компонентов лекарственных средств,
каждое из которых подчиняется закону
Бугера-Ламберта-Бера.
Количественное
определение в многокомпонентном
спектрофотометрическом анализе
основывается обычно на использовании
уравнения:
m
А
= SUM E x c i = 1,…n, (5)
i
j = 1 ij j
где:
А
— оптическая плотность испытуемого
раствора при i-ой длине волны;
i
E
— показатели поглощения (зависящие
от способа выражения
Ij
концентрации)
j-го компонента образца при i-ой
аналитической длине волны;
c
— концентрация j-го компонента образца.
j
Соответствующие
методики проведения анализа и расчетные
формулы указываются в частных фармакопейных
статьях.
Производная
спектрофотометрия
В
производной спектрофотометрии исходные
спектры поглощения (нулевого порядка)
преобразуются в спектры производных
первого, второго и более высокого
порядков.
Спектр
первой производной представляет собой
график зависимости градиента кривой
поглощения (скорость изменения оптической
плотности с длиной волны, d A/d лямбда) от
длины волны.
Спектр
второй производной представляет
собой график зависимости
2
2
кривизны
спектра поглощения (d А/d лямбда ) от
длины волны. Вторая
производная
при любой длине волны связана с
концентрацией следующим
соотношением:
2
1%
2
d A
d
A 1 см
———
= ———- x c x l, (6)
2
2
d
лямбда d лямбда
где:
A
— оптическая плотность при длине волны
лямбда;
1%
A
— удельный показатель поглощения при
длине волны лямбда;
1
см
c
— концентрация вещества в растворе, в
граммах/100 мл;
l
— толщина слоя, в сантиметрах.
Производная
спектрофотометрия может быть использована
как для целей идентификации веществ,
так и их количественного определения
в многокомпонентных смесях, а также в
тех случаях, когда имеется фоновое
поглощение, вызванное присутствием
веществ, содержание которых не
регламентируется.
Приборы.
Используют спектрофотометры, отвечающие
указанным выше требованиям и оснащенные
аналоговым резистентно-емкостным
дифференцирующим модулем или цифровым
дифференциатором, или другими средствами
получения производных спектров, в
соответствии с инструкцией к прибору.
Некоторые методы получения спектров
второй производной приводят к смещению
длин волн относительно исходного
спектра, что следует учитывать там, где
это необходимо.
Разрешающая
способность. Если указано в частных
фармакопейных статьях, записывают
спектр второй производной для раствора
0,2 г/л толуола в метаноле, используя
метанол в качестве раствора сравнения.
На спектре должен присутствовать
небольшой отрицательный экстремум,
расположенный между двумя большими
отрицательными экстремумами при 261 нм
и 268 нм, в соответствии с рис. 12.1.1. (не
приводится). Если нет других указаний
в частных фармакопейных статьях,
отношение A/B должно быть не менее 0,2.
Методика.
Процедура анализа аналогична применяемой
в обычной спектрофотометрии, но вместо
оптических плотностей используют
производные. Готовят раствор испытуемого
образца, настраивают прибор в соответствии
с инструкцией производителя и рассчитывают
количество определяемого вещества, как
указано в частной фармакопейной статье.
Рис.
12.1.1. Спектр второй производной раствора
толуола
(0,2 г/л) в метаноле
Рисунок
не приводится.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Оптическая плотность раствора
Колориметрия
Из оптических методов анализа в практике аналитических лабораторий наиболее широко применяются колориметрические методы (от лат. color — цвет и греч. μετρεω — измеряю). Колориметрические методы основаны на измерении интенсивности светового потока, прошедшего через окрашенный раствор.
В колориметрическом методе используются химические реакции, сопровождающиеся изменением цвета анализируемого раствора. Измеряя светопоглощение такого окрашенного раствора или сравнивая полученную окраску с окраской раствора известной концентрации, определяют содержание окрашенного вещества в испытуемом растворе.
Существует зависимость между интенсивностью окраски раствора и содержанием в этом растворе окрашенного вещества. Эта зависимость, называемая основным законом светопоглощения (или законом Бугера—Ламберта—Бера), выражается уравнением:
I = I0 10 — ε c l
где I — интенсивность света, прошедшего через раствор; I0 — интенсивность падающего на раствор света; ε- коэффициент светопоглощения, постоянная величина для каждого окрашенного вещества, зависящая от его природы; С — молярная концентрация окрашенного вещества в растворе; l — толщина слоя светопоглощающего раствора, см.
Физический смысл этого закона можно выразить следующим образом. Растворы одного и того же окрашенного вещества при одинаковой концентрации этого вещества и толщине слоя раствора поглощают равное количество световой энергии, т. е. светопоглощение таких растворов одинаковое.
Для окрашенного раствора, заключенного в стеклянную кювету с параллельными стенками, можно сказать, что по мере увеличения концентрации и толщины слоя раствора его окраска увеличивается, а интенсивность света I, прошедшего через поглощающий раствор, уменьшается по сравнению с интенсивностью падающего света I0.
Рис.1 Прохождение света через кювету с исследуемым раствором.
Оптическая плотность раствора.
Если прологарифмировать уравнение основного закона светопоглощения и изменить знаки на обратные, то уравнение принимает вид:
Величина 
A = ε C l
Из этого уравнения вытекает, что оптическая плотность раствора прямо пропорциональна концентрации окрашенного вещества и толщине слоя раствора.
Другими словами, при одинаковой толщине слоя раствора данного вещества оптическая плотность этого раствора будет тем больше, чем больше в нем содержится окрашенного вещества. Или, наоборот, при одной и той же концентрации данного окрашенного вещества оптическая плотность раствора зависит только от толщины его слоя. Отсюда может быть сделан следующий вывод: если два раствора одного и того же окрашенного вещества имеют различную концентрацию, одинаковая интенсивность окраски этих растворов будет достигнута при толщинах их слоев, обратно пропорциональных концентрациям растворов. Этот вывод очень важен, так как на нем основаны некоторые методы колориметрического анализа.
Таким образом, чтобы определить концентрацию (С) окрашенного раствора, необходимо измерить его оптическую плотность (A). Чтобы измерить оптическую плотность, следует измерить интенсивность светового потока.
Интенсивность окраски растворов можно измерять различными методами. Различают субъективные (или визуальные) методы колориметрии и объективные (или фотоколориметрические).
Визуальными называются такие методы, при которых оценку интенсивности окраски испытуемого раствора делают невооруженным глазом.
При объективных методах колориметрического определения для измерения интенсивности окраски испытуемого раствора вместо непосредственного наблюдения пользуются фотоэлементами. Определение в этом случае проводят в специальных приборах — фотоколориметрах, откуда и метод получил название фотоколориметрического.
Визуальные методы
К визуальным методам относятся:
1) метод стандартных серий;
2) метод дублирования (колориметрическое титрование);
3) метод уравнивания.
Метод стандартных серий. При выполнении анализа методом стандартных серий интенсивность окраски анализируемого окрашенного раствора сравнивают с окрасками серии специально приготовленных стандартных растворов (при одинаковой толщине поглощающего слоя).
Растворы в колориметрии обычно имеют интенсивную окраску, поэтому имеется возможность определять весьма небольшие концентрации или количества веществ. Однако это может сопровождаться определенными трудностями: так навески для приготовления серии стандартных растворов могут быть очень малы. Для преодоления этих трудностей готовят стандартный раствор А достаточно высокой концентрации, например 1 мг/мл. После этого путем разбавления из раствора А готовят стандартный раствор В значительно меньшей концентрации, а из него в свою очередь готовят серию стандартных растворов.
Для этого в пробирки или кюветы одинакового размера и одинакового цвета стекла пипеткой добавляются необходимые объемы растворов реагентов в нужной последовательности. Порции растворов определяемого вещества целесообразно добавлять из бюретки, т.к. их объемы будут различны для обеспечения различных концентраций в серии стандартных растворов. При этом начальный раствор должен содержать все компоненты, кроме определяемого вещества (нулевой раствор). В исследуемый раствор добавляют растворы необходимых реагентов. Все растворы доводят до постоянного объема, а затем визуально сравнивают интенсивность окраски исследуемого раствора с растворами серии стандартных растворов. Возможно совпадение интенсивности окраски с каким-либо раствором серии. Тогда считается, сто исследуемый раствор имеет такую же концентрацию или содержит столько же определяемого вещества. Если же интенсивность окраски покажется промежуточной между соседними растворами серии, концентрация или содержание определяемого компонента считают средним арифметическим между растворами серии.
Колориметрическое титрование (метод дублирования). Этот метод основан на сравнении окраски анализируемого раствора с окраской другого раствора— контрольного. Для приготовления контрольного раствора готовят раствор, содержащий все компоненты исследуемого раствора, за исключением определяемого вещества, и все употреблявшиеся при подготовке пробы реактивы, и к нему добавляют из бюретки стандартный раствор определяемого вещества. Когда этого раствора будет добавлено столько, что интенсивности окраски контрольного и анализируемого раствора уравняются, считают, что в анализируемом растворе содержится столько же определяемого вещества, сколько его было введено в контрольный раствор.
Метод уравнивания.Этот метод основан на уравнивании окрасок анализируемого раствора и раствора с известной концентрацией определяемого вещества — стандартного раствора. Существуют два варианта выполнения колориметрического определения этим методом.
По первому варианту уравнивание окрасок двух растворов с разной концентрацией окрашенного вещества проводят путем изменения толщины слоев этих растворов при одинаковой силе проходящего через растворы светового потока. При этом, несмотря на различие концентраций анализируемого и стандартного растворов, интенсивность светового потока, проходящего через оба слоя этих растворов, будет одинакова. Соотношение между толщинами слоев и концентрациями окрашенного вещества в растворах в момент уравнивания окрасок будет выражаться уравнением:
где l1 — толщина слоя раствора с концентрацией окрашенного вещества C1, а l2-толщина слоя раствора с концентрацией окрашенного вещества C2.
В момент равенства окрасок отношение толщин слоев двух сравниваемых растворов обратно пропорционально отношению их концентраций.
На основании приведенного уравнения, измерив толщину слоев двух одинаково окрашенных растворов и зная концентрацию одного из этих растворов, легко можно рассчитать неизвестную концентрацию окрашенного вещества в другом растворе.
Для измерения толщины слоя, через который проходит световой поток, можно применять стеклянные цилиндры или пробирки, а при более точных определениях специальные приборы — колориметры.
По второму варианту, для уравнивания окрасок двух растворов с различной концентрацией окрашенного вещества, через слои растворов одинаковой толщины пропускают световые потоки различной интенсивности.
В этом случае оба раствора имеют одинаковую окраску, когда отношение логарифмов интенсивностей падающих световых потоков равно отношению концентраций.
В момент достижения одинаковой окраски двух сравниваемых растворов, при равной толщине их слоев, концентрации растворов прямо пропорциональны логарифмам интенсивностей падающего на них света.
По второму варианту определение может быть выполнено только с помощью колориметра.
Теоретические основы определения оптической плотности раствора
Любая частица, будь то молекула, атом или ион, в результате поглощения кванта света переходит на более высокий уровень энергетического состояния. Чаще всего осуществляется переход из основного в возбужденное состояние. Это вызывает появление в спектрах определенных полос поглощения.
Поглощение излучения приводит к тому, что при пропускании его через вещество интенсивность этого излучения снижается при увеличении количества частиц вещества, обладающего некоторой оптической плотностью. Этот метод исследования предложил В. М. Севергин еще в 1795 году.
Наилучшим образом этот метод годится для реакций, где определяемое вещество способно переходить в окрашенное соединение, что вызывает изменение окраски исследуемого раствора. Измерив его светопоглощение или сравнив окраску с раствором известной концентрации, несложно найти процент содержания вещества в растворе.
Основной закон светопоглощения
Суть фотометрического определения заключается в двух процессах:
- перевод определяемого вещества в поглощающее электромагнитные колебания соединение;
- замер интенсивности поглощения этих самых колебаний раствором исследуемого вещества.
Изменения в интенсивности потока света, проходящего через светопоглощающее вещество, будут вызываться также потерями света из-за отражения и рассеяния. Чтобы результат был достоверным, проводят параллельные исследования по замеру параметров при той же толщине слоя, в идентичных кюветах, с тем же растворителем. Так снижение интенсивности света зависит главным образом от концентрации раствора.
Уменьшение интенсивности света, пропущенного через раствор, характеризуют коэффициентом светопропускания (также принято называть его пропусканием) Т:
- I — интенсивность света, пропущенного через вещество;
- I0 — интенсивность падающего пучка света.
Таким образом, пропускание показывает долю непоглощенного светового потока, проходящего через изучаемый раствор. Обратный алгоритм значения пропускания называют оптической плотностью раствора (D): D = (-lgT) = (-lg) * (I / I0) = lg * (I0 / I).
Это уравнение показывает, какие параметры являются главными для исследования. К ним относится длина волны света, толщина кюветы, концентрация раствора и оптическая плотность.
Закон Бугера-Ламберта-Бера
Он является математическим выражением, отображающим зависимость уменьшения интенсивности монохроматического потока света от концентрации светопоглощающего вещества и толщины жидкостного слоя, через который он пропущен:
I = I0 * 10 -ε·С·ι , где:
- ε — коэффициент поглощения света;
- С — концентрация вещества, моль/л;
- ι —толщина слоя анализируемого раствора, см.
Преобразовав, эту формулу можно записать: I / I0 = 10 -ε·С·ι .
Суть закона сводится к следующему: различные растворы одного и того же соединения при равной концентрации и толщине слоя в кювете поглощают одинаковую часть падающего на них света.
Прологарифмировав последнее уравнение, можно получить формулу: D = ε * С * ι.
Очевидно, что оптическая плотность напрямую зависит от концентрированности раствора и толщины его слоя. Становится ясен физический смысл молярного коэффициента поглощения. Он равен D для одномолярного раствора и при толщине слоя в 1 см.
Ограничения применения закона
Этот раздел включает следующие пункты:
- Он справедлив исключительно для монохроматического света.
- Коэффициент ε связан с показателем преломления среды, особенно сильные отклонения от закона могут наблюдаться при анализе высококонцентрированных растворов.
- Температура при измерении оптической плотности должна быть постоянной (в рамках нескольких градусов).
- Световой пучок должен быть параллельным.
- рН среды должен быть постоянным.
- Закон применим для веществ, светопоглощающими центрами которых являются частицы одного вида.
Методы определения концентрации
Стоит рассмотреть метод градуировочного графика. Для его построения готовят ряд растворов (5-10) с различной концентрацией исследуемого вещества и замеряют их оптическую плотность. По полученным значениям выстраивают график зависимости D от концентрации. График является прямой линией, идущей от начала координат. Он позволяет легко определить концентрацию вещества по результатам проведенных измерений.
Также существует метод добавок. Применяется реже, чем предыдущий, но позволяет проанализировать растворы сложного состава, поскольку учитывает влияние дополнительных компонентов. Суть его состоит в определении оптической плотности среды Dx, содержащей определяемое вещество неизвестной концентрации Сх, с повторным анализом того же раствора, но с добавлением определенного количества исследуемого компонента (Сст). Величину Сх находят, используя расчеты или графики.
Условия проведения исследования
Чтобы фотометрические исследования давали достоверный результат, необходимо соблюдать несколько условий:
- реакция должна заканчиваться быстро и полностью, избирательно и воспроизводимо;
- окраска образующегося вещества должна быть устойчива во времени и не изменяться под действием света;
- исследуемое вещество берут в количестве, которого достаточно для перевода его в аналитическую форму;
- замеры оптической плотности проводят в том интервале длин волн, при котором различие в поглощении исходных реагентов и анализируемого раствора наибольшее;
- светопоглощение раствора сравнения принято считать оптическим нулем.
Способы расчета концентрации по величине аналитического сигнала
СПОСОБЫ РАСЧЕТА КОНЦЕНТРАЦИИ ПО ВЕЛИЧИНЕ АНАЛИТИЧЕСКОГО СИГНАЛА
МЕТОД ГРАДУИРОВОЧНОГО ГРАФИКА
Пример 1. При измерении оптической плотности в одинаковых условиях (длина волны 340 нм, толщина поглощающего слоя – 1,00 см) растворов калия дихромата с разной концентрацией хрома (мкг/мл) получены следующие результаты:
Изобразите примерный вид градуировочного графика; методом наименьших квадратов рассчитайте обратное уравнение градуировочного графика с = bA + а; определите концентрацию хрома (мкг/мл) в растворе Х, имеющем оптическую плотность 0,480.
Рассчитайте массу хрома (мг) в анализируемой пробе, если ее растворили в присутствии концентрированной серной кислоты в воде дистиллированной в мерной колбе объёмом 50,00 мл (раствор Х).
1. Расчет методом наименьших квадратов
2. Расчет с помощью программы Excel
длина волны 340 нм
Ответ: с = 115,72А — 8,8397 (r = 0,9941); масса хрома в пробе 2,34 мг
Пример 2. При измерении оптической плотности в одинаковых условиях (длина волны 400 нм, толщина поглощающего слоя – 1,00 см) растворов никеля (II) нитрата с разной концентрацией никеля (мг/мл) получены следующие результаты:
Изобразите примерный вид градуировочного графика; методом наименьших квадратов рассчитайте обратное уравнение градуировочного графика с = bA + а; определите концентрацию никеля (мг/мл) в растворе Х, имеющем оптическую плотность 0,350.
Рассчитайте массу никеля (мг) в анализируемой пробе, если ее количественно перенесли в мерную колбу объёмом 25,00 мл и развели водой дистиллированной в присутствии азотной кислоты до метки (раствор Х).
1. Расчет методом наименьших квадратов
2. Расчет с помощью программы Excel
Ответ: с = 42,495А — 3,8535 (r = 0,9986); масса никеля 275 мг
Пример 3. При измерении оптической плотности в одинаковых условиях (длина волны 620 нм, толщина поглощающего слоя – 1,00 см) растворов меди (II) в виде аммиачного комплекса с разной концентрацией меди (мкг/мл) получены следующие результаты:
Изобразите примерный вид градуировочного графика; методом наименьших квадратов рассчитайте обратное уравнение градуировочного графика с = bA; определите концентрацию меди (мкг/мл) в растворе Х, имеющем оптическую плотность 0,150.
Рассчитайте массу меди (мкг) в анализируемой пробе, если ее количественно перенесли в мерную колбу объёмом 25,00 мл и до метки развели водой дистиллированной в присутствии избытка аммиака (раствор Х).
1. Расчет методом наименьших квадратов
2. Расчет с помощью программы Excel
2. Расчет с помощью программы Excel
Ответ: с = 34,595А (r = 0,9985); масса меди 130 мкг.
МЕТОД ОДНОГО СТАНДАРТНОГО РАСТВОРА
Измеряют величину аналитического сигнала (yст) для раствора с известной концентрацией вещества (сст). Затем измеряют величину аналитического сигнала (yx) для раствора с неизвестной концентрацией вещества (сx). Такой способ расчёта можно использовать в том случае, если зависимость аналитического сигнала от концентрации описывается линейным уравнением без свободного члена. Концентрация вещества в стандартном растворе должна быть такой, чтобы величины аналитических сигналов, полученных при использовании стандартного раствора и раствора с неизвестной концентрацией вещества, были бы как можно ближе друг к другу.
ПРИМЕР 1. При фотометрическом определении концентрации нитрит-ионов с помощью реактива Грисса (раствора сульфаниловой кислоты и α-нафтиламина в разбавленной уксусной кислоте) было установлено, что раствор с концентрацией нитрит-ионов 2,00 мкг/мл имеет в соответствующих условиях оптическую плотность 0,300. Рассчитайте концентрацию нитрит-ионов в растворе (мкг/мл), оптическая плотность которого в таких же условиях равна 0,250. Зависимость оптической плотности от содержания аналита линейна и проходит через начало координат.
Ответ: 1,67 мкг/мл
МЕТОД ДВУХ СТАНДАРТНЫХ РАСТВОРОВ
(метод ограничивающих растворов)
Измеряют величины аналитических сигналов для стандартных растворов с двумя разными концентрациями вещества, одна из которых (с1) меньше предполагаемой неизвестной концентрации (сx), а вторая (с2) – больше. Его используют, если зависимость аналитического сигнала от концентрации описывается линейным уравнением, не проходящим через начало координат.
Пример 1. Раствор с концентрацией никеля (II) 12,00 мг/мл имеет оптическую плотность 0,350 нм, а с концентрацией 16,00 мг/мл – 0,440. Определите концентрацию никеля (мг/мл) в растворе с оптической плотностью 0,380 (все измерения проводились в одинаковых условиях: длина волны 400 нм, толщина поглощающего слоя – 1,00 см, раствор в азотной кислоте).
Ответ: 13,33 мг/мл
Используют при анализе сложных матриц, когда матричные компоненты оказывают влияний на величину аналитического сигнала и невозможно точно скопировать матричный состав образца, в случае линейной зависимости, проходящей через начало координат.
Вначале измеряют величину аналитического сигнала (yx) для пробы с неизвестной концентрацией вещества. Затем к данной пробе прибавляют некоторое точное количество определяемого вещества (стандарта) и снова измеряют величину аналитического сигнала (yдоб). Концентрацию определяемого компонента в анализируемой пробе (без учета разбавления) рассчитывают по формуле:
Для учета разбавления раствора используем формулу:
ПРИМЕР 1. Раствор с неизвестной концентрацией вещества имел оптическую плотность 0,300. К 5,00 мл такого раствора прибавили 2,00 мл раствора с концентрацией этого же вещества 40,0 мг/л. Оптическая плотность полученного раствора при измерении её в таких же условиях оказалась равна 0,500. Рассчитайте концентрацию вещества (мг/л) в исходном растворе.
1 способ: пропорционально
2 способ: преобразуем составленную пропорцию в приведенную ранее формулу
ПРИМЕР 2. Оптическая плотность раствора с неизвестным содержанием вещества равна 0,400. При добавлении к анализируемому раствору 10,0 мкг этого же вещества оптическая плотность увеличилась до 0,500. Рассчитайте массу определяемого вещества (мкг) в исходном растворе.
1 способ: пропорционально
2 способ: преобразуем составленную пропорцию в приведенную ранее формулу
источники:
http://fb.ru/article/378024/teoreticheskie-osnovyi-opredeleniya-opticheskoy-plotnosti-rastvora
http://pandia.ru/text/80/260/2737.php
Ошибки спектрофотометрических измерений определяются флуктуациями показаний на выходном приборе. Их величина зависит, в свою очередь, от стабильности источника света, флуктуаций светового пучка на пути от источника света к приемнику, шумов приемно-усилительной аппаратуры и регистрирующего прибора. Рассмотрим влияние этих источников ошибок на результаты измерений, учитывая, что при абсорбционных измерениях, в конечном итоге, существенна точность определения оптической плотности О, а не интенсивностей поглощенного и непоглощенного сигналов. Напомним, что [c.137]
Пусть чувствительность определения примесей в пробе объемом 25 мл при помощи кюветы толщиной 5 см равна 0,005 у/см . Тогда минимальное обнаруживаемое количество вещества равно 0,005 X (25/5) == 0,025 мкг, или 2,5 10 %, для пробы весом 1 г. Эта величина примерно соответствует ошибке спектрофотометрических измерений малых поглощений. [c.133]
Рассмотренные ошибки спектрофотометрического метода в основном относятся к работе прибора. Естественно, что не меньшее значение могут иметь ошибки, связанные с работой самого исследователя (точность приготовления исходных растворов, способ заполнения кювет), и с условиями протекания конкретной химиче- ской реакции (разложение реагентов, межмолекулярные взаимодействия и т. п.). Все это должно учитываться при проведении фотометрических измерений. [c.22]
Изучение факторов, влияющих на точность спектрофотометрических измерений [19] — [27], показывает, что причины ошибок в спектрофотометрии могут быть весьма разнообразны и многочисленны. Ошибки возникают, например, за счет действий оператора, условий проведения реакций, недостаточной чистоты кювет, непостоянства их установки в кюветные отделения, невоспроизводимости настройки шкалы прибора на О и 100% пропускания, непостоянства излучения источника освещения, нестабильности работы фотоэлектрической системы [24] — [27]. [c.30]
При определении Do (ВаО) на основании данных по реакций образования ВаО получаемые значения существенно зависят от принятого в расчете типа основного состояния этой молекулы. Значение, приведенное по данным работ [72, 74, 75, 396], получено для основного состояния Х 2 оно подтверждено результатами измерений методом электронного удара [73]. Расчет по результатам измерения давления пара ВаО менее надежен из-за неточности данных по АЯ (ВаО, тв.) и АЯд (Ва, тв.). В обзоре [76] принимается основное состояние и рекомендуется Do = 131 6. См. также [4, стр. 236]. Спектрофотометрические измерения [118, 119], приведшие к значению —120, содержали ошибки, см. [396]. [c.49]
На абсолютную и относительную точность (воспроизводимость) спектрофотометрических измерений влияет ряд разнообразных и часто трудно поддающихся учету факторов [23, 40]. Для количественного анализа и различных сравнительных исследований наиболее важной является воспроизводимость измерений и несущественны некоторые ошибки систематического характера, так что при разработке многих методик исследования, а также аппаратуры, исключению последних уделяется мало внимания. В связи с этим существует такое положение, что при высокой в большинстве случаев относительной точности современных спектрофотометрических измерений данные, полученные на различных приборах или в различных условиях эксперимента, часто значительно различаются. В большей части опубликованных исследований ультрафиолетовых спектров поглощения авторами не оценивается абсолютная точность измерений, а также не приводятся данные, относящиеся к аппаратуре и методике эксперимента, позволяющие провести хотя бы грубую оценку подобного рода. [c.383]
Расчет общей (максимальной) ошибки и отдельных составляющих ошибок дифференциальных спектрофотометрических измерений кобальта (14—26 г/л) в виде перхлората, измеренных по отношению к оптимальному раствору сравнения, содержащему 12 г/л Со +, приведены в табл. 7, [c.54]
Из уравнения (28) можно также сделать следующие общие заключения по точности дифференциальных спектрофотометрических измерений. Ошибка будет меньше, если [c.44]
Погрешность в определении истинной константы диссоциации слагается в основном из трех величин погрешности, вносимой спектрофотометрическими измерениями, погрешности потенциометрических измерений (если они производились) и ошибки, которая вносится принятой методикой нахождения истинной константы диссоциации по найденному значению кажущейся или концентрационной константы диссоциации. [c.93]
Ошибки при спектрофотометрических измерениях [c.137]
Первоначально рассмотрим точность анализов. Ошибка воспроизводимости, которой характеризуется точность определений атомно-абсорбционного анализа, складывается за счет двух основных операций получения поглощающего слоя и измерения поглощения спектрофотометром. Источники возникновения и величина ошибок при спектрофотометрических измерениях обсуждались ранее ( 19), причем было показано, что эти ошибки могут быть в принципе уменьшены до дробовых шумов приемника, имеющих статистическое происхождение. Случайные ошибки, связанные с получением поглощающего слоя, обусловлены следующими звеньями анализа неоднородностью образцов, дозированием проб на электрод, случайными обстоятельствами, определяющими скорость испарения элемента в кювету, колебаниями температуры кюветы и давления постороннего газа. [c.329]
Непосредственная погрешность спектрофотометрического измерения, включающая ошибки настройки прибора на О и 100% пропускания [76, 83, 88—91], погрешность отсчета по измерительному потенциометру и ошибки, связанные с нестабильностью электронной схемы [82, 92] в процессе измерения. [c.17]
Выбор условий регистрации спектров оказывает существенное влияние на результаты спектрофотометрических измерений. При выборе оптимальных условий удается свести к минимуму как систематические, так и случайные ошибки, возникающие [c.19]
Зависимость ошибки определения концентрации от величины пропускаемости света измеряемым раствором. Одна из существенных ошибок спектрофотометрических измерений возникает при отсчетах величины пропускания на крайних участках соответствующей шкалы прибора. Вследствие логарифмической формы закона поглощения наибольшая точность может быть получена при измерениях в области средних значений величины пропускания. Если предельное значение неопределенности при отсчете О величины отклонения гальванометра обозначить через (10 и предположить, что источник излучения является стабильным и что соотношение между интенсивностью падающего светового пучка и отклонением гальванометра является линейным, то [c.85]
Одновременное присутствие в растворе последовательно образующихся комплексов может привести к серьезным ошибкам при сочетании спектрофотометрических измерений с экстракцией растворителем. Только один из последовательных комплексов — электронейтральный — может экстрагироваться органическим растворителем. Различные последовательно образующиеся комплексы, которые содержат большее или меньшее количество лигандов, чем необходимо для нейтрализации положительного заряда центрального иона металла, и сами несут положительный или отрицательный заряд, останутся в водной фазе. Возможность ошибки будет наименьшей в случае комплексов, в которых для нейтрализации электрического заряда центрального иона металла и насыщения его координационной сферы требуется такое же число лигандов, как и для координации. [c.88]
Дифференциальный спектрофотометрический метод может быть применен и в тех случаях, когда имеется наложение в спектрах поглощения соединения и реагента. Тогда при измерении по отношению к одному из использованных как эталон растворов в значительной степени исключается ошибка за счет поглощения реагента. [c.480]
XI1-3-1. При каком значении Т (парциальное поглощение) в спектрофотометрических анализах будет минимальной относительная ошибка в определении концентрации (Дс/с) для данной ошибки измерения Г [c.143]
Дифференциальный метод анализа используют для повышения точности спектрофотометрических и фотоколориметрических измерений при определении высоких концентраций веществ (от 10 до 100%). Сущность метода заключается в измерении светопоглощения анализируемого раствора относительно раствора сравнения, содержащего определенное количество испытуемого вещества это приводит к изменению рабочей области шкалы прибора и снижению относительной ошибки анализа до 0,5—1%. [c.40]
Кроме того, в настоящее время разработаны спектрофотометрические методы определения большого содержания отдельных компонентов. Эти методы называют дифференциальной фотометрией. Для точного измерения в параллельном световом потоке устанавливают стандартный раствор, близкий по составу к испытуемому раствору. Таким образом, измеряется разница интенсивности двух световых потоков ошибка измерений меньше сказывается на конечном результате. Главные трудности и недостатки, по сравнению с эмиссионным спектральным анализом, связаны с затратой времени на подготовку вещества к анализу, отделение мешающих компонентов, и др. Результат зависит от выбора условий, реактивов и концентрации посторонних ионов. Групповые методы почти не разработаны, поэтому для каждого элемента необходим отдельный ход анализа. [c.9]
Другим методом определения констант является измерение возрастания растворимости в воде исследуемого вещества при различных значениях pH раствора (глава 6), Этот метод не так точен, как потенциометрический, спектрофотометрический и кондуктометрический, но бывает полезен в тех случаях (к счастью, редких), когда вещество слишком мало растворимо в воде для того, чтобы использовать потенциометрический или кондуктометрический метод, и спектр его непригоден для определения. Катализ гидролиза эфиров, дисахаридов и глюкозидов как метод измерения констант ионизации представляет лишь исторический интерес. В ряде случаев этот метод приводил к очень грубым ошибкам. [c.18]
Обычно спектрофотометрические измерения проводят в таких условиях, когда оптическая плотность исследуемого раствора лежит в 1феде-лах А = 0,2—0,8, так как именно при таких значениях оптической плотности достигается минимальная ошибка спектрофотометрических измерений. [c.528]
Общепринято, что такое ограничение не распространяется па спектрофотометрические данные, и отклонения обычно определяют как разность между необходимым и рассчитанным све-топоглощением [4, И, 12, 53, 72—74]. Обычно при определенных условиях нет необходимости использовать веса, так как в этом случае ошибки спектрофотометрического измерения преобладают над ошибками измерения концентрации [11, 12, 75]. Кроме того, показания современных спектрофотометров имеют постоянную дисперсию в некотором диапазоне значений светопоглощения (см. разд. 8.3, п. 6). Однако если измерять светопоглощение одного и того же раствора при нескольких длинах волн, то будет наблюдаться корреляция ошибок. Для математической корректности следовало бы учесть такую корреляцию, введя весовую матрицу, содержащую ковариации переменных. Тем не менее корреляцией можно пренебречь, так как спектрофотометрические ошибки начинают проявляться, когда ошибки в концентрациях составляют несколько десятых долей процента, а ошибки в измерении светопоглощения— несколько тысячных [12]. Показано [12], что даже в случае преобладания концентрационных ошибок пренебрежение корреляцией незначительно влияет на результат. [c.96]
В настоящее время метод остановленной струи широко приме-ляется для решения многих задач химической кинетики установление механизмов химической реакции, определение стадий, лимитирующих протекание реакции обнаружение промежуточных комплексов, определение кинетики ферментативных реакций, установление числа и концентрации активных центров фермента, изучение быстрых конформационны5( переходов в белках и нуклеиновых кислотах. Метод требует быстрой регистрации это единственное существенное ограничение его применимости. Особое внимание при применении метода остановленной струи необходимо уделять тер-мостатированию, так как разница в температурах в кювете наблюдения и растворе смеси реагентов может привести к большим оптическим ошибкам, затрудняющим установление механизма наблюдаемой реакции. Точность определения констант скоростей данным методом примерно такая, как и при обычных спектрофотометрических измерениях кинетики химических реакций. [c.28]
Рассмотрим в первую очередь ошибки, вытекающие из самой сущности законов поглощения излучений, и основные закономерности, установленные еще в 1937 г. Туайменом и Лотианом [19]. Найденная ими зависимость ошибки измерения А от ее абсолютного значения является определяющей в оценке ошибок спектрофотометрических измерений. [c.30]
Иногда в случае неблагоприятных условий спектрофотометрические измерения подвержены более высоким ошибкам. Например, реакцию гафния (IV) с хлораниловой кислотой в 3 М хлорной кислоте изучали спектрофотометрически в области 260—360 нм. Было измерено светопоглощение двенадцати растворов при двадцати одной длине волны [6]. На рис. 2.4 показана зависимость определяемого числа частиц от заданной ошибки матричного элемента. Результаты, полученные при исследовании хлораниловой кислоты в 3 М хлорной кислоте, также показаны на рис. 2.4. [c.41]
Определение по собственному светопоглощению. Метод основан на спектрофотометрическом измерении светопоглощения водного, раствора хлора [164, 524] или его раствора в I4 [117, 946] в УФ-области спектра (330—350 нм). Нижний предел определяемой концентрации хлора 2-10 М (1 мкг мл). Относительная ошибка при определении 10 М хлора составляет 4%, для более низких концентраций (< 10 М) ошибка увеличивается до 30— 50% [117]. [c.68]
Для индикации и регистрации показаний анализаторов все шире применяют цифровые преобразователи и цифровые регистраторы, обладающие целым рядом преимуществ перед аналоговыми, к которым в первую очередь относятся почти полное устранение ошибки считывания показаний и возможность непосредственной обработки данных на вычислительной машине. В состав цифрового регистрирующего устройства входят аналого-цифровой преобразователь, индикатор и перфоратор с логической схемой управления. Голландской фирмой Витатрон для регистрации и обработки результатов спектрофотометрических измерений выпускаются цифровой преобразователь ОНР 100 и цифровой регистратор ОКР 200. [c.135]
Спектрофотометрические измерения. На рис. 1 показаны ультрафиолетовые спектры перксеноната при различных значениях pH. Поскольку ионную силу растворов не контролировали, о результатах спектрометрических измерений можно сделать только качественные заключения. Однако очевидно, что при pH ниже И в перксенонатном растворе появляются новые формы соединений ксенона. В пределах ошибки опыта имеются две изобестических точки, что указывает на то, что во всем интервале pH имеются только две основные поглощающие формы. [c.237]
Свегла, Палл и Ердеи показали , что для вычисления ошибок спектрофотометрических измерений недостаточно учитывать только ошибки показания прибора ошибки возникают также из-за неопределенности отрезков, отсекаемых на осях координат калибровочными графиками и из-за различных наклонов последних. [c.30]
Сопоставление активационных параметров кислотного гидролиза алкилсульфатов с длинной цепью и немицеллярного этилсуль-фата показывает, что ускорение реакции при образовании мицелл связано главным образом с уменьшением энтальпии активации, а не с увеличением энтропии [212]. Этот вывод был получен с использованием потенциометрических данных. Однако энергия активации кислотного гидролиза додецилсульфата натрия, полученная из спектрофотометрических измерений, оказалась одинаковой в мицеллярных и истинных растворах (табл. 8), тогда как энтропия активации была на 6,9 энтр. ед. больше в случае мицеллярного раствора [215]. Это противоречие, вероятно, объясняется неодинаковым выбором стандарта для сравнения (раствор этилсульфата и неми-целлярный раствор додецилсульфата). Возможно также, что расхождения связаны с отклонениями температурной зависимости от уравнения Аррениуса и зависящими от температуры ошибками потенциометрического метода. [c.282]
Такой спектральный анализ требует трудно достижимой точности спектрофотометрических измерений. Он осложнен взаимным наложением аналитических полос свободных молекул и Н-комплексов, температурной зависимостью коэффициентов поглощения этих полос, неудобством и неточностью термостатирования (из-за нагрева образца излучением) и другими факторами. Ошибки спектральных определений АН составляют от 0,2 ккал1моль для прецизионных измерений до 0,5—1 ккалЫоль для обычных, но эти величины скорее характеризуют лишь невоспроизводимость измерений, а действительные неточности больше Расхождения результатов разных авторов часто намного превышает предполагаемые ошибки, достигая целых единиц ккалЫоль, или приблизительно 100% от измеряемой величины Поэтому, несмотря на большое число опубликованных данных, надежные сходящиеся значения энтальпий водородных связей известны все еще для сравнительно немногих систем . [c.139]
В работе [1049] изучены условия, при которых возможно быстрое спектрофотометрическое определение ртути в неорганических соединениях. Показано, что закон Вера выполняется для концентраций (0,5—4)-10 М Hg(II). Относительное стандартное отклонение составляет 1,8%. Изучено влияние концентрации иодида калия на определение ртути и найдено, что для 2,2-10 М Hg(II) поглощение остается неизменным, если концентрация иодида калия изменяется от 1,2 до 0,8 М. Установлено, что при pH 4 окисление Т до Тз становится заметным, однако ошибка не превышает 1%. Измерение поглощения ртутного комплекса при pH 10 дает ошибку 1%. Низкие величины оптической плотности могут быть получены при высоких pH из-за образования частиц Hg(OH) . На определение ртути данным методом оказывают влияние анионы СгО , СгзО , поглощающие в области 323 млг. Влияние СН связано с образованием частиц типа Hg( N) J4 . Ионы Ag , Сг + не влияют, если их концентрация равна 2-10 М. Но медь, платина, золото окисляют Т до и поэтому должны быть восстановлены кислым раствором НааЗгОз до анализа. Влияют на определение ртути ионы Ре(П), РЬ(П), В1(1П), Т1(1), которые дают видимые осадки в 1 М КТ при концентрации их. <1.10 М. Этот метод может быть применен в присутствии галогенидов и псевдогалогенидов. [c.105]
Одна из групп исследователей [16] вычисляла константы устойчивости, используя уравнения материального баланса. Минимизировалась сумма квадратов отклонений аналитической концентрации иона водорода. В этом случае взвешивание особенно важно, поскольку ошибка измерения pH соответствует большим отклонениям при низких значениях pH, чем при высоких [13]. Обычно взвешивание более необходимо при потенциометрических вычислениях, чем в спектрофотометрических методах 1 жно оно и тогда, когда используются отклонения функции п. Оказалось, что вычисленные веса изменяются в слишком широких пределах [26, 68, 69]. Возможно, частичной причиной этого является то, что авторы аппроксимируют данные функцией, зависимые переменные которой сами являются функциями экспериментальных наблюдений. Так, очевидно, что полная аналитическая концентрация иона водорода является экспоненциальной функцией от pH. Таким образом, условия применимости метода наименьших квадратов (разд. 4.6) выполнены не полностью, поскольку неточные зависимые переменные сопоставляются с функциями от точных значений независимых переменных. Особенно следует избегать использования отклонений функции образования п. Правильным будет применять для расчета всех потенциометрических данных функцию суммы квадратов разностей между вычисленными и наблюдаемыми э. д. с. Дополнительное преимущество такого подхода — возможность использовать единичные веса до тех пор, пока нет веских оснований полагать противное. Примером использования единичных весов служит минимизация суммы квадратов разностей меладу вычисленным и наблюдаемым объемом титрантов в процессе кислотно-основного титрования [29]. Другие исследователи также для простоты вводили допущение о единичности весовой матрицы [11, 15, 31, 51], и было сообщение, что и с весовыми коэффициентами и без них получались одни и те же значения рассчитанных констант устойчивости. [c.95]
Спектрофотометрия в ультрафиолетовой (УФ) и видимой областях (ОФС.1.2.1.1.0003.15)
Государственная фармакопея 13 издание (ГФ XIII)
ОБЩАЯ ФАРМАКОПЕЙНАЯ СТАТЬЯ
Взамен ОФС ГФ X, ОФС ГФ XI, ОФС 42-0042-07 ГФ XII, ч.1
Спектроскопические методы анализа основаны на избирательном поглощении электромагнитного излучения анализируемым веществом и служат для исследования строения, идентификации и количественного определения светопоглощающих соединений.
В зависимости or используемой аппаратуры в фармацевтическом анализе различают следующие методы анализа, основанные на поглощении электромагнитного излучения и испускании света:
- спектрофотометрия в ультрафиолетовой (УФ) и видимой областях;
- спектрометрия в инфракрасной (ИК) области;
- атомно-эмиссионная спектрометрия (АЭС);
- атомно-абсорбционная спектроскопия (ААС);
- флуоримегрия;
- спектроскопия ядерного магнитного резонанса (ЯМР);
- масс-спектрометрия;
- рамановская спектрометрия;
- рентгеновская флуоресцентная спектрометрия;
- рентгеновская порошковая дифрактометрия.
Ряд длин волн, для которых проводятся измерения методами абсорбционной спектрофотометрии, охватывает спектральную область от коротких длин волн в УФ-области до ИК-области. Для удобства отнесений этот спектральный ряд делится на следующие диапазоны длин волн: УФ (от 190 до 380 нм), видимый (от 380 до 780 нм), ИК (от 0,78 до 400 мкм).
СПЕКТРОФОТОМЕТРИЯ В УЛЬТРАФИОЛЕТОВОЙ И ВИДИМОЙ ОБЛАСТЯХ
Уменьшение интенсивности монохроматического излучения, проходящего через гомогенную поглощающую среду, количественно описывается законом Бугера-Ламберта-Бера:
где:
Т – пропускание, отношение интенсивности светового потока, прошедшего через вещество, к интенсивности падающего на вещество светового потока: Т = I/I0;
I – интенсивность прошедшего монохроматического излучения;
I0 – интенсивность падающего монохроматического излучения;
ε – молярный показатель поглощения;
с – молярная концентрация вещества в растворе;
b – длина оптического пути или толщина слоя, в сантиметрах.
Величина log10(1/Т) носит название оптической плотности, обозначается буквой А и является измеряемой величиной. В отсутствии других физико-химических факторов измеренная оптическая плотность (А) пропорциональна концентрации вещества в растворе (с) и толщине слоя (b).
Величина представляет собой удельный показатель поглощения, т.е. оптическую плотность раствора вещества с концентрацией 10 г/л (1 г/100 мл) в кювете с толщиной слоя 1 см. Величины
и ε связаны соотношением:
где:
М.м. – молекулярная масса исследуемого вещества.
Измерение оптической плотности
Если нет других указаний в фармакопейной статье, измерение оптической плотности проводят при указанной длине волны с использованием кювет с толщиной слоя 1 см и при температуре (20 ± 1) °С по сравнению с тем же растворителем или той же смесью растворителей, в которой растворено вещество. При измерении оптической плотности раствора при данной длине волны оптическая плотность кюветы с растворителем, измеренная против воздуха при той же длине волны, не должна превышать 0,9 и, желательно, чтобы она была не менее 0,2.
Спектр поглощения представляют таким образом, чтобы оптическая плотность или ее некоторая функция были приведены по оси ординат, а длина волны или некоторая функция длины волны – по оси абсцисс.
Если в фармакопейной статье для максимума поглощения указывается только одна длина волны, то это означает, что полученное значение максимума не должно отличаться от указанного более чем на ± 2 нм.
Приборы
Спектрофотометры, предназначенные для измерений в ультрафиолетовой и видимой областях спектра, состоят из оптической системы, выделяющей монохроматическое излучение в области от 190 до 800 нм и обеспечивающей его прохождение через образец, и устройства для измерения оптической плотности.
Основными частями этих приборов являются: источник излучения, диспергирующий прибор (призма или решетка), щель для выделения полосы длин волн, кюветы для образцов, детектор излучаемой энергии, встроенные усилители и измерительные приборы.
Проверка шкалы длин волн в ультрафиолетовой и видимой области. Точность калибровки прибора по шкале длин волн в спектральном ряду проверяют по приведенным в табл. 1 спектральным линиям водородной (Hβ) или дейтериевой (Dβ) разрядной лампы, линиям паров ртути (Hg) кварцево-ртутной дуговой лампы, а также по максимумам поглощения раствора гольмия перхлората (Ho) (готовый реактив для калибровки спектрофотометра представляет собой 4 % раствор гольмия оксида в 14,1% растворе хлорной кислоты). Допустимое отклонение составляет ± 1 нм для ультрафиолетовой и ± 3 нм для видимой области.
Таблица 1. Максимумы поглощения для проверки шкалы длин волн
| 241,15 нм (Но) | 404,66 нм (Hg) |
| 253,7 нм (Hg) | 435,83 нм (Hg) |
| 287,15 нм (Но) | 486,0 нм (Dв) |
| 302,25 нм (Hg) | 486,1 нм (Нв) |
| 313,16 нм (Hg) | 536,3 нм (Но) |
| 334,15 нм (Hg) | 546,07 нм (Hg) |
| 361,5 нм (Но) | 576,96 нм (Hg) |
| З65,48 нм (Hg) | 579,07 нм (Hg) |
Шкала длин волн может быть калибрована также при помощи подходящих стеклянных фильтров, которые имеют фиксированные полосы поглощения в видимой и ультрафиолетовой областях, а также стандартных стекол, содержащих дидим (смесь празеодима и неодима), и стекол, содержащих гольмий.
Проверка шкалы оптической плотности. Для проверки шкалы оптической плотности используют стандартные неорганические стеклянные фильтры или раствор калия дихромата при длинах волн, указанных в табл. 2, где для каждой длины волны приведено точное значение удельного показателя поглощения и допустимые пределы.
Раствор калия дихромата для проверки шкалы оптической плотности при 235, 257, 313 и 350 нм готовят следующим образом: от 57,0 до 63,0 мг (точная навеска) калия дихромата, предварительно высушенного до постоянной массы при температуре 130 °С, растворяют в 0,005 М растворе серной кислоты и доводят объем раствора тем же растворителем до 1000 мл. Для проверки оптической плотности при 430 нм, растворяют 57,0-63,0 мг (точная навеска) калия дихромата в 0,005 М растворе серной кислоты и доводят объём раствора тем же растворителем до метки.
Таблица 2. Удельный показатель поглощения стандартов при различных длинах волн
Предельный уровень рассеянного света. Рассеянный свет может быть обнаружен при данной длине волны с использованием соответствующих фильтров или растворов: например, оптическая плотность раствора 12 г/л калия хлорида в кювете с толщиной слоя 1 см резко увеличивается между 220 и 200 нм и должна быть больше 2 при 198 нм при использовании воды в качестве раствора сравнения.
Разрешающая способность (для качественного анализа). Если есть указание в фармакопейной статье, определяют разрешающую способность спектрофотометра следующим образом. Записывают спектр 0,02 % (об/об) раствора толуола в гексане. Минимально допустимое значение отношения оптической плотности в максимуме поглощения при 269 нм к оптической плотности в минимуме поглощения при 266 нм указывают в фармакопейной статье.
Ширина спектральной щели (для количественного анализа). В случае использования спектрофотометра с изменяемой шириной спектральной щели при выбранной длине волны возможны погрешности, связанные с шириной этой щели. Для их исключения ширина щели должна быть малой по сравнению с полушириной полосы поглощения (шириной на половине оптической плотности) и в то же время должна быть максимально велика для получения высокого значения интенсивности падающего монохроматического излучения (I0). Таким образом, ширина щели должна быть такой, чтобы дальнейшее ее уменьшение не изменяло величину измеряемой оптической плотности.
Кюветы. Допустимые отклонения в толщине слоя используемых кювет должны быть не более ±0,005 см. Кюветы, предназначенные для испытуемого раствора и раствора сравнения, должны иметь одинаковое пропускание (или оптическую плотность) при заполнении одним и тем же растворителем. В противном случае это различие следует учитывать.
Требования к растворителям. Для определений, производимых в ультрафиолетовой и видимой областях, образец анализируемого вещества растворяют в соответствующем растворителе, который должен быть оптически прозрачным в используемой области длин волн. Для этих областей длин волн пригодны многие растворители, в том числе вода, спирты, хлороформ, низшие углеводороды, эфиры и разбавленные растворы сильных кислот и щелочей.
Идентификация
Абсорбционную спектрофотометрию в ультрафиолетовой и видимой областях спектра применяют для определения подлинности лекарственных средств путем:
- сравнения спектров поглощения испытуемого раствора и раствора стандартного образца; в указанной области спектра должно наблюдаться совпадение положений максимумов, минимумов, плеч и точек перегиба;
- указания положений максимумов, минимумов, плеч и точек перегиба спектра поглощения испытуемого раствора; расхождение между наблюдаемыми и указанными длинами волн в максимумах и минимумах поглощения не должно обычно превышать ± 2 нм.
Возможны и другие варианты применения, оговоренные в фармакопейных статьях.
Количественное определение
Определение концентрации веществ спектрофотометрическим методом основано на использовании закона Бугера-Ламберта-Бера:
В ряде случаев, даже при использовании монохроматического излучения могут наблюдаться отклонения от закона Бугера-Ламберта-Бера, обусловленные процессами диссоциации, ассоциации и комплексообразования. Поэтому предварительно следует проверить линейность зависимости оптической плотности раствора от концентрации в аналитической области. При наличии отклонений от линейной зависимости следует пользоваться не формулой (3), а экспериментально найденной зависимостью.
Обычно определение концентрации спектрофотометрическим методом проводят с использованием стандартного образца. Расчет концентрации основан на использовании уравнения:
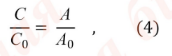
С и С0 – концентрации испытуемого раствора и раствора стандартного образца, соответственно;
А и А0 – оптические плотности испытуемого раствора и раствора стандартного образца, соответственно.
Концентрации испытуемого и стандартного раствора должны быть близки.
Вначале измеряют оптическую плотность раствора стандартного образца, приготовленного, как указано в фармакопейной статье, затем проводят измерение оптической плотности испытуемого раствора. Второе измерение проводят сразу после первого, с использованием той же кюветы, в тех же экспериментальных условиях.
Метод с использованием стандартного образца является более точным и надежным. Возможность применения значения удельного показателя поглощения в каждом конкретном случае следует обосновывать. Обычно метод с использованием значения удельного показателя поглощения применим при допусках содержания анализируемого вещества не менее ±10 % от номинального содержания.
Многокомпонентный спектрофотометрический анализ
Многокомпонентный спектрофотометрический анализ (анализ смесей) применяют для одновременного количественного определения нескольких компонентов лекарственных средств, каждое из которых подчиняется закону Бугера-Ламберта-Бера.
Количественное определение в многокомпонентном спектрофотометрическом анализе основывается обычно на использовании уравнения:
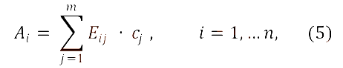
Аi – оптическая плотность испытуемого раствора при i-ой длине волны;
Еij – показатели поглощения (зависящие от способа выражения концентрации) j-го компонента образца при i-ой аналитической длине волны;
cj – концентрация j-го компонента образца.
Соответствующие методики проведения анализа и расчетные формулы указываются в фармакопейных статьях.
Производная спектрофотометрия
В производной спектрофотометрии исходные спектры поглощения (нулевого порядка) преобразуются в спектры производных первого, второго и более высокого порядков.
Спектр первой производной представляет собой график зависимости градиента кривой поглощения (скорость изменения оптической плотности от длины волны, dA/dλ) от длины волны.
Спектр второй производной представляет собой график зависимости кривизны спектра поглощения (d2A/dλ2) от длины волны. Вторая производная при любой длине волны связана с концентрацией следующим соотношением:
Производная спектрофотометрия может быть использована как для целей идентификации веществ, так и для их количественного определения в многокомпонентных смесях, а также в тех случаях, когда имеется фоновое поглощение, вызванное присутствием веществ, содержание которых не регламентируется.
Приборы
Используют спектрофотометры, отвечающие указанным выше требованиям и оснащенные аналоговым резистивно-емкостным дифференцирующим модулем или цифровым дифференциатором, или другими средствами получения производных спектров, в соответствии с инструкцией к прибору. Некоторые методы получения спектров второй производной приводят к смещению длин волн относительно исходного спектра, что следует учитывать там, где это необходимо.
Разрешающая способность
Если указано в фармакопейных статьях, записывают спектр второй производной для раствора 0,2 г/л толуола в метаноле, используя метанол в качестве раствора сравнения. На спектре должен присутствовать небольшой отрицательный экстремум, расположенный между двумя большими отрицательными экстремумами при 261 нм и 268 нм, в соответствии с рис. 1. Если нет других указаний в фармакопейных статьях, отношение А/B должно быть не менее 0,2.
Методика
Процедура анализа аналогична применяемой в обычной спектрофотометрии, но вместо оптических плотностей используют производные. Готовят раствор испытуемого образца, настраивают прибор в соответствии с инструкцией производителя и рассчитывают количество определяемого вещества, как указано в фармакопейной статье.
Рисунок 1. Спектр второй производной раствора толуола (0,2 г/л) в метаноле
Ошибки спектрофотометрических измерений определяются флуктуациями показаний на выходном приборе. Их величина зависит, в свою очередь, от стабильности источника света, флуктуаций светового пучка на пути от источника света к приемнику, шумов приемно-усилительной аппаратуры и регистрирующего прибора. Рассмотрим влияние этих источников ошибок на результаты измерений, учитывая, что при абсорбционных измерениях, в конечном итоге, существенна точность определения оптической плотности О, а не интенсивностей поглощенного и непоглощенного сигналов. Напомним, что [c.137]
Пусть чувствительность определения примесей в пробе объемом 25 мл при помощи кюветы толщиной 5 см равна 0,005 у/см . Тогда минимальное обнаруживаемое количество вещества равно 0,005 X (25/5) == 0,025 мкг, или 2,5 10 %, для пробы весом 1 г. Эта величина примерно соответствует ошибке спектрофотометрических измерений малых поглощений. [c.133]
Рассмотренные ошибки спектрофотометрического метода в основном относятся к работе прибора. Естественно, что не меньшее значение могут иметь ошибки, связанные с работой самого исследователя (точность приготовления исходных растворов, способ заполнения кювет), и с условиями протекания конкретной химиче- ской реакции (разложение реагентов, межмолекулярные взаимодействия и т. п.). Все это должно учитываться при проведении фотометрических измерений. [c.22]
Изучение факторов, влияющих на точность спектрофотометрических измерений [19] — [27], показывает, что причины ошибок в спектрофотометрии могут быть весьма разнообразны и многочисленны. Ошибки возникают, например, за счет действий оператора, условий проведения реакций, недостаточной чистоты кювет, непостоянства их установки в кюветные отделения, невоспроизводимости настройки шкалы прибора на О и 100% пропускания, непостоянства излучения источника освещения, нестабильности работы фотоэлектрической системы [24] — [27]. [c.30]
При определении Do (ВаО) на основании данных по реакций образования ВаО получаемые значения существенно зависят от принятого в расчете типа основного состояния этой молекулы. Значение, приведенное по данным работ [72, 74, 75, 396], получено для основного состояния Х 2 оно подтверждено результатами измерений методом электронного удара [73]. Расчет по результатам измерения давления пара ВаО менее надежен из-за неточности данных по АЯ (ВаО, тв.) и АЯд (Ва, тв.). В обзоре [76] принимается основное состояние и рекомендуется Do = 131 6. См. также [4, стр. 236]. Спектрофотометрические измерения [118, 119], приведшие к значению —120, содержали ошибки, см. [396]. [c.49]
На абсолютную и относительную точность (воспроизводимость) спектрофотометрических измерений влияет ряд разнообразных и часто трудно поддающихся учету факторов [23, 40]. Для количественного анализа и различных сравнительных исследований наиболее важной является воспроизводимость измерений и несущественны некоторые ошибки систематического характера, так что при разработке многих методик исследования, а также аппаратуры, исключению последних уделяется мало внимания. В связи с этим существует такое положение, что при высокой в большинстве случаев относительной точности современных спектрофотометрических измерений данные, полученные на различных приборах или в различных условиях эксперимента, часто значительно различаются. В большей части опубликованных исследований ультрафиолетовых спектров поглощения авторами не оценивается абсолютная точность измерений, а также не приводятся данные, относящиеся к аппаратуре и методике эксперимента, позволяющие провести хотя бы грубую оценку подобного рода. [c.383]
Расчет общей (максимальной) ошибки и отдельных составляющих ошибок дифференциальных спектрофотометрических измерений кобальта (14—26 г/л) в виде перхлората, измеренных по отношению к оптимальному раствору сравнения, содержащему 12 г/л Со +, приведены в табл. 7, [c.54]
Из уравнения (28) можно также сделать следующие общие заключения по точности дифференциальных спектрофотометрических измерений. Ошибка будет меньше, если [c.44]
Погрешность в определении истинной константы диссоциации слагается в основном из трех величин погрешности, вносимой спектрофотометрическими измерениями, погрешности потенциометрических измерений (если они производились) и ошибки, которая вносится принятой методикой нахождения истинной константы диссоциации по найденному значению кажущейся или концентрационной константы диссоциации. [c.93]
Ошибки при спектрофотометрических измерениях [c.137]
Первоначально рассмотрим точность анализов. Ошибка воспроизводимости, которой характеризуется точность определений атомно-абсорбционного анализа, складывается за счет двух основных операций получения поглощающего слоя и измерения поглощения спектрофотометром. Источники возникновения и величина ошибок при спектрофотометрических измерениях обсуждались ранее ( 19), причем было показано, что эти ошибки могут быть в принципе уменьшены до дробовых шумов приемника, имеющих статистическое происхождение. Случайные ошибки, связанные с получением поглощающего слоя, обусловлены следующими звеньями анализа неоднородностью образцов, дозированием проб на электрод, случайными обстоятельствами, определяющими скорость испарения элемента в кювету, колебаниями температуры кюветы и давления постороннего газа. [c.329]
Непосредственная погрешность спектрофотометрического измерения, включающая ошибки настройки прибора на О и 100% пропускания [76, 83, 88—91], погрешность отсчета по измерительному потенциометру и ошибки, связанные с нестабильностью электронной схемы [82, 92] в процессе измерения. [c.17]
Выбор условий регистрации спектров оказывает существенное влияние на результаты спектрофотометрических измерений. При выборе оптимальных условий удается свести к минимуму как систематические, так и случайные ошибки, возникающие [c.19]
Зависимость ошибки определения концентрации от величины пропускаемости света измеряемым раствором. Одна из существенных ошибок спектрофотометрических измерений возникает при отсчетах величины пропускания на крайних участках соответствующей шкалы прибора. Вследствие логарифмической формы закона поглощения наибольшая точность может быть получена при измерениях в области средних значений величины пропускания. Если предельное значение неопределенности при отсчете О величины отклонения гальванометра обозначить через (10 и предположить, что источник излучения является стабильным и что соотношение между интенсивностью падающего светового пучка и отклонением гальванометра является линейным, то [c.85]
Одновременное присутствие в растворе последовательно образующихся комплексов может привести к серьезным ошибкам при сочетании спектрофотометрических измерений с экстракцией растворителем. Только один из последовательных комплексов — электронейтральный — может экстрагироваться органическим растворителем. Различные последовательно образующиеся комплексы, которые содержат большее или меньшее количество лигандов, чем необходимо для нейтрализации положительного заряда центрального иона металла, и сами несут положительный или отрицательный заряд, останутся в водной фазе. Возможность ошибки будет наименьшей в случае комплексов, в которых для нейтрализации электрического заряда центрального иона металла и насыщения его координационной сферы требуется такое же число лигандов, как и для координации. [c.88]
Дифференциальный спектрофотометрический метод может быть применен и в тех случаях, когда имеется наложение в спектрах поглощения соединения и реагента. Тогда при измерении по отношению к одному из использованных как эталон растворов в значительной степени исключается ошибка за счет поглощения реагента. [c.480]
XI1-3-1. При каком значении Т (парциальное поглощение) в спектрофотометрических анализах будет минимальной относительная ошибка в определении концентрации (Дс/с) для данной ошибки измерения Г [c.143]
Дифференциальный метод анализа используют для повышения точности спектрофотометрических и фотоколориметрических измерений при определении высоких концентраций веществ (от 10 до 100%). Сущность метода заключается в измерении светопоглощения анализируемого раствора относительно раствора сравнения, содержащего определенное количество испытуемого вещества это приводит к изменению рабочей области шкалы прибора и снижению относительной ошибки анализа до 0,5—1%. [c.40]
Кроме того, в настоящее время разработаны спектрофотометрические методы определения большого содержания отдельных компонентов. Эти методы называют дифференциальной фотометрией. Для точного измерения в параллельном световом потоке устанавливают стандартный раствор, близкий по составу к испытуемому раствору. Таким образом, измеряется разница интенсивности двух световых потоков ошибка измерений меньше сказывается на конечном результате. Главные трудности и недостатки, по сравнению с эмиссионным спектральным анализом, связаны с затратой времени на подготовку вещества к анализу, отделение мешающих компонентов, и др. Результат зависит от выбора условий, реактивов и концентрации посторонних ионов. Групповые методы почти не разработаны, поэтому для каждого элемента необходим отдельный ход анализа. [c.9]
Другим методом определения констант является измерение возрастания растворимости в воде исследуемого вещества при различных значениях pH раствора (глава 6), Этот метод не так точен, как потенциометрический, спектрофотометрический и кондуктометрический, но бывает полезен в тех случаях (к счастью, редких), когда вещество слишком мало растворимо в воде для того, чтобы использовать потенциометрический или кондуктометрический метод, и спектр его непригоден для определения. Катализ гидролиза эфиров, дисахаридов и глюкозидов как метод измерения констант ионизации представляет лишь исторический интерес. В ряде случаев этот метод приводил к очень грубым ошибкам. [c.18]
Обычно спектрофотометрические измерения проводят в таких условиях, когда оптическая плотность исследуемого раствора лежит в 1феде-лах А = 0,2—0,8, так как именно при таких значениях оптической плотности достигается минимальная ошибка спектрофотометрических измерений. [c.528]
Общепринято, что такое ограничение не распространяется па спектрофотометрические данные, и отклонения обычно определяют как разность между необходимым и рассчитанным све-топоглощением [4, И, 12, 53, 72—74]. Обычно при определенных условиях нет необходимости использовать веса, так как в этом случае ошибки спектрофотометрического измерения преобладают над ошибками измерения концентрации [11, 12, 75]. Кроме того, показания современных спектрофотометров имеют постоянную дисперсию в некотором диапазоне значений светопоглощения (см. разд. 8.3, п. 6). Однако если измерять светопоглощение одного и того же раствора при нескольких длинах волн, то будет наблюдаться корреляция ошибок. Для математической корректности следовало бы учесть такую корреляцию, введя весовую матрицу, содержащую ковариации переменных. Тем не менее корреляцией можно пренебречь, так как спектрофотометрические ошибки начинают проявляться, когда ошибки в концентрациях составляют несколько десятых долей процента, а ошибки в измерении светопоглощения— несколько тысячных [12]. Показано [12], что даже в случае преобладания концентрационных ошибок пренебрежение корреляцией незначительно влияет на результат. [c.96]
В настоящее время метод остановленной струи широко приме-ляется для решения многих задач химической кинетики установление механизмов химической реакции, определение стадий, лимитирующих протекание реакции обнаружение промежуточных комплексов, определение кинетики ферментативных реакций, установление числа и концентрации активных центров фермента, изучение быстрых конформационны5( переходов в белках и нуклеиновых кислотах. Метод требует быстрой регистрации это единственное существенное ограничение его применимости. Особое внимание при применении метода остановленной струи необходимо уделять тер-мостатированию, так как разница в температурах в кювете наблюдения и растворе смеси реагентов может привести к большим оптическим ошибкам, затрудняющим установление механизма наблюдаемой реакции. Точность определения констант скоростей данным методом примерно такая, как и при обычных спектрофотометрических измерениях кинетики химических реакций. [c.28]
Рассмотрим в первую очередь ошибки, вытекающие из самой сущности законов поглощения излучений, и основные закономерности, установленные еще в 1937 г. Туайменом и Лотианом [19]. Найденная ими зависимость ошибки измерения А от ее абсолютного значения является определяющей в оценке ошибок спектрофотометрических измерений. [c.30]
Иногда в случае неблагоприятных условий спектрофотометрические измерения подвержены более высоким ошибкам. Например, реакцию гафния (IV) с хлораниловой кислотой в 3 М хлорной кислоте изучали спектрофотометрически в области 260—360 нм. Было измерено светопоглощение двенадцати растворов при двадцати одной длине волны [6]. На рис. 2.4 показана зависимость определяемого числа частиц от заданной ошибки матричного элемента. Результаты, полученные при исследовании хлораниловой кислоты в 3 М хлорной кислоте, также показаны на рис. 2.4. [c.41]
Определение по собственному светопоглощению. Метод основан на спектрофотометрическом измерении светопоглощения водного, раствора хлора [164, 524] или его раствора в I4 [117, 946] в УФ-области спектра (330—350 нм). Нижний предел определяемой концентрации хлора 2-10 М (1 мкг мл). Относительная ошибка при определении 10 М хлора составляет 4%, для более низких концентраций (< 10 М) ошибка увеличивается до 30— 50% [117]. [c.68]
Для индикации и регистрации показаний анализаторов все шире применяют цифровые преобразователи и цифровые регистраторы, обладающие целым рядом преимуществ перед аналоговыми, к которым в первую очередь относятся почти полное устранение ошибки считывания показаний и возможность непосредственной обработки данных на вычислительной машине. В состав цифрового регистрирующего устройства входят аналого-цифровой преобразователь, индикатор и перфоратор с логической схемой управления. Голландской фирмой Витатрон для регистрации и обработки результатов спектрофотометрических измерений выпускаются цифровой преобразователь ОНР 100 и цифровой регистратор ОКР 200. [c.135]
Спектрофотометрические измерения. На рис. 1 показаны ультрафиолетовые спектры перксеноната при различных значениях pH. Поскольку ионную силу растворов не контролировали, о результатах спектрометрических измерений можно сделать только качественные заключения. Однако очевидно, что при pH ниже И в перксенонатном растворе появляются новые формы соединений ксенона. В пределах ошибки опыта имеются две изобестических точки, что указывает на то, что во всем интервале pH имеются только две основные поглощающие формы. [c.237]
Свегла, Палл и Ердеи показали , что для вычисления ошибок спектрофотометрических измерений недостаточно учитывать только ошибки показания прибора ошибки возникают также из-за неопределенности отрезков, отсекаемых на осях координат калибровочными графиками и из-за различных наклонов последних. [c.30]
Сопоставление активационных параметров кислотного гидролиза алкилсульфатов с длинной цепью и немицеллярного этилсуль-фата показывает, что ускорение реакции при образовании мицелл связано главным образом с уменьшением энтальпии активации, а не с увеличением энтропии [212]. Этот вывод был получен с использованием потенциометрических данных. Однако энергия активации кислотного гидролиза додецилсульфата натрия, полученная из спектрофотометрических измерений, оказалась одинаковой в мицеллярных и истинных растворах (табл. 8), тогда как энтропия активации была на 6,9 энтр. ед. больше в случае мицеллярного раствора [215]. Это противоречие, вероятно, объясняется неодинаковым выбором стандарта для сравнения (раствор этилсульфата и неми-целлярный раствор додецилсульфата). Возможно также, что расхождения связаны с отклонениями температурной зависимости от уравнения Аррениуса и зависящими от температуры ошибками потенциометрического метода. [c.282]
Такой спектральный анализ требует трудно достижимой точности спектрофотометрических измерений. Он осложнен взаимным наложением аналитических полос свободных молекул и Н-комплексов, температурной зависимостью коэффициентов поглощения этих полос, неудобством и неточностью термостатирования (из-за нагрева образца излучением) и другими факторами. Ошибки спектральных определений АН составляют от 0,2 ккал1моль для прецизионных измерений до 0,5—1 ккалЫоль для обычных, но эти величины скорее характеризуют лишь невоспроизводимость измерений, а действительные неточности больше Расхождения результатов разных авторов часто намного превышает предполагаемые ошибки, достигая целых единиц ккалЫоль, или приблизительно 100% от измеряемой величины Поэтому, несмотря на большое число опубликованных данных, надежные сходящиеся значения энтальпий водородных связей известны все еще для сравнительно немногих систем . [c.139]
В работе [1049] изучены условия, при которых возможно быстрое спектрофотометрическое определение ртути в неорганических соединениях. Показано, что закон Вера выполняется для концентраций (0,5—4)-10 М Hg(II). Относительное стандартное отклонение составляет 1,8%. Изучено влияние концентрации иодида калия на определение ртути и найдено, что для 2,2-10 М Hg(II) поглощение остается неизменным, если концентрация иодида калия изменяется от 1,2 до 0,8 М. Установлено, что при pH 4 окисление Т до Тз становится заметным, однако ошибка не превышает 1%. Измерение поглощения ртутного комплекса при pH 10 дает ошибку 1%. Низкие величины оптической плотности могут быть получены при высоких pH из-за образования частиц Hg(OH) . На определение ртути данным методом оказывают влияние анионы СгО , СгзО , поглощающие в области 323 млг. Влияние СН связано с образованием частиц типа Hg( N) J4 . Ионы Ag , Сг + не влияют, если их концентрация равна 2-10 М. Но медь, платина, золото окисляют Т до и поэтому должны быть восстановлены кислым раствором НааЗгОз до анализа. Влияют на определение ртути ионы Ре(П), РЬ(П), В1(1П), Т1(1), которые дают видимые осадки в 1 М КТ при концентрации их. <1.10 М. Этот метод может быть применен в присутствии галогенидов и псевдогалогенидов. [c.105]
Одна из групп исследователей [16] вычисляла константы устойчивости, используя уравнения материального баланса. Минимизировалась сумма квадратов отклонений аналитической концентрации иона водорода. В этом случае взвешивание особенно важно, поскольку ошибка измерения pH соответствует большим отклонениям при низких значениях pH, чем при высоких [13]. Обычно взвешивание более необходимо при потенциометрических вычислениях, чем в спектрофотометрических методах 1 жно оно и тогда, когда используются отклонения функции п. Оказалось, что вычисленные веса изменяются в слишком широких пределах [26, 68, 69]. Возможно, частичной причиной этого является то, что авторы аппроксимируют данные функцией, зависимые переменные которой сами являются функциями экспериментальных наблюдений. Так, очевидно, что полная аналитическая концентрация иона водорода является экспоненциальной функцией от pH. Таким образом, условия применимости метода наименьших квадратов (разд. 4.6) выполнены не полностью, поскольку неточные зависимые переменные сопоставляются с функциями от точных значений независимых переменных. Особенно следует избегать использования отклонений функции образования п. Правильным будет применять для расчета всех потенциометрических данных функцию суммы квадратов разностей между вычисленными и наблюдаемыми э. д. с. Дополнительное преимущество такого подхода — возможность использовать единичные веса до тех пор, пока нет веских оснований полагать противное. Примером использования единичных весов служит минимизация суммы квадратов разностей меладу вычисленным и наблюдаемым объемом титрантов в процессе кислотно-основного титрования [29]. Другие исследователи также для простоты вводили допущение о единичности весовой матрицы [11, 15, 31, 51], и было сообщение, что и с весовыми коэффициентами и без них получались одни и те же значения рассчитанных констант устойчивости. [c.95]
УРАЛЬСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
МЕТОДИЧЕСКИЕ УКАЗАНИЯ К ЛАБОРАТОРНЫМ РАБОТАМ «СПЕКТРОФОТОМЕТРИЧЕСКИЙ АНАЛИЗ» ПО СПЕЦКУРСУ «ОПТИЧЕСКИЕ МЕТОДЫ АНАЛИЗА» ДЛЯ СТУДЕНТОВ 4 КУРСА ХИМИЧЕСКОГО ФАКУЛЬТЕТА. СПЕЦИАЛЬНОСТЬ «ХИМИЯ»
ЕКАТЕРИНБУРГ 2005
Методические указания подготовлены кафедрой аналитической химии
Составитель:
Буянова Е.С.
Емельянова Ю.В.
Уральский государственный университет
2005
ОТ СОСТАВИТЕЛЯ
При изучении специального курса «Оптические методы анализа» студенты осваивают наиболее распространенные методы качественного и количественного эмиссионного спектрального анализа, спектрофотометрического анализа. В настоящих методических указаниях описаны лабораторные работы, выполнение которых позволяет студентам получить определенные навыки в проведении точного аналитического эксперимента и обработке экспериментальных данных. В руководстве описана необходимая аппаратура, используемая при различных измерениях, правила ее эксплуатации и порядок измерений. Описанию лабораторных методик предшествует краткое изложение теоретических основ метода, облегчающее выполнение конкретных аналитических задач. Методические указания разделены на две части: спектральный анализ и спектрофотометрический анализ.
Выполняя практические работы, студент должен выполнять следующие правила:
- Ознакомиться с инструкцией по технике безопасности при работе в лаборатории
- Ознакомиться с описанием конкретной работы, уяснить цель работы и методику ее выполнения.
- Ознакомиться с описанием прибора, на котором выполняется работа и методикой измерений на нем.
- Приготовить в строгом соответствии с методикой необходимые приборы, материалы, реактивы и посуду.
- Получить у преподавателя или дежурного лаборанта разрешение на включение прибора.
- Получить у преподавателя или дежурного лаборанта контрольную задачу и необходимые материалы.
- По окончании работы выключить прибор, привести в порядок и сдать рабочее место лаборанту.
- Оформить и сдать преподавателю отчет о проделанной работе.
Краткая теория
Методы анализа, основанные на измерении поглощения излучения молекулярной средой в видимой и УФ-областях, называют спектрофотометрическими. Единой теоретической базой всех разновидностей спектрофотометрии является закон Бугера – Ламберта – Бера:
A = k ∙ l ∙ c
Коэффициент поглощения k в данном выражении равен оптической плотности при единичной концентрации и толщине слоя и в зависимости от способа выражения последних, может иметь разные единицы измерения. В количественном анализе обычно выражают концентрацию в молях на литр, а толщину слоя – в сантиметрах, тогда k называют молярным коэффициентом поглощения и обозначают буквой . Молярный коэффициент поглощения – важнейшая молекулярная характеристика, не зависящая от концентрации и толщины поглощающего слоя. Она может служить объективным критерием чувствительности фотометрического определения. Светопоглощение подчиняется также закону аддитивности: оптическая плотность смеси веществ равна сумме оптических плотностей каждого из них (при условии подчинения закону Бугера – Ламберта – Бера). Для одной и той же длины волны и толщины слоя для смеси веществ
A = ε1 ∙l1 ∙c1 + ε2 ∙l2 ∙c2 + …εn ∙ln ∙cn
Отклонения от закона Бугера – Ламберта – Бера. Поведение поглощающих свет систем подчиняется закону Бугера – Ламберта – Бера при определенных условиях. При нарушении этих условий молярный коэффициент поглощения изменяется. Если он уменьшается, наблюдаются отрицательные отклонения от закона, если возрастает – положительные отклонения. Причины отклонений от основного закона светопоглощения могут быть кажущимися и истинными. Кажущиеся причины, обусловленные немонохроматичностью светового потока, рассеянием света и случайными излучениями, называют инструментальными, а вызванные химическими взаимодействиями – химическими. Истинные причины связаны с изменениями в окружении поглощающих частиц при повышении концентрации и с допущениями, сделанными при выводе основного закона светопоглощения.
Представление спектров поглощения. Спектр поглощения вещества – графическое изображение распределения поглощаемой энергии по длинам волн. Способы представления спектров различаются величинами, откладываемыми по осям абсцисс и ординат. По оси ординат откладывают оптическую плотность, логарифм оптической плотности, пропускание (в долях пропускания или в процентах). По оси абсцисс откладывают длину волны, частоту, волновое число. Выбор той или иной величины определяется стоящими перед исследователем задачами, областью спектра; величиной поглощения и т. п.
Для целей качественного анализа удобно представить спектр в координатах длина волны – молярный коэффициент поглощения. В случае подчинения закону Бугера – Ламберта – Бера независимо от концентрации спектр сохраняет свой вид. При отклонениях от закона наблюдается смещение максимума поглощения или другие изменения.
Для выявления всех характерных особенностей спектральных кривых их можно продифференцировать (производная спектрофотометрия). Тогда спектр будет представлять собой зависимость первой, второй и т.д. производных оптической плотности от (): Для первой и вообще нечетных производных вместо обычной полосы поглощения получаются кривые вида дисперсионной функции. Эти производные позволяют легче выявить и определить положение точек перегиба и замаскированных пиков, поскольку в максимумах поглощения
. Вторая и последующие четные производные дают пики, совпадающие по положению с максимумом полосы поглощения по первой производной. Эти пики резче, чем исходная полоса, за счет чего может быть получено более высокое разрешение. Дифференциальный спектр можно получить также с помощью двухволнового спектрофотометра, в котором через одну и ту же кювету одновременно проходят два потока излучения с разными длинами волн.
Измерение поглощения. Прибор для измерения светопоглощения состоит из ряда узлов, соединенных в определенной последовательности. Прибор должен выполнять две основные задачи: 1) разложить полихроматический свет по длинам волн и выделить нужный интервал длин волн; 2) оценить поглощение света веществом при выбранной длине волны.
Каждый прибор включает: источник излучения, устройство для выделения нужного интервала длин волн (монохроматор или светофильтр), кюветное отделение, детектор, преобразователь сигнала, индикатор сигнала (шкалу или цифровой счетчик). Порядок расположения узлов может быть разным (например, монохроматор может стоять до кюветы или после нее).
Типичные источники излучения в спектрофотометрии – лампа накаливания с вольфрамовой нитью, дейтериевая (водородная) лампа или галогенокварцевая лампа. Эти источники излучают в широкой области спектра, поэтому излучение нужно монохроматизировать. Приборы, в которых для монохроматизации используют монохроматоры, называют спектрофотометрами (отсюда – спектрофотометрический метод анализа), а те, в которых необходимый интервал длин волн выделяют светофильтром, называют фотоэлектроколориметрами (ФЭК).
В абсорбционной спектроскопии измеряется не абсолютное значение оптической плотности, а разность оптических, плотностей исследуемого раствора и раствора, оптическая плотность которого принята за нуль (раствор сравнения). Кювета, в которую помещают исследуемый раствор, называется рабочей, а кювета для раствора сравнения – кюветой сравнения. Обе кюветы должны быть по возможности идентичны. Основное требование к кюветам – прозрачность в области спектра, в которой ведется измерение оптической плотности. Для работы в видимой области кюветы изготовляют из стекла. В ультрафиолетовой области стекло непригодно: кюветы делают из кварца. По форме кюветы бывают прямоугольными и цилиндрическими.
Для некоторых работ требуются кюветы специальной конструкции. Для исследования кинетики реакций применяют термостатированные кюветы (с «рубашкой» из стекла, через которую циркулирует вода с определенной температурой). В автоматических установках используют проточные кюветы.
Для приема сигнала в видимой и УФ-областях обычно применяют фотоэлементы и фотоумножители. Наиболее употребительны сурьмяно – цезиевые (в диапазоне 180 – 650 нм) и кислородно – цезиевые (в диапазоне 600 – 1100 нм) фотоэлементы.
В зависимости от способа измерения различают одно- и двухлучевые приборы, от способа монохроматизации – фотоэлектроколориметры и спектрофотометры, от способа регистрации – визуальные, регистрирующие и нерегистрирующие приборы.
Фотоэлектроколориметры имеют простую конструкцию и пригодны для измерений в видимой и ближней (до 300 нм) УФ-областях. Оптические детали этих приборов изготовлены из стекла или просветленного стекла. Фотоэлектроколориметры используют чаще всего для проведения серийных определений концентраций веществ.
Спектрофотометры имеют более сложную конструкцию и часто снабжены электронными устройствами (усилителями фототока, дисплеями). Оптические детали изготовлены из кварца. Спектрофотометры применяют для получения спектров поглощения, а также для измерений концентраций веществ с узкой полосой поглощения или веществ с близкими длинами волн поглощения.
Аппаратура и принадлежности для фотометрического анализа
КОЛОРИМЕТР ФОТОЭЛЕКТРИЧЕСКИЙ
КОНЦЕНТРАЦИОННЫЙ КФК-2
1. Описание прибора
Принцип измерения коэффициента пропускания состоит в том, что на фотоприемник направляются поочередно различные световые потоки: полный и прошедший через исследуемую среду, и определяется отношение этих потоков.
Принципиальная оптическая схема фотометра приведена на рис. 1.
Рис. 1. Оптическая схема фотоэлектроколориметра КФК-2
2. Подготовка к работе
2. 1. Колориметр включить в сеть за 15 минут до начала измерений. Во время прогрева кюветное отделение должно быть открыто (при этом шторка перед фотоприемниками перекрывает световой пучок).
2. 2. Ввести необходимый по роду измерения цветной светофильтр.
2.3. Установить минимальную чувствительность колориметра. Для этого ручку «ЧУВСТВИТЕЛЬНОСТЬ» (рис. 2) необходимо установить в положение 1, ручку «УСТАНОВКА 100 ГРУБО» – в крайнее левое положение.
2. 4. Перед измерениями и при переключении фотоприемников проверить установку стрелки колориметра на «0» по шкале коэффициентов пропускания Т при открытом кюветном отделении. При смещении стрелки от нулевого положения, ее подводят к нулю с помощью потенциометра «НУЛЬ», выведенного под шлиц.
Рис. 2. Внешний вид колориметра КФК-2
3. Порядок работы
3. 1. Измерение коэффициента пропускания
3. 1. 1. В световой пучок поместить кювету с растворителем или контрольным раствором, по отношению к которому производятся измерения.
3. 1. 2. Закрыть крышку кюветного отделения.
3. 1. 3. Ручками «ЧУВСТВИТЕЛЬНОСТЬ» и «УСТАНОВКА 100 ГРУБО» и «ТОЧНО» установить отсчет «100» по шкале колориметра.
3. 1. 4. Затем, поворотом ручки кювету с растворителем или контрольным раствором заменить кюветой с исследуемым раствором.
3. 1. 5. Снять отсчет по шкале колориметра, соответствующей коэффициенту пропускания исследуемого раствора в процентах. Для регистрирующего прибора типа M 907-10 отсчет снимают по шкале коэффициентов пропускания Т в процентах, или по шкале Д – в единицах оптической плотности. Абсолютная погрешность измерения коэффициента пропускания не превышает 1%.
3. 1. 6. Измерение провести 3 – 5 раз и окончательное значение измеренной величины определить как среднее арифметическое из полученных значений.
3. 2. Определение концентрации вещества в растворе
При определении концентрации вещества в растворе следует соблюдать следующую последовательность в работе:
– выбор светофильтра;
– выбор кюветы;
– построение градуировочной зависимости для данного вещества;
– измерение оптической плотности исследуемого раствора и определение концентрации вещества в растворе.
3. 2. 1. Выбор светофильтра.
Наличие в колориметре узла светофильтров и набора кювет позволяет подобрать такое их сочетание, при котором погрешность в определения концентрации будет наименьшей.
Выбор светофильтра проводят следующим образом. Наливают раствор в кювету (о выборе размера кювет см. ниже) и определяют оптическую плотность для всех светофильтров.
По полученным данным строят зависимость, откладывая по горизонтальной оси длины волн, соответствующие максимуму коэффициента пропускания светофильтров, указанные в описании колориметра, а по вертикальной оси – соответствующие значения оптической плотности раствора. Отмечают тот участок кривой, для которого выполняются следующие условия:
– оптическая плотность имеет максимальную величину;
– ход кривой примерно параллелен горизонтальной оси,
т. е. оптическая плотность мало зависит от длины волн. Светофильтр для работы выбирают так, чтобы длина волны, соответствующая максимуму коэффициента пропускания светофильтра, приходилась на отмеченный выше участок спектральной кривой испытуемого раствора.
Если эти условия выполняются для нескольких светофильтров, то выбирают тот из них, для которого чувствительность колориметра выше.
3. 2. 2. Выбор кюветы.
Относительная ошибка определения концентрации раствора будет различной при работе на разных участках шкалы колориметра и достигает минимума при значении оптической плотности 0.4. Поэтому при работе на колориметре рекомендуется, путем соответствующего выбора кювет, работать вблизи указанного значения оптической плотности.
Предварительный выбор кювет проводится визуально, соответственно интенсивности окраски раствора. Если раствор интенсивно окрашен (темный), следует пользоваться кюветами с малой рабочей длиной. В случае слабо окрашенных растворов рекомендуется работать с кюветами с большой рабочей длиной.
В предварительно подобранную кювету наливают раствор и измеряют его оптическую плотность, вводя в ход лучей соответствующий для данного раствора светофильтр.
Второе условие может для некоторых растворов не иметь места, тогда при выборе светофильтра ограничиваются выполнением первого условия.
При измерении ряда растворов кювету заполняют раствором средней концентрации. Если полученное значение оптической плотности составляет примерно 0.3 – 0.5 – выбирают данную кювету для работы с этим раствором. В том случае, когда это условие не выполняется, следует испробовать другую кювету. Если величина измеренной оптической плотности больше 0.5 – 0.6, берут кювету меньшей рабочей длины, если величина оптической плотности меньше 0.3 – 0.2, следует выбрать кювету с большей рабочей длиной.
3. 2. 3. Построение градуировочного графика для данного вещества.
Построение градуировочного графика проводят следующим образом. Готовят ряд растворов данного вещества с известными концентрациями, охватывающими область возможных изменений концентраций этого вещества в исследуемом растворе.
Измеряют оптические плотности всех растворов и строят градуировочный график, откладывая по горизонтальной оси известные концентрации, а по вертикальной соответствующие им значения оптической плотности.
3. 2. 4. Определение концентрации вещества в растворе.
По градуировочному графику в дальнейшем определяют неизвестную концентрацию вещества в исследуемых растворах. Для этого раствор наливают в ту же кювету, для которой построена градуировочная зависимость, и, выбрав тот же светофильтр, определяют оптическую плотность раствора. Затем по градуировочному графику находят концентрацию, соответствующую измеренному значению оптической плотности.
Примечания: 1. Часто в работе бывает удобнее пользоваться градуировочными таблицами, которые составляются по данным градуировочной зависимости.
2. Градуировочный график следует время от времени проверять.
Фотометр фотоэлектрический КФК-3