Тренировочный вариант №4 решу ЕГЭ 2023 по биологии 11 класс с ответами и решением по новой демоверсии ЕГЭ 2023 года от ФИПИ для подготовки на 100 баллов в новом формате, задания взяты из банка заданий ФИПИ и с экзамена прошлых лет.
егэ2023-биология-вариант4
Скачать вариант и ответы
1. Рассмотрите таблицу «Методы биологических исследований» и заполните пустую ячейку, вписав соответствующий термин.
Ответ: экосистемный
2. Экспериментатор перенес дрожжи, растущие на глюкозе, из анаэробной среды в аэробную. Как изменится скорость потребления глюкозы и количество продуктов неполного окисления, если АТФ будет синтезироваться с прежней скоростью и кислород будет участвовать в обмене веществ? Для каждой величины определите соответствующий характер её изменения:
- 1) увеличилась
- 2) уменьшилась
- 3) не изменилась
Ответ: 23
3. При беге на беговой дорожке у человека пульс участился в два раза от исходных 75 ударов в минуту. Ударный объем крови тоже возрос в два раза – от 60 мл до 120 мл. Чему будет равен минутный объем крови у такого интенсивно работающего сердца? В ответе запишите только количество литров.
Ответ: 18
4. Определите соотношение фенотипов в потомстве при дигибридном скрещивании двух дигетерозигот при полном сцеплении рецессивных и доминантных генов попарно. Полное доминирование. Запишите в виде последовательности цифр в порядке убывания.
Ответ: 31
5. Каким номером на схеме указана клетка с диплоидным набором однохроматидных хромосом?
Ответ: 4
6. Установите соответствие между характеристиками и типами клеток, обозначенным цифрами на схеме: к каждой позиции, данной в первом столбце, подберите соответствующую позицию из второго столбца.
- А) имеют акросому
- Б) гаплоидный набор однохроматидных хромосом
- В) сперматоцит 2 порядка
- Г) диплоидные клетки
- Д) происходит репликация
- Е) клетки имеют кинетосому
Ответ: 332113
7. Выберите три верных ответа из шести и запишите в таблицу цифры, под которыми они указаны. Какие признаки характерны для молекулы ДНК?
- 1) состоит из двух полипептидных нитей, закрученных в спираль
- 2) состоит из двух полинуклеотидных нитей, комплементарных и антипараллельных друг другу
- 3) в состав нуклеотидов входит рибоза
- 4) имеет нуклеотид, содержащий тимин
- 5) способна к репликации
- 6) состоит из одной полинуклеотидной цепи, имеются петли (двуцепочечные фрагменты)
Ответ: 245
8. Установите правильную последовательность реакций энергетического обмена веществ. Запишите в таблицу соответствующую последовательность цифр.
- 1) образование углекислого газа
- 2) попадание ПВК в митохондрии
- 3) инициация молекулы глюкозы с затратой 2 АТФ
- 4) гидролиз молекулы крахмала
- 5) использование кислорода
Ответ: 43215
9. Все представленные на рисунках 1-4 объекты относятся к одной стадии жизненных циклов растений различных отделов. Как называют эту стадию?
Ответ: гаметофит
11. Выберите три верно обозначенных подписи к рисунку, на котором изображён участок тела гидры. Запишите в таблицу цифры, под которыми они указаны.
- 1) нервная клетка
- 2) стрекательная клетка
- 3) эпителиально-мускульная клетка
- 4) промежуточная клетка
- 5) пищеварительно-мускульная клетка
- 6) эктодерма
Ответ: 356
12. Установите последовательность таксономических названий, начиная с наименьшего. Запишите в таблицу соответствующую последовательность цифр.
- 1) Животные
- 2) Хордовые
- 3) Караси
- 4) Карповые
- 5) Карась золотой
- 6) Лучепёрые рыбы
Ответ: 534621
13. Какие структуры из представленных на рисунках А-В максимально увеличивают площадь поверхности пищеварительного канала? В ответе запишите только название структуры.
Ответ: микроворсинка
15. Выберите три верно обозначенных подписи к рисунку «Скелет человека». Запишите в таблицу цифры, под которыми они указаны.
- 1) Лучевая кость
- 2) Ключица
- 3) Локтевая кость
- 4) Подвздошная кость
- 5) Большеберцовая
- 6) Пяточная кость
Ответ: 124
16. Расположите в правильном порядке соподчинение уровней организации системы человека, начиная с наибольшей. Запишите в таблицу соответствующую последовательность цифр.
- 1) кровеносная система
- 2) сердечная мышца
- 3) стенка сердца
- 4) мышечная клетка
- 5) сердце
- 6) миозин
Ответ: 153246
18. Выберите три верных ответа из шести и запишите в таблицу цифры, под которыми они указаны. Укажите консументы в экосистеме широколиственного леса:
- 1) бересклет бородавчатый
- 2) повилика
- 3) ежа сборная
- 4) домовая мышь
- 5) спорынья
- 6) денитрифицирующие бактерии
Ответ: 245
20. Установите последовательность этапов эволюции растений в хронологическом порядке. Запишите в таблицу соответствующую последовательность цифр.
- 1) формирование многоклеточных талломов
- 2) возникновение корневых систем
- 3) развитие покровных и механических тканей
- 4) образование пестичного и тычиночного аппаратов
- 5) появление защитных семенных оболочек
Ответ: 13254
22. Проанализируйте диаграмму «Количество укусов людей малярийными комарами на острове Борнео». На диаграмме показано число человек, которые были укушены за ночь определенное количество раз. Выберите все утверждения, которые можно сформулировать на основании анализа представленных данных. Запишите в ответе цифры, под которыми указаны выбранные утверждения.
- 1) Вероятность заразиться малярией на Борнео очень высока.
- 2) Людей, которых комары укусили больше 23 раз за ночь, меньше 10%.
- 3) Большинство людей были укушены 2-6 раз за ночь.
- 4) Малярия – заболевание, распространенное в тропическом климате.
- 5) Малярийный комар очень распространен на Борнео.
Ответ: 23
23. Какая переменная в этом эксперименте будет зависимой (изменяющейся), а какая – независимой (задаваемой)? Объясните, как в данном эксперименте можно поставить отрицательный контроль*. С какой целью необходимо такой контроль ставить?
24. Как именно экспериментатор изменил рН межмембранного пространства? Как влияет рН межмембранного пространства на синтез АТФ?
25. Назовите клеточную структуру, изображенную на рисунке. Из какого вещества она состоит. Укажите особенности строения этой структуры и ее функции в клетке. Какие еще структуры клетки имеют схожее строение?
26. В зависимости от строения своей молекулы дыхательный белок гемоглобин может иметь различную степень сродства к кислороду, то есть различную способность присоединять кислород к железосодержащему гему. Чем меньше сродство гемоглобина к кислороду, тем медленнее кровь связывает кислород из внешней среды. Как различается сродство гемоглобина к кислороду у высокогорных лам, в отличие от верблюдов, обитающих в степях Монголии? Ответ аргументируйте. Какие параметры форменных элементов крови обеспечивают её кислородную ёмкость (способность насыщаться кислородом) у различных групп позвоночных животных?
27. Ниже приведено филогенетическое древо класса млекопитающие. В точках ветвления указано предположительное время расхождения соответствующих групп (в миллионах лет назад). Животные какого отряда являются ближайшими родственниками китообразных? По изображённому филогенетическому древу определите, когда примерно существовал ближайший общий предок бурого медведя и пятнистого оленя? Какой эре и какому периоду это соответствует? Почему в Австралии из плацентарных млекопитающих присутствует только человек и привезённые им животные?
28. Известно, что комплементарные цепи нуклеиновых кислот антипараллельны (5′ концу одной цепи соответствует 3′ коней другой цепи). Синтез нуклеиновых кислот начинается с 5′ конца. Рибосома движется по иРНК в направлении от 5′ к З’ концу. Ген имеет кодирующую и некодирующую области. Кодирующая область гена называется открытой рамкой считывания. Фрагмент конца гена имеет следующую последовательность нуклеотидов (нижняя цепь матричная (транскрибируемая)). 5′ -ААГЦГЦТААТАГЦАТАТТАГАГЦТА-3′ 3′ -ТТЦГЦГАТТАТЦГТАТААТЦТЦГАТ-5′ Определите верную открытую рамку считывания и найдите последовательность аминокислот во фрагменте конца полипептидной цепи. Известно, что конечная часть полипептида, кодируемая этим геном, имеет длину более четырёх аминокислот. Объясните последовательность решения задачи. Для выполнения задания используйте таблицу генетического кода. При написании последовательностей нуклеиновых кислот указывайте направление цепи.
29. На Х- и У -хромосомах человека существуют псевдоаутосомные участки, которые содержат аллели одного гена, и между ними может происходить кроссинговер. Один из таких генов вызывает нарушения в развития скелета. Рецессивный аллель куриной слепоты (ночной слепоты) наследуется сцепленно с полом. Женщина, имеющая нарушения в развитии скелета и страдающая куриной слепотой, родители которой имели нормально развитый скелет, вышла замуж за мужчину без этих заболеваний, мать которого страдала нарушениями в развитии скелета. Родившаяся в этом браке дочь без указанных заболеваний вышла замуж за мужчину, страдающего нарушениями развития скелета, но не имеющего куриной слепоты. Составьте схемы решения задачи. Определите генотипы родителей и генотипы, фенотипы, пол возможного потомства. Возможно ли рождение о первом браке ребёнка, страдающего двумя названными заболеваниями? Ответ поясните.
Варианты в формате ЕГЭ 2023 по биологии
17 октября 2022 Статград биология 11 класс ЕГЭ 2023 варианты с ответами
ПОДЕЛИТЬСЯ МАТЕРИАЛОМ
Межмембранное пространство
Cтраница 4
Анализ полученных экспериментальных данных дает возможность сделать следующие качественные заключения. Засыпка в межмембранное пространство анионита АН-31 обеспечивает селективное извлечение из раствора ионов S0f — особенно при малых скоростях фильтрования. В то же время, несмотря на предпочтительное поглощение иона Mg2 катионитом КБ-4 в равновесных условиях, в экспериментах на модели электродиализнои установки при засыпке катионита КБ-4 в межмембранное пространство селективного удаления иона Mg2 не было отмечено. Последнее обстоятельство, вероятно, связано с малой подвижностью иона Mg2 1 в катионите КБ-4. При этом перенос электрических зарядов внутри ионита осуществляется практически только ионами натрия, так что селективно поглощен-ные ионы магния с малой вероятностью переходят из ионита непосредственно в мембрану и затем в боковую камеру.
[46]
В первом из этих процессов электроны переносятся вместе с протонами, которые выходят в межмембранное пространство, во втором — только электроны. Первый шаг первой петли соответствует восстановлению NAD группой SH2 органического субстрата. Это приводит к одновременному переносу Н и электронов. При этом протоны переходят из матрикса в межмембранное пространство, что приводит к понижению рН и увеличению мембранного потенциала Дсрт.
[48]
Если есть необходимость убедиться в работоспособности обратного клапана, то это делают так. Отключающие устройства на входе и выходе из ГРП при этом должны быть закрыты. Факт срабатывания ПКК-40 в результате того, что в межмембранное пространство подается воздух, давление которого достигает верхнего предела срабатывания, также может служить подтверждением наличия прохода воздуха через обратный клапан.
[49]
При увеличении измеряемого перепада давление в плюсовой камере будет выше, мембраны прогнутся влево, и на рычаге относительно точки О создастся момент силы, пропорциональный перепаду давлений — это выходной сигнал измерительного блока. Мембранный блок рассчитан на определенный измеряемый перепад. Чтобы мембранный блок при этом не вышел из строя, при прогибе перегруженная мембрана своим профилем совместится с перегородкой, имеющей такой же профиль, а вторая мембрана будет опираться на заполняющую межмембранное пространство жидкость.
[50]
Описанный ниже метод основан на различиях липидного состава: внешняя мембрана в отличие от внутренней содержит значительные количества холестерина. Последний способен образовывать специфические комплексы с дигитонином — детергентом, сходным по химической структуре с холестерином. Обработка интактных митохондрий в строго контролируемых условиях дозированными количествами дигитонина приводит к разрушению внешней мембраны и вымыванию во внешнюю среду содержимого мембранного пространства. Матрикс, ограниченный внутренней мембраной ( митопласты), можно отделить центрифугированием. Супернатант, остающийся после отделения митопластов, подвергается дальнейшему разделению на фракцию внешних мембран и ферментов межмембранного пространства. Внутреннее содержимое митопластов можно перевести в раствор, разрушив последние ультразвуком или подходящим детергентом.
[51]
Пневматическая регулирующая часть работает следующим образом. Воздух после редуктора с давлением 1 1 кГ / см2, поступает через постоянный дроссель 19 в камеру 16 и проходит по внутренней трубке манометрической пружины 7 к соплу 5, расположенному на свободном конце манометрической пружины. Одновременно сжатый воздух поступает через отверстие 13 золотника 12 в камеру 14 я в линию исполнительного механизма. При понижении уровня жидкости в камере уровнемера заслонка 6 отходит от сопла 5 на некоторое расстояние, и часть воздуха через сопло выходит в атмосферу, давление воздуха в камере 16 понизится, вследствие чего мембранная сборка, состоящая из мембраны 18, металлического диска, размещенного под мембраной, и второй мембраны 17 со втулкой, под действием пружины 11 переместится вверх. В результате воздух по каналу металлического диска поступает в межмембранное пространство и далее через отверстие 15 отводится в атмосферу. Давление в линии исполнительного механизма понизится, и клапан, установленный на линии выхода жидкости из аппарата, прикроется. При повышении уровня жидкости в камере уровнемера буек перемещается вверх и вызывает пропорциональное изменение угла раскручивания упругой трубки, а следовательно, и приближение заслонки к соплу. Давление в линии исполнительного механизма ( на выходе из усилительного реле А) повысится, и клапан откроется.
[52]
Эта разница в диаметрах отверстий приводит к тому, что при откручивании пусковой пробки газ среднего давления, находившийся до этого в межмембранном пространстве, мгновенно выбрасывается в атмосферу. Навстречу ей, сверху, под действием пружины 2 так же практически мгновенно опустится верхняя мембрана. Следствие этого — прекращение подачи газа среднего давления в межмембранное пространство через отверстие диаметром 1 2 мм в верхней части корпуса — клапана, так как его плотно перекроет уплотнение верхнего клапана.
[53]
Из подмембранного пространства в межмембранное газ может попасть только одним путем — через внутреннее отверстие корпуса клапана диаметром 1 2 мм. Рассмотрим, что произойдет в ПКК-40, когда газ среднего давления впервые начинает поступать на клапан, например при выполнении пусконаладочных работ. При этом под действием веса большой шайбы 15 нижняя мембрана займет крайнее нижнее положение, так как значения давления газа под и над ней будут равны. Пробка 5 закручена до отказа и поэтому плотно сидит на своем седле, не давая газу, заполняющему межмембранное пространство, выйти из него в атмосферу через сбросное отверстие.
[54]
Вслед за ядром в клетке были открыты ( около 1900 г.) так называемые крупные гранулы, или митохондрии. По своим размерам эти клеточные органеллы также стоят на втором месте непосредственно за ядром. Митохондрии, окрашенные такими красителями, как янус зеленый, находятся почти на пределе разрешения обычного светового микроскопа. В фазово-контрастном микроскопе их различить легко. Однако подлинных успехов в изучении структуры митохондрии удалось добиться только в последние 15 лет после появления электронного микроскопа. Число митохондрий, их размеры и форма могут в разных клетках сильно варьировать, но их ультраструктура во всех случаях в достаточной степени сходна и вместе с тем отличается от ультраструктуры других органелл настолько, что в большинстве случаев однозначная идентификация этих частиц не составляет большого труда. Это фундаментальное сходство всех митохондрий независимо от того, какому организму они принадлежат — человеку, грибу или простейшему. Наиболее характерной чертой строения митохондрий является их мембранная система, которая состоит из относительно гладкой наружной мембраны, межмембранного пространства и высокоструктурированной внутренней мембраны, образующей многочисленные складки, называемые кристами. Кристы глубоко вдаются в интрамитохондриальный матрикс, или внутреннее пространство митохондрии. С внутренней мембраной и кристами связаны многочисленные ( до нескольких тысяч) отчетливо видимые мелкие частицы.
[55]
Страницы:
1
2
3
4
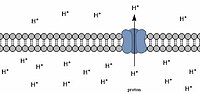
Градиент pH через мембрану, при этом протоны проходят через транспортер, встроенный в мембрану.
Внутриклеточный pH (pHi) — мера кислотность или же основность (т.е. pH ) из внутриклеточная жидкость. PHi играет решающую роль в мембранном транспорте и других внутриклеточных процессах. В среде с неподходящим pHi биологические клетки могут нарушать функцию.[1][2] Следовательно, pHi строго регулируется, чтобы обеспечить правильную клеточную функцию, контролируемый рост клеток и нормальные клеточные процессы.[3] Механизмы, регулирующие pHi, обычно считаются плазматическая мембрана транспортеры, из которых существуют два основных типа — зависимые и независимые от концентрации бикарбонат (HCO−
3). Физиологически нормальный внутриклеточный pH чаще всего составляет от 7,0 до 7,4, хотя между тканями существует различие (например, pH скелетных мышц млекопитающих обычно составляет 6,8–7,1).[4][5]. Также существует различие pH в разных органеллы, который может варьироваться от 4,5 до 8,0.[6][7] pHi можно измерить несколькими способами.[3][8]
Гомеостаз
Внутриклеточный pH обычно ниже внеклеточный pH из-за более низкой концентрации HCO3−.[9] Повышение внеклеточного (например, сыворотка ) частичное давление из углекислый газ (pCO2 ) выше 45мм рт. ст. приводит к образованию угольная кислота, что вызывает снижение pHi, поскольку диссоциирует:[10]
- ЧАС2O + CO2 ⇌ H2CO3 ⇌ H+ + HCO3–
Поскольку биологические клетки содержат жидкость, которая может действовать как буфер, pHi можно довольно хорошо поддерживать в определенном диапазоне.[11] Клетки соответственно регулируют свой pHi при повышении кислотности или основности, обычно с помощью CO.2 или HCO3– датчики присутствуют в мембране клетки.[3] Эти датчики могут позволить H + проходить через клеточную мембрану, соответственно, позволяя pHi быть взаимосвязанным с внеклеточным pH в этом отношении.[12]
Основные внутриклеточные буферные системы включают те, которые включают белки или фосфаты. Поскольку белки имеют кислые и основные области, они могут служить как донорами, так и акцепторами протонов для поддержания относительно стабильного внутриклеточного pH. В случае фосфатного буфера значительные количества слабой кислоты и конъюгированного слабого основания (H2PO4– и HPO42–) может принимать или отдавать протоны соответственно для сохранения внутриклеточного pH:[13][14]
- ОЙ– + H2PO4– ⇌ H2O + HPO42–
- ЧАС+ + HPO42– ⇌ H2PO4–
В органеллах
Приблизительные значения pH различных органелл внутри клетки.[6]
Уровень pH в конкретной органелле зависит от ее конкретной функции.
Например, лизосомы имеют относительно низкий pH, равный 4,5.[6] Кроме того, методы флуоресцентной микроскопии показали, что фагоциты также имеют относительно низкий внутренний pH.[15] Поскольку обе эти органеллы являются деградирующими органеллами, которые поглощают и расщепляют другие вещества, им требуется высокая внутренняя кислотность, чтобы успешно выполнять свою функцию.[15]
В отличие от относительно низкого pH внутри лизосом и фагоцитов, митохондриальный матрикс имеет внутренний pH около 8,0, что примерно на 0,9 единицы pH выше, чем внутри межмембранного пространства.[6][16] Поскольку окислительное фосфорилирование должно происходить внутри митохондрий, это несоответствие pH необходимо для создания градиента через мембрану. Именно этот мембранный потенциал позволяет митохондриям вырабатывать большое количество АТФ.[17]
Протоны перекачиваются из митохондриальной матрицы в межмембранное пространство по мере того, как работает электронная транспортная цепочка, что снижает pH межмембранного пространства.
Измерение
Существует несколько распространенных способов измерения внутриклеточного pH (pHi), в том числе с помощью микроэлектрода, красителя, чувствительного к pH, или с помощью методов ядерного магнитного резонанса.[18][19] Для измерения pH внутри органелл можно использовать метод, использующий pH-чувствительные зеленые флуоресцентные белки (GFP).[20]
В целом, у всех трех методов есть свои преимущества и недостатки. Использование красителей, возможно, является самым простым и достаточно точным, в то время как ЯМР представляет собой проблему относительно меньшей точности.[18] Кроме того, использование микроэлектрода может быть проблематичным в ситуациях, когда клетки слишком малы или целостность клеточной мембраны не должна нарушаться.[19] GFP уникальны тем, что они обеспечивают неинвазивный способ определения pH внутри различных органелл, но этот метод не является наиболее точным в количественном отношении способом определения pH.[21]
Микроэлектрод
Микроэлектродный метод измерения pH заключается в помещении очень маленького электрода в цитозоль клетки, проделывая очень маленькое отверстие в плазматической мембране клетки.[19] Поскольку микроэлектрод содержит жидкость с высокой концентрацией H + внутри по сравнению с внешней стороной электрода, возникает потенциал из-за несоответствия pH между внутренней и внешней частью электрода.[18][19] По этой разнице напряжений и заранее определенному pH жидкости внутри электрода можно определить внутриклеточный pH (pHi) интересующей клетки. [19]
Флуоресцентная спектроскопия
Другой способ измерения внутриклеточного pH (pHi) — использовать красители, чувствительные к pH и флуоресцирующие по-разному при различных значениях pH.[15][22] Этот метод, использующий флуоресцентную спектроскопию, заключается в добавлении этого специального красителя в цитозоль клетки.[18][19] Возбуждая краситель в клетке энергией света и измеряя длину волны света, испускаемого фотоном, когда он возвращается в свое естественное энергетическое состояние, можно определить тип присутствующего красителя и связать его с внутриклеточным pH данного клетка.[18][19]
Ядерный магнитный резонанс
Помимо использования pH-чувствительных электродов и красителей для измерения pHi, спектроскопия ядерного магнитного резонанса (ЯМР) также может использоваться для количественного определения pHi.[19] ЯМР, как правило, выявляет информацию о внутренней части клетки, помещая клетку в среду с сильным магнитным полем.[18][19] На основе соотношения между концентрациями протонированных и депротонированных форм фосфатных соединений в данной клетке можно определить внутренний pH клетки.[18] Кроме того, ЯМР также можно использовать для выявления присутствия внутриклеточного натрия, который также может предоставить информацию о pHi.[23]
С помощью ЯМР-спектроскопии было установлено, что лимфоциты поддерживать постоянный внутренний pH 7,17 ± 0,06, хотя, как и во всех клетках, внутриклеточный pH изменяется в том же направлении, что и внеклеточный pH.[24]
pH-чувствительные GFP
Для определения pH внутри органелл часто используются pH-чувствительные GFP как часть неинвазивного и эффективного метода.[20] Используя кДНК в качестве матрицы вместе с соответствующими праймерами, ген GFP может быть экспрессирован в цитозоле, а продуцируемые белки могут нацеливаться на определенные области внутри клетки, такие как митохондрии, аппарат Гольджи, цитоплазма и эндоплазматический ретикулум.[21] Если в этих экспериментах используются определенные мутанты GFP, которые очень чувствительны к pH во внутриклеточной среде, относительное количество результирующей флуоресценции может показать приблизительный pH окружающей среды.[21][25]
Рекомендации
- ^ Харгинди, S; Stanciu, D; Девеса, Дж; Альфарук, К. Кардоне, РА; Поло Ороско, JD; Devesa, P; Rauch, C; Орив, G; Anitua, E; Роджер, S; Решкин, SJ (апрель 2017 г.). «Подкисление клеток как новый подход к лечению рака, а также к пониманию и лечению нейродегенеративных заболеваний». Семинары по биологии рака. 43: 157–179. Дои:10.1016 / j.semcancer.2017.02.003. PMID 28193528.
- ^ Флинк М., Крамер С.Х., Педерсен С.Ф. (июль 2018 г.). «Роль pH в контроле пролиферации клеток». Acta Physiologica. 223 (3): e13068. Дои:10.1111 / apha.13068. PMID 29575508. S2CID 4874638.
- ^ а б c Boron WF (декабрь 2004 г.). «Регулирование внутриклеточного pH». Достижения в физиологическом образовании. 28 (1–4): 160–79. Дои:10.1152 / advan.00045.2004. PMID 15545345.
- ^ Брэндис К. «2.6 Регулирование внутриклеточной концентрации ионов водорода». Кислотно-основная физиология. Веб-сайт анестезиологического образования.
- ^ Мадшус IH (февраль 1988 г.). «Регулирование внутриклеточного pH в эукариотических клетках». Биохимический журнал. 250 (1): 1–8. Дои:10.1042 / bj2500001. ЧВК 1148806. PMID 2965576.
- ^ а б c d Асокан А., Чо М.Дж. (апрель 2002 г.). «Использование внутриклеточных градиентов pH в доставке макромолекул в клетки». Журнал фармацевтических наук. 91 (4): 903–13. Дои:10.1002 / jps.10095. PMID 11948528.
- ^ Прокщ Э. (сентябрь 2018 г.). «pH в природе, человеке и коже». Журнал дерматологии. 45 (9): 1044–1052. Дои:10.1111/1346-8138.14489. PMID 29863755.
- ^ Демут С., Варонье Дж., Йоссен В., Эйбл Р., Эйбл Д. (май 2016 г.). «Новые зонды для измерения pH и растворенного кислорода при культивировании от миллилитров до настольных». Прикладная микробиология и биотехнология. 100 (9): 3853–63. Дои:10.1007 / s00253-016-7412-0. PMID 26995606. S2CID 8434413.
- ^ Флинк М., Крамер С.Х., Педерсен С.Ф. (июль 2018 г.). «Роль pH в контроле пролиферации клеток». Acta Physiol (Oxf). 223 (3): e13068. Дои:10.1111 / apha.13068. PMID 29575508. S2CID 4874638.[требуется проверка ]
- ^ Флинк М., Крамер С.Х., Педерсен С.Ф. (июль 2018 г.). «Роль pH в контроле пролиферации клеток». Acta Physiol (Oxf). 223 (3): e13068. Дои: 10.1111 / apha.13068. PMID 29575508.
- ^ Slonczewski JL, Fujisawa M, Dopson M, Krulwich TA (2009). «Измерение pH цитоплазмы и гомеостаз у бактерий и архей». Успехи микробной физиологии. 55: 1–79, 317. Дои:10.1016 / S0065-2911 (09) 05501-5. ISBN 9780123747907. PMID 19573695.
- ^ Дженсен Ф. Б. (ноябрь 2004 г.). «PH красных кровяных телец, эффект Бора и другие связанные с оксигенацией явления в переносе O2 и CO2 в крови». Acta Physiologica Scandinavica. 182 (3): 215–27. Дои:10.1111 / j.1365-201X.2004.01361.x. PMID 15491402.
- ^ Bookallil MJ. «Кислотно-основное: pH крови — 3 — механизмы контроля». Список лекций и учебных заметок. Отделение анестезии Наффилда Сиднейского университета. Получено 2019-05-28.
- ^ Бертон РФ (апрель 1978 г.). «Внутриклеточная буферизация». Физиология дыхания. 33 (1): 51–8. Дои:10.1016 / 0034-5687 (78) 90083-X. PMID 27854.
- ^ а б c Нуньес П., Гвидо Д., Деморекс Н. (декабрь 2015 г.). «Измерение pH фагосом с помощью ратиометрической флуоресцентной микроскопии». Журнал визуализированных экспериментов (106): e53402. Дои:10.3791/53402. ЧВК 4692782. PMID 26710109.
- ^ Порселли А.М., Гелли А., Занна С., Пинтон П., Риццуто Р., Руголо М. (январь 2005 г.). «Разница pH на внешней митохондриальной мембране, измеренная с помощью мутанта зеленого флуоресцентного белка». Сообщения о биохимических и биофизических исследованиях. 326 (4): 799–804. Дои:10.1016 / j.bbrc.2004.11.105. PMID 15607740.
- ^ Альбертс Б., Джонсон А., Льюис Дж. И др. (2002). «Митохондрия». Молекулярная биология клетки (4-е изд.). Нью-Йорк: Наука Гарланд.
- ^ а б c d е ж грамм Роос А., Бор WF (апрель 1981 г.). «Внутриклеточный pH». Физиологические обзоры. 61 (2): 296–434. Дои:10.1152 / Physrev.1981.61.2.296. PMID 7012859.
- ^ а б c d е ж грамм час я Луизель Ф. Б., Кейси-младший (2010). «Измерение внутриклеточного pH». Мембранные переносчики в открытии и разработке лекарств. Методы молекулярной биологии. 637. С. 311–31. Дои:10.1007/978-1-60761-700-6_17. ISBN 978-1-60761-699-3. PMID 20419443.
- ^ а б Roberts TM, Rudolf F, Meyer A, Pellaux R, Whitehead E, Panke S, Held M (май 2018 г.). «Исправление: идентификация и характеристика pH-стабильного GFP». Научные отчеты. 8: 46976. Bibcode:2018НатСР … 846976R. Дои:10.1038 / srep46976. ЧВК 5956236. PMID 29769631.
- ^ а б c Книн М., Фаринас Дж., Ли Й., Веркман А.С. (март 1998 г.). «Зеленый флуоресцентный белок как неинвазивный индикатор внутриклеточного pH». Биофизический журнал. 74 (3): 1591–9. Bibcode:1998BpJ …. 74,1591K. Дои:10.1016 / S0006-3495 (98) 77870-1. ЧВК 1299504. PMID 9512054.
- ^ Шпехт Э.А., Бразельманн Э., Палмер Э.А. (февраль 2017 г.). «Критический и сравнительный обзор флуоресцентных инструментов для визуализации живых клеток». Ежегодный обзор физиологии. 79: 93–117. Дои:10.1146 / аннурев-физиол-022516-034055. PMID 27860833.
- ^ Элиав У, Навон Г (февраль 2016 г.). «Натрий ЯМР / МРТ для анизотропных систем». ЯМР в биомедицине. 29 (2): 144–52. Дои:10.1002 / nbm.3331. PMID 26105084.
- ^ Deutsch C, Taylor JS, Wilson DF (декабрь 1982 г.). «Регулирование внутриклеточного pH лимфоцитами периферической крови человека по данным 19F ЯМР». Труды Национальной академии наук Соединенных Штатов Америки. 79 (24): 7944–8. Дои:10.1073 / пнас.79.24.7944. ЧВК 347466. PMID 6961462.
- ^ Риццуто Р., Брини М., Пиццо П., Мурджа М., Поццан Т. (июнь 1995 г.). «Химерный зеленый флуоресцентный белок как инструмент для визуализации субклеточных органелл в живых клетках». Текущая биология. 5 (6): 635–42. Дои:10.1016 / s0960-9822 (95) 00128-х. PMID 7552174. S2CID 13970185.
From Wikipedia, the free encyclopedia
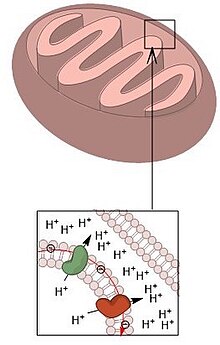
Simplified structure of a mitochondrion
The intermembrane space (IMS) is the space occurring between or involving two or more membranes.[1] In cell biology, it is most commonly described as the region between the inner membrane and the outer membrane of a mitochondrion or a chloroplast. It also refers to the space between the inner and outer nuclear membranes of the nuclear envelope, but is often called the perinuclear space.[2] The IMS of mitochondria plays a crucial role in coordinating a variety of cellular activities, such as regulation of respiration and metabolic functions. Unlike the IMS of the mitochondria, the IMS of the chloroplast does not seem to have any obvious function.
Intermembrane space of mitochondria[edit]
Mitochondria are surrounded by two membranes; the inner and outer mitochondrial membranes. These two membranes allow the formation of two aqueous compartments, which are the intermembrane space (IMS) and the matrix.[3] Channel proteins called porins in the outer membrane allow free diffusion of ions and small proteins about 5000 daltons or less into the IMS. This makes the IMS chemically equivalent to the cytosol regarding the small molecules it contains. By contrast, specific transport proteins are required to transport ions and other small molecules across the inner mitochondrial membrane into the matrix due to its impermeability.[4] The IMS also contains many enzymes that use the ATP moving out of the matrix to phosphorylate other nucleotides and proteins that initiate apoptosis.[5]
Translocation[edit]
Most of proteins destined for the mitochondrial matrix are synthesized as precursors in the cytosol and are imported into the mitochondria by the translocase of the outer membrane (TOM) and the translocase of the inner membrane (TIM).[4][6] The IMS is involved in the mitochondrial protein translocation. The precursor proteins called small TIM chaperones which are hexameric complexes are located in the IMS and they bind hydrophobic precursor proteins and delivery the precursors to the TIM.[7]
Electron transport chain and intermembrane space of a mitochondrion
Oxidative phosphorylation[edit]
The pyruvate generated by glycolysis and the fatty acids produced by breakdown of fats enter the mitochondrial IMS through the porins in the outer mitochondrial membrane.[8] Then they are transported across the inner mitochondrial membrane into the matrix and converted into the acetyl CoA to enter the citric acid cycle.[8][9]
Apoptotic components released from the intermembrane space of a mitochondrion
The respiratory chain in the inner mitochondrial membrane carries out oxidative phosphorylation. Three enzyme complexes are responsible for the electron transport: NADH-ubiquinone oxidoreductase complex (complex I), ubiquinone-cytochrome c oxidoreductase complex (complex III), and cytochrome c oxidase (complex IV).[10] The protons are pumped from the mitochondrial matrix to the IMS by these respiratory complexes. As a result, an electrochemical gradient is generated, which is combined by forces due to a H+ gradient (pH gradient) and a voltage gradient (membrane potential). The pH in the IMS is about 0.7 unit lower than the one in the matrix and the membrane potential of the IMS side becomes more positively charged than the matrix side. This electrochemical gradient from the IMS to the matrix is used to drive the synthesis of ATP in the mitochondria.[5]
Apoptosis[edit]
Releasing of cytochrome c from the IMS to the cytosol activates procaspases and triggers a caspase cascade leading to apoptosis.[4]
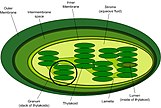
Intermembrane space of chloroplasts[edit]
Simplified structure of a chloroplast
The intermembrane space (IMS) of the chloroplast is exceedingly small, from 10 to 20 nm thick. Unlike the IMS of the mitochondria, the IMS of the chloroplast does not seem to have any obvious function. The translocase of the outer membrane (TOC) and the translocase of the inner membrane (TIC) mainly assist the translocation of chloroplast precursor proteins[11] Chaperone involvement in the IMS has been proposed but still remains uncertain. The eukaryotic Hsp70, which is the heat shock protein of 70 kDa, typically localized in the cytoplasm is also found in the IMS of chloroplasts. The resulting hypothesis states that co-localization of Hsp70 is important for efficient translocation of protein precursors into and across the IMS of chloroplasts.[12]
Intermembrane space of nuclear envelopes[edit]
Simplified structure of a eukaryotic cell nucleus
The nuclear envelope is composed of two lipid bilayer membranes that are penetrated by nuclear pores and separated by a small intermembrane space, which is often called the perinuclear space.[13] The perinuclear space is usually about 20-40 nm wide.[14] The perinuclear translocation of certain proteins and enzymes were studied and results showed that perinuclear space was important for genome integrity and gene regulation.[15]
References[edit]
- ^ «Definition of INTERMEMBRANE». www.merriam-webster.com. Retrieved 2019-04-09.
- ^ en:Nuclear_envelope, oldid 889274242[circular reference]
- ^ Cooper GM (2000). «Mitochondria». The Cell: A Molecular Approach (2nd ed.).
- ^ a b c Essential Cell Biology. Alberts, Bruce., Bray, Dennis., Hopkin, Karen., Johnson, Alexander D., Lewis, Julian. Garland Pub. 2014. ISBN 9780815345251. OCLC 881664767.
{{cite book}}: CS1 maint: others (link) - ^ a b Manganas P, MacPherson L, Tokatlidis K (January 2017). «Oxidative protein biogenesis and redox regulation in the mitochondrial intermembrane space». Cell and Tissue Research. 367 (1): 43–57. doi:10.1007/s00441-016-2488-5. PMC 5203823. PMID 27632163.
- ^ Pfanner N, Meijer M (February 1997). «The Tom and Tim machine». Current Biology. 7 (2): R100-3. doi:10.1016/S0960-9822(06)00048-0. PMID 9081657.
- ^ Wiedemann N, Pfanner N (June 2017). «Mitochondrial Machineries for Protein Import and Assembly». Annual Review of Biochemistry. 86 (1): 685–714. doi:10.1146/annurev-biochem-060815-014352. PMID 28301740.
- ^ a b Chaudhry R, Varacallo M (2019). «Biochemistry, Glycolysis». StatPearls. StatPearls Publishing. PMID 29493928. Retrieved 2019-04-09.
- ^ «Structural Biochemistry/Krebs Cycle (Citric Acid cycle) — Wikibooks, open books for an open world». en.wikibooks.org. Retrieved 2019-04-09.
- ^ Sousa JS, D’Imprima E, Vonck J (2018). «Mitochondrial Respiratory Chain Complexes». Membrane Protein Complexes: Structure and Function. Subcellular Biochemistry. Vol. 87. pp. 167–227. doi:10.1007/978-981-10-7757-9_7. ISBN 978-981-10-7756-2. PMID 29464561.
- ^ Jarvis P, Soll J (December 2001). «Toc, Tic, and chloroplast protein import». Biochimica et Biophysica Acta (BBA) — Molecular Cell Research. 1541 (1–2): 64–79. doi:10.1016/S0167-4889(01)00147-1. PMID 11750663.
- ^ Bionda T, Gross LE, Becker T, Papasotiriou DG, Leisegang MS, Karas M, Schleiff E (March 2016). «Eukaryotic Hsp70 chaperones in the intermembrane space of chloroplasts». Planta. 243 (3): 733–47. doi:10.1007/s00425-015-2440-z. PMID 26669598. S2CID 18533966.
- ^ Walter, Peter; Roberts, Keith; Raff, Martin; Lewis, Julian; Johnson, Alexander; Alberts, Bruce (2002). «The Transport of Molecules between the Nucleus and the Cytosol». Molecular Biology of the Cell. 4th Edition.
- ^ «Perinuclear space — Biology-Online Dictionary | Biology-Online Dictionary». www.biology-online.org. Retrieved 2019-04-02.
- ^ Shaiken TE, Opekun AR (May 2014). «Dissecting the cell to nucleus, perinucleus and cytosol». Scientific Reports. 4: 4923. Bibcode:2014NatSR…4E4923S. doi:10.1038/srep04923. PMC 4017230. PMID 24815916.
From Wikipedia, the free encyclopedia
Simplified structure of a mitochondrion
The intermembrane space (IMS) is the space occurring between or involving two or more membranes.[1] In cell biology, it is most commonly described as the region between the inner membrane and the outer membrane of a mitochondrion or a chloroplast. It also refers to the space between the inner and outer nuclear membranes of the nuclear envelope, but is often called the perinuclear space.[2] The IMS of mitochondria plays a crucial role in coordinating a variety of cellular activities, such as regulation of respiration and metabolic functions. Unlike the IMS of the mitochondria, the IMS of the chloroplast does not seem to have any obvious function.
Intermembrane space of mitochondria[edit]
Mitochondria are surrounded by two membranes; the inner and outer mitochondrial membranes. These two membranes allow the formation of two aqueous compartments, which are the intermembrane space (IMS) and the matrix.[3] Channel proteins called porins in the outer membrane allow free diffusion of ions and small proteins about 5000 daltons or less into the IMS. This makes the IMS chemically equivalent to the cytosol regarding the small molecules it contains. By contrast, specific transport proteins are required to transport ions and other small molecules across the inner mitochondrial membrane into the matrix due to its impermeability.[4] The IMS also contains many enzymes that use the ATP moving out of the matrix to phosphorylate other nucleotides and proteins that initiate apoptosis.[5]
Translocation[edit]
Most of proteins destined for the mitochondrial matrix are synthesized as precursors in the cytosol and are imported into the mitochondria by the translocase of the outer membrane (TOM) and the translocase of the inner membrane (TIM).[4][6] The IMS is involved in the mitochondrial protein translocation. The precursor proteins called small TIM chaperones which are hexameric complexes are located in the IMS and they bind hydrophobic precursor proteins and delivery the precursors to the TIM.[7]
Electron transport chain and intermembrane space of a mitochondrion
Oxidative phosphorylation[edit]
The pyruvate generated by glycolysis and the fatty acids produced by breakdown of fats enter the mitochondrial IMS through the porins in the outer mitochondrial membrane.[8] Then they are transported across the inner mitochondrial membrane into the matrix and converted into the acetyl CoA to enter the citric acid cycle.[8][9]
Apoptotic components released from the intermembrane space of a mitochondrion
The respiratory chain in the inner mitochondrial membrane carries out oxidative phosphorylation. Three enzyme complexes are responsible for the electron transport: NADH-ubiquinone oxidoreductase complex (complex I), ubiquinone-cytochrome c oxidoreductase complex (complex III), and cytochrome c oxidase (complex IV).[10] The protons are pumped from the mitochondrial matrix to the IMS by these respiratory complexes. As a result, an electrochemical gradient is generated, which is combined by forces due to a H+ gradient (pH gradient) and a voltage gradient (membrane potential). The pH in the IMS is about 0.7 unit lower than the one in the matrix and the membrane potential of the IMS side becomes more positively charged than the matrix side. This electrochemical gradient from the IMS to the matrix is used to drive the synthesis of ATP in the mitochondria.[5]
Apoptosis[edit]
Releasing of cytochrome c from the IMS to the cytosol activates procaspases and triggers a caspase cascade leading to apoptosis.[4]
Intermembrane space of chloroplasts[edit]
Simplified structure of a chloroplast
The intermembrane space (IMS) of the chloroplast is exceedingly small, from 10 to 20 nm thick. Unlike the IMS of the mitochondria, the IMS of the chloroplast does not seem to have any obvious function. The translocase of the outer membrane (TOC) and the translocase of the inner membrane (TIC) mainly assist the translocation of chloroplast precursor proteins[11] Chaperone involvement in the IMS has been proposed but still remains uncertain. The eukaryotic Hsp70, which is the heat shock protein of 70 kDa, typically localized in the cytoplasm is also found in the IMS of chloroplasts. The resulting hypothesis states that co-localization of Hsp70 is important for efficient translocation of protein precursors into and across the IMS of chloroplasts.[12]
Intermembrane space of nuclear envelopes[edit]
Simplified structure of a eukaryotic cell nucleus
The nuclear envelope is composed of two lipid bilayer membranes that are penetrated by nuclear pores and separated by a small intermembrane space, which is often called the perinuclear space.[13] The perinuclear space is usually about 20-40 nm wide.[14] The perinuclear translocation of certain proteins and enzymes were studied and results showed that perinuclear space was important for genome integrity and gene regulation.[15]
References[edit]
- ^ «Definition of INTERMEMBRANE». www.merriam-webster.com. Retrieved 2019-04-09.
- ^ en:Nuclear_envelope, oldid 889274242[circular reference]
- ^ Cooper GM (2000). «Mitochondria». The Cell: A Molecular Approach (2nd ed.).
- ^ a b c Essential Cell Biology. Alberts, Bruce., Bray, Dennis., Hopkin, Karen., Johnson, Alexander D., Lewis, Julian. Garland Pub. 2014. ISBN 9780815345251. OCLC 881664767.
{{cite book}}: CS1 maint: others (link) - ^ a b Manganas P, MacPherson L, Tokatlidis K (January 2017). «Oxidative protein biogenesis and redox regulation in the mitochondrial intermembrane space». Cell and Tissue Research. 367 (1): 43–57. doi:10.1007/s00441-016-2488-5. PMC 5203823. PMID 27632163.
- ^ Pfanner N, Meijer M (February 1997). «The Tom and Tim machine». Current Biology. 7 (2): R100-3. doi:10.1016/S0960-9822(06)00048-0. PMID 9081657.
- ^ Wiedemann N, Pfanner N (June 2017). «Mitochondrial Machineries for Protein Import and Assembly». Annual Review of Biochemistry. 86 (1): 685–714. doi:10.1146/annurev-biochem-060815-014352. PMID 28301740.
- ^ a b Chaudhry R, Varacallo M (2019). «Biochemistry, Glycolysis». StatPearls. StatPearls Publishing. PMID 29493928. Retrieved 2019-04-09.
- ^ «Structural Biochemistry/Krebs Cycle (Citric Acid cycle) — Wikibooks, open books for an open world». en.wikibooks.org. Retrieved 2019-04-09.
- ^ Sousa JS, D’Imprima E, Vonck J (2018). «Mitochondrial Respiratory Chain Complexes». Membrane Protein Complexes: Structure and Function. Subcellular Biochemistry. Vol. 87. pp. 167–227. doi:10.1007/978-981-10-7757-9_7. ISBN 978-981-10-7756-2. PMID 29464561.
- ^ Jarvis P, Soll J (December 2001). «Toc, Tic, and chloroplast protein import». Biochimica et Biophysica Acta (BBA) — Molecular Cell Research. 1541 (1–2): 64–79. doi:10.1016/S0167-4889(01)00147-1. PMID 11750663.
- ^ Bionda T, Gross LE, Becker T, Papasotiriou DG, Leisegang MS, Karas M, Schleiff E (March 2016). «Eukaryotic Hsp70 chaperones in the intermembrane space of chloroplasts». Planta. 243 (3): 733–47. doi:10.1007/s00425-015-2440-z. PMID 26669598. S2CID 18533966.
- ^ Walter, Peter; Roberts, Keith; Raff, Martin; Lewis, Julian; Johnson, Alexander; Alberts, Bruce (2002). «The Transport of Molecules between the Nucleus and the Cytosol». Molecular Biology of the Cell. 4th Edition.
- ^ «Perinuclear space — Biology-Online Dictionary | Biology-Online Dictionary». www.biology-online.org. Retrieved 2019-04-02.
- ^ Shaiken TE, Opekun AR (May 2014). «Dissecting the cell to nucleus, perinucleus and cytosol». Scientific Reports. 4: 4923. Bibcode:2014NatSR…4E4923S. doi:10.1038/srep04923. PMC 4017230. PMID 24815916.