Ритм ЭЭГ (англ. rhythm) – регулярный (имеющий постоянную частоту) тип электрической активности, соответствующий некоторому определенному состоянию мозга и связанный с определенными церебральными механизмами. При описании ритма указывается его частота, типичная для определенного состояния и области мозга, амплитуда и некоторые характерные черты его изменений во времени при изменениях функциональной активности мозга. Основные ритмы ЭЭГ связаны с различными состояниями человека.
Краткое описание
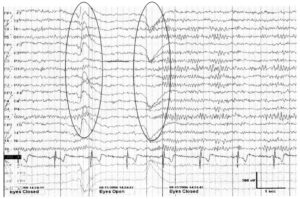
Альфа-ритм — регулярный, синусоидальной формы, с частотой 8-13 Гц (колебаний в 1 с) и амплитудой 20-80 мкВ (микровольт). Альфа-ритм регистрируется при отведении биопотенциалов от всех зон коры большого мозга, но более постоянно — от затылочной и теменной областей. Альфа-ритм регистрируется у человека в условиях физического и умственного покоя, обязательно при закрытых глазах и отсутствии внешних раздражений.
Бета-ритм имеет частоту колебаний 14-35 Гц. Амплитуда 10-30 мкВ. Может быть зарегистрирован в любых областях мозга, но более выражен в лобных долях. При открывании глаз, умственной работе и других раздражителях альфа-ритм быстро сменяется бета-ритмом. Это явление смены редкого ритма на более частый получило название реакции активации (или десинхронизации).
Тета-ритм имеет частоту 4-7 Гц и амплитуду 100-150 мкВ. Наблюдается в состоянии неглубокого сна, при кислородном голодании мозга, наркозе.
Дельта-ритм характеризуется медленными колебаниями с частотой 0,5-3 Гц, высокой амплитудой 250-300 мкВ, вплоть до 1000 мкВ. Обнаруживается во всех зонах мозга, во время глубокого сна, а также при наркозе. У детей до 7 лет дельта-ритм может быть зарегистрирован и в бодрствующем состоянии.
Близкий по частоте альфа-эквивалент, регистрируемый над центральными и центрально-теменными отделами, носит название сенсомоторный или роландический ритм, поскольку максимальную выраженность он имеет в проекции роландовой борозды. Считается, что роландический ритм был впервые подробно описан Гасто в 1958 г. Этот ритм имеет характерную форму волн: аркообразные волны с закругленными вершинами и «острыми» основаниями, напоминающими греческую букву μ(мю). Поэтому существует еще одно название сенсомоторного ритма — мю-ритм. Мю-ритм, так же как и альфа-ритм, подвержен депрессии при реакции активации. Но в отличие от альфа-ритма, мю-ритм угнетается при двигательной активности: произвольной (сжимание пальцев в кулак), рефлекторной и даже при намерении движения.
В состоянии бодрствования над средневисочными отделами могут быть зарегистрированы немодулированные каппа-волны частотой 8—12 Гц и тау-ритм частотой 10—12 Гц. Считается, что регистрации на ЭЭГ этих ритмов препятствуют кости черепа, и чаще альфа-эквиваленты могут быть зарегистрированы при наличии дефектов подлежащих костных структур. Тау-ритм избирательно чувствителен к слуховым стимулам, счету в уме и другим видам умственной деятельности.
Существует еще один феномен: лямбда-волны — заостренные однофазные колебания обычно в альфа- или, реже, в тета-диапазонах частот амплитудой до 30—50 мкВ, регистрируемые в затылочных отведениях во время работы (!) зрительного анализатора (например, при демонстрации визуальных изображений). Считается, что лямбда-волны связаны с саккадическими движениями глаз при рассматривании сложных изображений.
Сравнение ритмов ЭЭГ
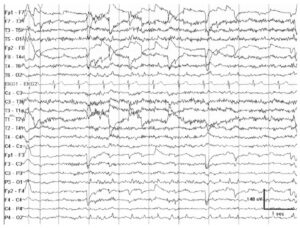
ЭЭГ норма альфа-ритма
➥ Основная статья: Альфа-ритмы
«блокируется» при открывании глаз и восстанавливается при закрывании глаз. Обращает на себя внимание увеличение частоты ритма непосредственно после закрывания глаз (squeak-феномен)
Альфа-ритм остается первым шагом при анализе ЭЭГ. В норме на ЭЭГ выявляется ритм, преобладающий в задних отведениях, имеющий билатеральное распространение, с частотой в пределах 8—13 Гц (α-частота). Если этот ритм ослабевает при открывании глаз, он обозначается как α-ритм. В процессе нормального развития ребенка α-ритм с частотой 8 Гц формируется к 3 годам жизни. Частота α-ритма остается стабильной от 8 до 12 Гц даже во время нормального процесса взросления и старения, вплоть до пожилого возраста. Приблизительно у 10% здоровых взрослых альфа-ритм плохо визуализируется, и менее чем у 10% его амплитуда может составлять <15 мкВ. Альфа-ритм максимально выражен в затылочных областях и смещается в переднем направлении в состоянии дремоты. Амплитудная асимметрия >50% должна рассматриваться как патология, особенно если амплитуда слева выше, чем справа. Альфа-ритм наиболее выражен в состоянии расслабленного бодрствования, и различия по частоте с двух сторон не превышают 1 Гц. Одностороннее отсутствие a-ритма указывает на патологию на ипсилатеральной стороне (феномен Банко). В норме частота α-ритма может транзиторно возрастать сразу после закрывания глаз (squeak-феномен). Существуют два варианта α-ритма: с уменьшением частоты на половину (медленный альфа-вариант) или с ее увеличением в два раза (быстрый α-вариант), с сохранением характерного распределения и реактивности. По характеристикам волн α-ритм может иметь пилообразную форму. Парадоксальный α-ритм появляется в состоянии активации, а не в состоянии расслабленного бодрствования.
ЭЭГ норма мю-ритма
➥ Основная статья: Мю-ритмы
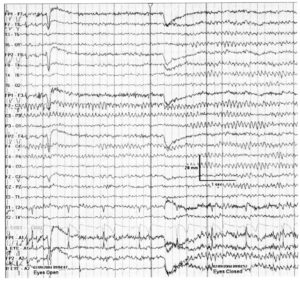
в левых центральных отведениях при открывании глаз
Мю-ритм локализуется в центральных отведениях, что соответствует сенсомоторной коре, в состоянии покоя, имеет аркообразную форму и частоту, свойственную альфа-ритму (обычно 8-10 Гц) (рис. 2). Хотя он напоминает α-ритм, но не блокируется при открывании глаз, напротив, этот ритм блокируется при движениях в контралатеральной конечности. Может выявляться только на одной стороне, может быть асимметричным и асинхронным, несмотря на отсутствие в его основе структурного поражения. Мю-ритм может замедляться с возрастом и обычно имеет более низкую амплитуду, чем α-ритм. Стойко сохраняющийся, ареактивный и ассоциированный с фокальным замедлением мю-подобный ритм считается патологическим.
Нормальная ЭЭГ бета-ритма
➥ Основная статья: Бета-ритмы
в правой височной области (с максимумом в Т4) после краниотомии и височной лобэктомии
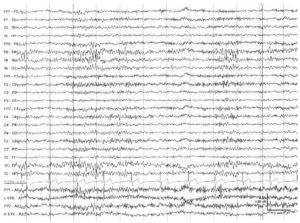
Бета-ритм превышает по частоте 13 Гц. Это распространенный ритм, в норме его частота варьирует в пределах 18—25 Гц, а амплитуда не превышает 20 мкВ. Амплитуда свыше 25 мкВ считается патологической. Препараты бензодиазепинового ряда, барбитураты и хлорал гидрат провоцируют появление выраженной генерализованной β-активности (быстрой активности — «fast activity») амплитудой >50 мкВ, которая занимает >50% записи бодрствования и находится в диапазоне частот 14—16 Гц. Бета-активность в норме усиливается в состоянии дремоты, в поверхностном сне и при умственной деятельности. Стойкое уменьшение амплитуды >50% позволяет предполагать патологические изменения в сером веществе коры большого мозга того полушария, в котором амплитуда β-ритма ниже; однако менее выраженная асимметрия может служить простым отражением нормальной асимметрии черепа. Дефекты черепа могут приводить к появлению бреш-ритма (breach-ритма) очаговой локализации, асимметричного, высокоамплитудного (амплитуда может повышаться более чем в три раза); β-активность в области дефектов черепа может достигать более высоких частот. Это считается нормальным явлением при отсутствии ассоциации со спайками (эпилептиформной активностью) или фокальным замедлением.
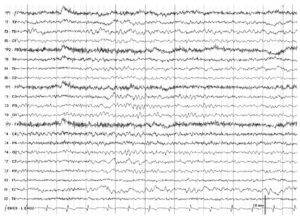
Тета-ритм на ЭЭГ
➥ Основная статья: Тета-ритмы
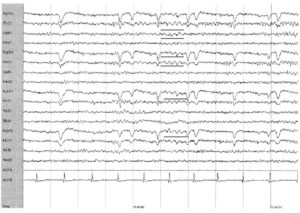
в лобно-центральных отведениях у 18-летнего пациента в состоянии бодрствования
Тета-ритм характеризуется частотой от 4 до 7 Гц и варьирует по амплитуде и морфологии. Приблизительно в одной трети случаев у здоровых молодых взрослых в состоянии бодрствования выявляется интермиттирующий тета-ритм, частотой 6—7 Гц, амплитудой < 15 мкВ, максимально выраженный в лобных или лобно-центральных областях. Тета-активность в лобных областях может усиливаться при эмоциях, концентрации внимания, при решении интеллектуальных задач. Тета-активность в норме усиливается при гипервентиляция, в состоянии дремоты и во сне. Интермиттирующая активность частотой 4—5 Гц, битемпоральная, или даже с односторонним преобладанием (обычно слева > справа), может возникать примерно в одной трети случаев у пожилых людей при отсутствии клинических проявлений и не считается патологической.
Лямбда-ритм
с биокципитальным расположением у 28-летнего пациента с жалобами на головокружение. Обращает на себя внимание частое появление артефакта, связанного со следящими движениями глаз в отведениях F7 и Т8
Лямбда-волны первоначально были описаны как поверхностно положительно направленные заостренные θ-волны, появляющиеся в затылочной области с двух сторон. Эти потенциалы имеют продолжительность от 160 до 250 мс, и временами могут быть заостренными, асимметричными, иметь более высокую амплитуду, чем преобладающий ритм покоя в задних отведениях. При асимметричном появлении λ-волн их можно спутать с интериктальными эпилептиформными разрядами, что может привести к ошибочной интерпретации ЭЭГ. Лучше всего λ-волны выражены у молодых взрослых (в тех случаях, когда они выявляются), хотя чаще они обнаруживаются у детей. Лямбда-волны лучше выражены в то время, когда пациент рассматривает текстурированное или сложное изображение с появлением у него быстрых саккадированных движений глаз. Если в данном случае поместить белый лист бумаги перед глазами исследуемого, это приводит к прекращению потока зрительной информации, необходимой для формирования λ-волн.
Вариант ЭЭГ нормы дельта-ритма
➥ Основная статья: Дельта-ритмы
слева в средних височных отведениях во время перехода в состояние дремоты у здорового 84-летнего пациента, проходящего обследование по поводу обморока
Дельта-ритм представляет собой активность частотой менее 4 Гц, которая занимает < 10% записи ЭЭГ в состоянии бодрствования в норме у людей, достигших 10 лет. В состоянии бодрствования δ-активность может считаться нормой в очень раннем и в пожилом возрасте. В норме у пожилых людей могут выявляться редкие нерегулярные δ-комплексы в височных отведениях. Эта активность сходна по распределению с височным θ-ритмом, часто более выражена в левых, чем в правых височных областях, но в Норме не превышает 1% записи. В некоторых случаях δ-активность считается нормальной — у людей старше 60 лет, при появлении состояния дремоты, в ответ на гипервентиляцию, а также во время медленноволнового сна. Чрезмерно выраженная генерализованная δ-активность является патологической и указывает на энцефалопатию неспецифической этиологии. Фокальная аритмичная δ-активность обычно указывает на структурное поражение, вовлекающее белое вещество ипсилатерального полушария, особенно если эта активность продолженная и ареактивная.
Природа ритмов и связь с мозговыми функциями
Новые открытия в области электроэнцефалографии (ЭЭГ), сделанные в течение нескольких прошлых десятилетий, существенно изменили классические представления, на которых базировалось обучение психиатров и неврологов в медицинских школах. Согласно классическим представлениям, обработка информации в человеческом мозгу реализуется за счет импульсной (спайковой) активности отдельных нейронов. Осцилляторная электрическая активность (например, ритмы ЭЭГ) в худшем случае отвергалась и игнорировалась, в лучшем — считалась фоновой активностью. В качестве примера может быть приведена книга Principles of neuroscience под редакцией Е. Kandel, J. Schwartz и Т. Jessel, которая считается «библией» ученых, занимающихся исследованием деятельности мозга. В четвертом издании глава про электрические колебания ЭЭГ отсутствовала, а глава Джона Мартина (John Martin) «Коллективная электрическая активность нейронов: электроэнцефалограмма и механизмы эпилепсии», представленная в третьем издании, была отвергнута.
В течение последних нескольких лет ситуация медленно изменяется. Теперь мы сталкиваемся с ренессансом ЭЭГ, что связано с появлением новых методов оценки человеческой ЭЭГ и новых экспериментальных результатов в исследованиях на животных, которые позволили электрофизиологам обнаружить, что изменения в колебательных паттернах ЭЭГ играют определяющую роль в поддержании мозговых функций и, следовательно, могут использоваться как мощный инструмент для диагноза мозговых дисфункций.
С общей точки зрения, колебания присутствуют во всех физических и биологических системах, стремящихся достигнуть равновесия. Почти во всех случаях колебания появляются, когда система управляется двумя противоположными процессами: выводящим систему из равновесия и возвращающим ее обратно к равновесию. В этом отношении колебания ЭЭГ не отличаются от колебаний в других биологических системах. В случае любого наблюдаемого ритма ЭЭГ (такого как альфа, бета или тета) мы всегда можем обнаружить фактор, который выводит нейрон или нейронную сеть из состояния равновесия, и причину, которая возвращает их назад.
Однако колебания могут быть не только отражением действия двух противоположных сил в нейронных сетях, но гипотетически также могут служить источником объединяющего начала в организации нейронных сетей. Например, изменения суммарного локального электрического потенциала, созданного нейронами — генераторами данного ритма, могут вовлечь в этот процесс другие нейроны, которые непосредственно не участвуют в генерации ритма. Это вовлечение синхронизирует активность всех нейронов нейронной сети с генераторами ритма. Несмотря на попытки доказать это предположение, мы все еще не знаем, правильно оно или нет.
Типы биоэлектрической активности мозга
➥ Основная статья: Биоэлектрическая активность головного мозга
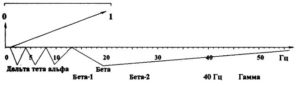
Ритмы ЭЭГ в диапазоне частот от 0 до 70 Гц охватывают несколько категорий электрических явлений, регистрирующихся от скальпа. Эти биоэлектрические явления традиционно разделены на следующие типы: сдвиги DC-потенциалов, декасекундные колебания и медленные волны, дельта-, тета-, альфа– и бета-ритмы ЭЭГ. Здесь необходимо подчеркнуть, что понятие ритма предполагает, что ритм представляет собой регулярные изменения электрического потенциала, измеренного электродами от скальпа. Если к записи ЭЭГ, содержащей ритмы, применяется преобразование Фурье или волновое (wavelet) преобразование, то эти ритмы выявляются в соответствующих спектрах в форме пиков.
Для регистрации декасекундных колебаний необходимы специальные усилители. Декасекундные колебания, как правило, не рассматриваются в обычной ЭЭГ. Дельта-ритмы охватывают диапазон частот от 1 до 4 Гц, тета-ритмы — 4—8 Гц, альфа-ритмы — 8—13 Гц и бета-ритмы имеют частоту выше 13 Гц. Тета-, альфа- и бета-ритмы присутствуют в нормальной ЭЭГ, регистрируются в состоянии покоя (с закрытыми или открытыми глазами) и в условиях решения различных задач. Дельта-ритмы в нормальном мозге выражены на спектрограммах в форме пиков только во время состояния глубокого сна. Хотя основные ритмы ЭЭГ известны со времени Бергера (конец 1920-х), их нейрофизиологические основы начинают выясняться только недавно, начиная приблизительно с 1980-х годов.
Надо подчеркнуть, что ЭЭГ — это чувствительный маркер состояния человека: ритмы ЭЭГ существенно изменяются, когда человек засыпает и переходит от одной стадии сна к другой. Например, во II стадии сна появляется определенные колебания, названные сонными веретенами. Веретена сна исчезают в то время, как в дальнейших стадиях сна развиваются тета- и дельта-ритмы. Во время бодрствования ритмы могут определять меру реакции мозга на различные психологические задачи. Например, затылочные альфа-ритмы подавляются (реакция десинхронизации) в то время, как лобные бета-ритмы увеличиваются (реакция синхронизации) в ответ на поведенчески значащие зрительные стимулы.
Границы частот строго не определены. Однако полноценность частотной классификации доказывается всей историей ЭЭГ.
В поврежденном мозге нормальные механизмы генерации ритмов ЭЭГ могут нарушаться, и ритмы могут: 1) становиться медленнее по частоте (замедление ЭЭГ); 2) иметь необычную локализацию (например, альфа-ритмы в височных областях); 3) стать выше по амплитуде (гиперсинхронизация) и в большей синхронности с другими областями (гиперкогерентность). В некоторых серьезных случаях (характеризующихся, например, разобщением корковых областей и подкорковых структур, в результате травмы или опухоли) может появиться медленный ритм с частотой дельта-диапазона (1—3 Гц). Также нормальные механизмы синхронизации могут быть усилены, тогда на ЭЭГ появляются спайки или паттерны «спайк/медленная волна», указывающие на очаг эпилептиформной активности в человеческом мозгу, который иногда может привести к эпилептическому приступу. Нормативные базы данных могут помочь электроэнцефалографисту выявить перечисленные аномальные паттерны и оценить уровень статистической значимости отклонения от нормы для каждого исследуемого человека. Пространственная локализация генераторов ритмов ЭЭГ может быть оценена различными методами, такими как дипольная аппроксимация или электромагнитная томография низкого разрешения (LORETA).
Пароксизмальная активность
➥ Основная статья: Пароксизм
В нормальном мозгу процессы коркового возбуждения и торможения хорошо сбалансированы. Кора со сбалансированными процессами торможения и возбуждения в состоянии спокойного бодрствования генерирует нормальные регулярные электрические колебания: альфа-ритмы, бета-ритмы и среднелобный тета-ритм. Если указанный баланс нарушен так, что возбуждение превышает торможение, кора начинает производить аномальные паттерны электрической активности, которые называются пароксизмами. В большинстве случаев они могут быть зарегистрированы с помощью обычной скальповой ЭЭГ в форме определенных электрографических паттернов. Есть несколько типов эпилептиформной активности, наиболее распространенные из которых — спайки, острые волны, комплексы «спайк — медленная волна». Спайки обычно генерируются локальной корковой областью, называемой фокусом. С использованием таких современных методов, как электромагнитная томография, LORETA или анализ диполей, эпилептогенные фокусы могут быть локализованы в коре с хорошей точностью. С 1950-х годов долгие годы обнаружение спайков визуальным просмотром ЭЭГ оставалось единственным методом. За прошлые 10—20 лет были разработаны весьма надежные методы для автоматического обнаружения спайков. В настоящее время большинство современных QEEG-систем имеет дополнительные инструменты для автоматического обнаружения спайков, которые помогают практикам обнаружить и проанализировать пароксизмальную активность в мозгу.
Отражение функционирования мозговых систем
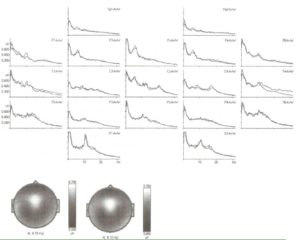
Спектры мощности и топограммы ЭЭГ, зарегистрированных у одного субъекта в течение 3 минут, с интервалом между регистрациями 7 дней.
ЭЭГ — сложная комбинация ритмов. Например, спектры ЭЭГ пациента, представленные на рис. 8, включают лобный тета-ритм, затылочный альфа-ритм, задневисочную низкочастотную бета-активность и центральную высокочастотную бета-активность. При сравнении с нормативной базой данных лобная тета-активность и задневисочная низкочастотная бета-активность оказались вне диапазона нормы.
Различные ритмы ЭЭГ отражают различные механизмы. Альфа-ритмы отражают состояние таламокорковых путей. Среднелобный тета-ритм отражает функционирование лимбической системы. Бета-ритмы более локальны и отражают состояние локальных корковых областей. Определение аномальной ритмической активности ЭЭГ и связь этих отклонений с различными мозговыми системами соответствует второму критерию эндофенотипов как биологических маркеров болезни.
Термин «биологические часы» используют в разных контекстах. Но всегда имеется в виду, что на выполнение определенной функции организма отведено ограниченное время. Касается это и цикла «сон — бодрствование». Человек не просто так ложится спать вечером, а просыпается утром. За это отвечают циркадные ритмы. Из этого материала вы узнаете, что это такое, можно ли взять под контроль данный механизм.
Циркадный ритм — что это?
В 2017 году американские физиологи получили Нобелевскую премию за вклад в изучение механизмов, называемых циркадными ритмами. Это биологические ритмы, связанные со сменой дня и ночи.
Ученые установили, что существует ген, который контролирует суточные изменения в организме:
• сон и бодрствование;
• выработку гормонов;
• скорость обменных процессов;
• реакции на стресс.
Этим геном кодируется белок, накапливаемый в клетках в темное время суток. Когда всходит солнце, вещество начинает расходоваться. Человек просыпается, и внутренние процессы в его теле ускоряются.
Проще говоря, циркадный ритм — это механизм, работа которого основана на биологических часах организма. Он отражает циклические колебания, происходящие в течение суток.
Как работает?
Существует внешний цикл, составляющий 24 часа: он обусловлен вращением Земли вокруг Солнца. Биоритм каждого живого существа подстраивается под него. У человека он приближен к 24 часам (±15 минут).
Идеальный суточный режим организм выстраивает самостоятельно, подстраиваясь под смену дня и ночи:
• в 6:30 происходит резкий скачок кровяного давления;
• в 7:30 прекращается выработка мелатонина (гормона сна);
• в 8:30 активизируется перистальтика кишечника;
• в 9:00 достигает максимума концентрация тестостерона;
• в 10:00 повышается бдительность;
• в 14:30 достигается лучшая координация движений;
• в 15:30 у человека наблюдаются самые быстрые реакции;
• в 17:00 лучше всего работает сердечно-сосудистая система;
• в 18:30 отмечается самое высокое давление;
• в 19:00 достигает максимума температура тела;
• в 21:00 начинает вырабатываться мелатонин;
• в 22:30 подавляется перистальтика кишечника.
Таким образом, тело само диктует, когда нам нужно просыпаться и ложиться спать, ходить в туалет, заниматься физическими упражнениями, приступать к интеллектуальной работе. Учет этого распорядка влияет на состояние здоровья.
Влияние циркадных ритмов на здоровье
Изучение циркадного ритма человека позволило понять важность своевременного пробуждения и отхождения ко сну. Он объясняет, почему не стоит ставить будильник ранее, чем на 7:30, ведь телу нужно время на подготовку к выходу из состояния сна. Суточный биоритм обуславливает и вред ночного образа жизни, посменной работы, при которых эндокринная и нервная системы буквально путаются в расписании.
Соблюдение цикла, установленного внутренними часами, позволяет:
• нормализовать метаболические процессы;
• предотвратить расстройства пищеварения;
• взять под контроль гормоны;
• добиваться максимальной эффективности на работе;
• получать удовольствие от физических нагрузок.
Знание биологических ритмов подсказывает, как вести здоровый образ жизни и не испытывать от этого стресс. Когда организм вовремя получает то, в чем нуждается, он менее подвержен всевозможным заболеваниям.
Нарушение циркадного ритма
Иногда происходит десинхронизация внутренних ритмов человека и внешнего цикла «день — ночь». Исследуют их преимущественно неврологи — в контексте нарушения режима сна и бодрствования.
Рассматриваются несколько их типов:
• Джетлаг. Из-за резкого перемещения между часовыми поясами (на два и более) появляются расстройства вегетативного характера (слабость, головная боль, дезориентация, тошнота).
• Нарушение сна при посменной работе. Из-за сбоя выработки мелатонина возникает бессонница, повышается уровень стресса, возможно развитие депрессии.
• Расстройство фаз сна. Из-за рассинхронизации сон приходит с опозданием, соответственно, откладывается и пробуждение. Некоторые, наоборот, засыпают слишком рано.
Все это влияет на здоровье. Организм вынужден резко подстраивать естественные процессы под сложившийся режим. В итоге его жизнедеятельность протекает не так, как заложено природой.
Последствия для здоровья
Сон должен быть своевременным. Это время диктуется не семьей, расписанием уроков, режимом работы или личными предпочтениями, а биоритмами.
Самое очевидное последствие их игнорирования — сонливость в течение дня, вплоть до развития нарколепсии (кратковременного засыпания на ходу). Это влечет снижение концентрации, что чревато ухудшением работоспособности и созданием аварийных ситуаций.
Если суточный распорядок не соблюдается, человек не может полноценно отдохнуть.
Постоянное пребывание организма в состоянии усталости в отдаленной перспективе чревато:
• сердечно-сосудистыми заболеваниями;
• гормональными сбоями;
• метаболическими нарушениями;
• ослаблением иммунитета;
• психическими расстройствами;
• онкологическими процессами.
Возрастает также риск появления аутоиммунных заболеваний. Работая ночью, когда нужно спать, тело вступает во внутреннее противоборство с самим собой. И оно в любом случае будет искать способы прекратить это.
Как настроить циркадный ритм?
Нормальные суточные биоритмы широко известны. Если обнаружилось, что привычный режим дня вступает с ними в противоречие, «часовой механизм» можно «починить». «Инструментом» станет дневной свет — основа формирования 24-часового цикла.
Главное правило: чем меньше света, тем больше мелатонина. Поэтому утром нужно сразу же распахивать все шторы, а если за окном темно — включать лампы. Ближе к ночи, наоборот, следует минимизировать количество света.
Выяснилось, что за желание спать отвечают фоточувствительные ганглионарные клетки сетчатки. Именно они фиксируют рассвет и закат, чтобы передать сигналы в мозг и запустить или остановить процесс выработки мелатонина. Поэтому наши внутренние биоритмы зависят от лицезрения света.
Как справиться с джетлагом?
Исследования показали, что перемещения на запад переносятся легче, чем на восток. Причина — в том, что в первом случае сон и пробуждение переносятся на более позднее время, а во втором — на более ранее.
Дальние перелеты происходят не так часто, чтобы вызвать существенные патологии. Поэтому задача путешественника — предотвратить появление симптомов, ухудшающих качество жизни.
Для этого рекомендуется:
• начать постепенное смещение цикла сна и бодрствования за несколько дней до поездки, чтобы перемены были не такими резкими;
• получить как можно больше солнечного света в первое утро на новом месте;
• перед сном обеспечить полную темноту (без гаджетов, ночников).
Если отхождение ко сну оказывается слишком затруднительным, возможно применение снотворных кратковременного действия. Подбор препарата лучше доверить врачу.
Как нормализовать сон при сменной работе?
У людей, вынужденных периодически работать по ночам, сбиваются суточные биоритмы. Каждый день у них меняется режим дня, и организм едва успевают перестраиваться с одного цикла на другой.
Для нормализации внутренних процессов неврологи рекомендуют:
• включать свет в период бодрствования;
• обеспечивать полную темноту во время сна;
• надевать солнцезащитные очки за несколько часов до предполагаемого засыпания для постепенного снижения выработки мелатонина;
• использовать беруши и затемняющие маски во время сна.
Особенно важна социальная составляющая настройки биологических часов. Домочадцы должны осознать, что здоровье ночного работника подвергается опасности, и не мешать созданию комфортных для него световых условий.
У кого бывают нарушения фаз сна?
Для ответа на этот вопрос нужно отделить людей с истинными нарушениями фаз сна от обладателей определенных хронотипов.
Их всего три:
• Утренний (жаворонки). Биологические часы сдвинуты примерно на три часа назад.
• Асинхронный. Биологические часы соответствуют нормальному циркадному ритму.
• Вечерний (совы). Биологические часы сдвинуты примерно на три часа вперед.
Совы и жаворонки — это не жертвы неправильных привычек. Просто у первых ген PER3, отвечающий за циркадные ритмы, укорочен, а у вторых — удлинен.
Синдрому смещения фаз подвержены люди с асинхронным хронотипом. Если их режим дня десинхронизируется с обычным циркадным ритмом, начинаются расстройства сна и сопутствующие неприятные симптомы. У жаворонков подобные явления наблюдаются редко, у сов — исключены в принципе.
Как бороться с нарушением фаз сна?
Человек с асинхронным хронотипом может устранить такое расстройство коррекцией режима дня и светотерапией. Конкретные действия зависят от необходимого направления сдвига.
- Проблема — долгое засыпание, решение — ранее пробуждение + светотерапия в дневное время.
- Проблема — ранее пробуждение, решение — светотерапия в вечернее время.
- Проблема — сдвиг фаз сна, решение — пропорциональная задержка сна и пробуждения до нормализации.
Если эти меры не помогают, возможен прием экзогенного мелатонина — синтетического гормона (эндогенный вырабатывается самим организмом). Он позволяет корректировать время наступления биологической ночи — периода замедления физиологических процессов и отхождения ко сну.
Препараты на основе этого действующего вещества (например, Мелаксен, Меларитм) являются снотворными, они регулируют нейроэндокринные функции. Поэтому принимать их можно только под контролем врача.
Что делать жаворонкам и совам?
Особенности циркадных ритмов людей с утренним и вечерним хронотипами обусловлены генетически, а не патологически. Чистых жаворонков и сов в природе не так много — 15 и 20% от общего населения планеты.
Конструктивными решениями для них могут стать:
• смена места жительства (совам комфортнее на западе, жаворонкам — на востоке);
• оптимизация режима сна и отдыха с опорой на часы максимальной производительности (у жаворонков — до 12:00, у сов — после 16:00);
• распределение типов деятельности в соответствии с особенностями хронотипа (при утреннем слуховая чувствительность максимальна с 7 до 13 часов, при вечернем — с 19 до 1 часа).
Лечить таких людей бессмысленно: они не больны. Заставлять их жить в соответствии со стандартным циркадным ритмом опасно. Это равносильно постоянному насильственному выбиванию обычного человека из стандартного биоритма.
В снотворных здесь необходимости нет — они только навредят. От избыточного потребления кофе тоже лучше воздержаться: обладатели нестандартных хронотипов более склонны к зависимости.
Ритмы мозговой деятельности
Деятельность мозга подчиняется определённым так сказать режимам, характерным для различных состояний активности его участков. Каждому типу ритма свойственна определённая частота и амплитуда электромагнитных колебаний. При смене функциональной активности мозга характер колебаний изменяется.
Ритмы мозга в состоянии бодрствования
Деятельность мозга, фиксируемая у взрослого человека, находящегося в активном состоянии, характеризуется несколькими типами ритмов, для которых свойственны определённые типичные показатели.
- Альфа-ритм характерен для подавляющего большинства взрослых здоровых людей (свыше 90%). Наивысшая амплитуда колебаний, как правило, достигается при пребывании в состоянии покоя, в тёмной комнате либо с закрытыми глазами. Наиболее чётко альфа-ритм фиксируется в области затылка. При активизации мыслительного процесса или поступлении зрительных сигналов альфа-колебания блокируются либо исчезают.
- Бета-ритм с частотой, лежащей в интервале от 13 Гц до 30 Гц, проявляется в моменты высокой мыслительной активности, преимущественно в лобных долях мозга. Обязательным условием его проявления служит возбуждение эмоционального или психического характера Амплитуда колебаний не слишком высока.
- Гамма-ритм характеризуется небольшой амплитудой (до 10 мкВ) и достаточно высокой частотой колебаний, которая может изменяться в широком диапазоне: от 30 Гц до 150-180 Гц. Если амплитуда гамма-колебаний превышает 15 мкВ, это считается признаком патологии, характеризующейся снижением интеллекта. Гамма-ритм фиксируется в ситуациях, связанных с напряжённой умственной деятельностью или требующих концентрации внимания.
- Каппа-ритм проявляется в височных долях с частотой от 8 до 12 Гц при умственной активности и подавляет альфа-ритм остальных участков мозга.
- Лямбда-ритм фиксируют в затылочной части мозга в виде колебаний небольшой амплитуды в узком диапазоне, всего 4-5 Гц. Он возникает в моменты принятия зрительных решений, например, во время поиска глазами нужного предмета. При зрительной концентрации в одной точке он исчезает.
- Мю-ритм с интервалом в пределах от 8 Гц до 13 Гц характерен для затылочной части мозга и фиксируется во время пребывания в спокойном состоянии.
Ритмы мозга в спящем состоянии
У спящего человека нейрофизиологи обнаружили и описали три различных режима электромагнитной активности нейронов.
- Дельта-ритм наблюдается в состоянии глубокого сна и во время пребывания больных в коме. Кроме того, его фиксируют на участках коры мозга, расположенных рядом с опухолевыми новообразованиями. В некоторых случаях он наблюдается у детей 4-6-летнего возраста.
- Тэта-ритм характерен для особого участка мозга, называемого гиппокампом, его частота варьирует в пределах от 4 Гц до 8 Гц. Установлена ведущая роль тэта для процесса усвоения информации.
- Сигма-ритм возникает на начальной стадии естественного сна с частотой в пределах от 10 Гц до 16 Гц.
Психология. Журнал Высшей школы экономики. 2006. Т. 3, № 2. С. 62-72.
РОЛЬ ВЫСОКОЧАСТОТНЫХ РИТМОВ ЭЛЕКТРИЧЕСКОЙ АКТИВНОСТИ МОЗГА В ОБЕСПЕЧЕНИИ ПСИХИЧЕСКИХ ПРОЦЕССОВ1
Н.Н. ДАНИЛОВА
Данилова Нина Николаевна — профессор факультета психологии МГУ им. М. В. Ломоносова, доктор психологических наук. Лауреат Ломоносовской премии и конкурса Института «Открытое общество» в рамках программы «Высшее образование». Имеет звания: Заслуженный профессор Московского университета, Почетный работник высшего профессионального образования, Заслуженный работник Высшей школы Российской Федерации. Автор более 150 научных работ, в т. ч. монографии «Функциональные состояния: механизмы и диагностика» (1985), коллективных монографий «Функциональные состояния мозга» (под ред. Е.Н. Соколова, Н.Н. Даниловой, Е.Д. Хомской, 1974), «Стресс и индивидуальные различия» (под ред. Н.Н. Даниловой и Я. Матысяка, Варшава, 1991), учебников «Физиология высшей нервной деятельности» (совм. с А.Л. Крыловой, 1989), «Психофизиологическая диагностика функциональных состояний» (1992), «Психофизиология» (1998-2004).
Контакты: danilovan@mail.ru
Резюме
В статье обсуждается механизм возникновения гамма-осцилляций мозга, которые, как показывают исследования последних лет, вовлечены в реализацию самых различных психических процессов: усиление внимания и изменение функционального состояния, перцепцию и рабочую память, узнавание и опознание стимула, сознание, выполнение семантических операций и т. д. Обсуждаются две гипотезы происхождения гамма-ритма — пейсмекерная и ансамблевая. Для анализа этой проблемы разработан специальный исследовательский метод, основанный на узкополосной частотной фильтрации так называемого вызванного гамма-ритма, локализации его дипольных источников на структурных МРТ срезах мозга. Полученные данные совместимы с пейсмекерной гипотезой.
Современные технологии объемного отображения активности мозга человека, такие, как позитронная эмиссионная томография (ПЭТ) и функцио-
нальная магнитно-резонансная томография (фМРТ), предоставляют уникальные возможности для изучения мозговых механизмов психической
‘Работа поддержана РФФИ (грант № 05-06-80330).
деятельности человека. Они позволяют выявлять зоны локальной активности, специфически связанные с той или другой психической функцией (Розпег, 2004; Розпег, RaicЫe, 1998). Данные методы дорогостоящи и сегодня имеют недостаточно высокое временное и пространственное разрешение. Наиболее высокое временное и пространственное разрешение достигается при регистрации нейронной активности мозга. Но такой метод практически мало приемлем для человека, так как требует операционного вмешательства в мозг. Однако в качестве аналога нейронной активности человека можно рассматривать гамма-ритм, регистрируемый в составе ЭЭГ при высокой частоте оцифровки электрического сигнала.
На это указывает высокая частота гамма-ритма, которая охватывает широкий диапазон частот от 30 до 600 Гц и выше. Гамма-ритм присутствует не только в электрической (ЭЭГ), но и в магнитной записи активности мозга (МЭГ). Недавно получено новое подтверждение связи гамма-ритма с нейронной активностью мозга. Показана высокая корреляция уровня синхронизации гам-ма-осцилляций с гемодинамическим сигналом (фМРТ), зависящим от содержания кислорода в крови. Сравнение записей, полученных параллельно при внутриклеточной регистрации спайковых разрядов отдельных нейронов, мультинейронной активности и фокального потенциала с сигналом фМРТ от зрительной коры обезьяны показало, что изменения в фокальном потенциале наилучшим образом коррелируют с динамикой гемодинамического сигнала (Logothetis е! а1., 2001).
Метод фМРТ позволяет любой вид когнитивной деятельности представить в виде распределенной системы очагов активности, зависящей от ее специфики. Высокая корреляция гамма-ритма с гемодинамиче-ским сигналом дает основание рассматривать его в качестве неинвазив-ного показателя активности локальных нейронных ансамблей. Сходную точку зрения высказывает Е. Басар. Он определяет гамма-ритм как мост через пропасть, разделяющую активность отдельных нейронов и их нейронных ансамблей (Basar et al., 2001).
Впервые гамма-ритм в низкочастотном диапазоне (30-80 Гц) был выделен Бергером в 1924 г., когда он у своего сына зарегистрировал электрическую активность мозга во время решения им арифметических задач. С тех пор электрофизиологи мало обращали внимания на высокочастотную активность мозга. Одна из причин — малая величина гамма-сигнала: около 1 мкв, для регистрации которого длительное время не было нужной техники. И только в последние годы, когда появились первые экспериментальные данные, подтверждающие вовлечение гамма-осцил-ляций в реализацию самых различных психических процессов, возник бурный всплеск интереса специалистов, работающих в области нейро-наук, к роли и функции гамма-ритма.
Установлена связь гамма-ритма с усилением внимания и изменением функционального состояния (Данилова, Быкова, 2003; Данилова и др., 2005; Данилова, Ханкевич, 2001; Tii-tinen, 1993), с восприятием, узнаванием и опознанием стимула (Данилова, Астафьев, 2000; Данилова, Быкова,
2003; Basar et al., 2000; Singer, Gray, 1995), иллюзией (Kojo, Liinasuo, Ro-vamo, 1993), с рабочей памятью (Tal-lon-Baudry, 1995; Tallon-Baudry, Kreiter, Bertrand, 1999), с процессами сознания (Singer, 1991; Singer, Gray, 1995), с выполнением семантических операций (Lutzenberger et al., 1994; Pulvermuller et al., 1995). Гамма-ритм требуется для выполнения двигательных реакций. Вспышки гамма-ритма появляются в моторной и пре-моторной коре, дополнительном моторном поле и в париетальной коре человека до начала движения, регистрируемого в виде электромиограм-мы (ЭМГ), продолжаются во время его исполнения и дополнительно появляются на прекращение движения. Вспышки гамма-осцилляций в моторной коре совпадают по частоте и опережают по фазе ритм Пипера ЭМГ. Гамма-ритм при регистрации ЭМГ — это наиболее простое доказательство его управляющей функции. Усиление мощности гамма-ритма наблюдается и при торможении двигательной реакции на нецелевой стимул (Mima et al., 1999; Popivanov, 1999).
Показана зависимость успешности сохранения информации в рабочей памяти от мощности гамма-ритма. В опытах с периодом задержки, в течение которого требуется сохранять ранее полученную информацию для последующего ее использования, исследователи наблюдали на интервале задержки устойчивое увеличение мощности гамма-осцилляций (24-60 Гц) в зрительной коре и бе-та-осцилляций (15-20 Гц) во фронтальной. Увеличение периода задержки приводило к ослаблению гамма-осцилляций, что совпадало с
параллельным ухудшением результатов опознания целевого стимула (Tallon-Baudry, 1999). Авторы полагают, что репрезентации объектов в зрительной кратковременной памяти состоят из синхронизированных осцилляций клеточных ансамблей.
Включение гамма-ритма в самые различные сенсорные, когнитивные и исполнительные процессы, наличие его в различных структурах мозга не только человека, но и животных, в том числе беспозвоночных, позволяет рассматривать его в качестве универсального механизма мозга. Е. Басар сравнивает гамма-осцилляции с функциональными строительными блоками, из которых формируются когнитивные и сенсорные процессы (Basar, 1999; Basar et al., 2000).
Открытие явления пространственно-временной синхронизации гамма-ритма между удаленными участками мозга заложило основу для появления концепции связывания (binding) (Eckhorn et al., 1988). Сам принцип связывания нейронов в более сложные структуры на основе корреляции их сигналов во времени был предложен К. фон дер Мальс-бургом и В. Шнайдером (Von der Malsburg, 1995). Первоначально речь шла о том, что когерентные гамма-осцилляции отражают механизм зрительной коры, обеспечивающий интеграцию различных черт объекта для конструирования его образа, формирования гештальта (Eckhorn et al., 1990; Kojo, 1993). Р. Экхорн (Eckhorn et al., 1988) вводит понятие пространственного «контраста синхронизации» между областями, представляющими разные объекты, что позволяет различать их. Позже синхронизация осцилляторной активности
удаленных локусов мозга на частоте гамма-ритма стала рассматриваться как более универсальный и основной механизм коммуникации между нейронными сетями, который обеспечивает различные психические процессы и их взаимодействие (Basar, 1999).
Факт пространственно-временной синхронизации на частоте гам-ма-осцилляций многократно подтвержден при регистрации активности мозга человека и животных как поверхностными электродами и специальными датчиками (в случае регистрации магнитной активности мозга), так и при регистрации спай-ковой активности отдельных нейронов. Нейроны зрительной коры кошки, пространственно удаленные, но обладающие одинаковыми детекторными свойствами с селективной настройкой реагировать на перемещающиеся полоски в определенном направлении и с определенной скоростью, при восприятии адекватных для них зрительных стимулов разряжались пачками потенциалов действия (ПД), повторяющимися с частотой 40 Гц гамма-ритма. Если же полоски пересекали рецептивные поля нейронов в другом направлении, то синхронизация их разрядов не возникала (Singer, 1991).
Согласно концепции связывания, ритмическая активность, генерируемая в одном локусе мозга, при определенных обстоятельствах может инициировать такой же ритм в другом участке мозга, что и обеспечивает их взаимодействие и связывание в одну систему.
Вычисление функции когерентности гамма-ритма по многоканальной ЭЭГ или МЭГ используется для определения частотно-фазовых от-
ношений гамма-осцилляций, регистрируемых различными электродами. В зависимости от величины фазового сдвига метод позволяет определять ведущие и ведомые участки мозга, взаимодействующие на общей частоте. Такой подход позволил обнаружить нейронные генераторы ритмической активности в специфических и неспецифических ядрах та-ламуса, показать их роль в появлении осцилляторной активности в новой коре, а также исследовать обратные связи от коры к таламусу, поддерживающие взаимодействие этих структур в процессе восприятия стимулов (Pedroarena, Llinas, 1997).
Однако не все экспериментальные данные укладываются в концепцию пространственно-временного связывания. Так нейроны-детекторы зрительной коры кошки, обладающие общей избирательностью в отношении определенных параметров стимула, представляющие различные колонки зрительной коры, которые пространственно удалены друг от друга на 7 мм, демонстрируют синхронизацию гамма-осцилляций при нулевой фазовой задержке (Singer, 1991). Это означает, что синхронизация гамма-осцилляций не обязательно предполагает последовательную передачу сигнала от одного нейрона к другому. С позиции концепции связывания трудно объяснить и другие свойства нейронов-детекторов: чем ближе стимул по своим характеристикам к селективным свойствам нейрона, тем больше амплитуда фокальных ритмических потенциалов на частоте 70-80 Гц в зоне отведения активности нейрона, что можно объяснить лишь тем, что генерация гамма-осцилляций связана
с гипотетическим резонансным механизмом.
Понимание механизма синхронизации гамма-осцилляций требует рассмотрения самого процесса генерации гамма-ритма.
Существуют две основные гипотезы относительно возникновения гамма-ритма. Согласно первой, гамма-ритм создается как результат функционирования ансамбля нейронов, ритмическая активность которого возникает за счет обратных и реци-прокных связей между его нейронами. По другой гипотезе, существуют нейроны-пейсмекеры как внутриклеточные генераторы или водители ритма, активность которых и определяет появление гамма-ритма (Соколов, 2003). Их эндогенная ритмическая активность проявляется и после полной изоляции такого нейрона от связей с другими клетками (Гречен-ко, 1999). Такая эндогенная ритмическая активность отдельного нейрона представлена последовательностью негативно-позитивных пейсмекер-ных потенциалов, которые не обязательно переходят в спайковые разряды. Внутриклеточная микроэлектродная регистрация пейсмекерных нейронов специфического таламуса показала, что частота эндогенных потенциалов зависит от состояния нейрона, представленного уровнем его мембранного потенциала. С деполяризацией нейрона растет частота его эндогенных потенциалов. Генерация нейроном-пейсмекером гамма-ритма связана с активацией высокопороговых ионных каналов кальция, локализованных на дендритах. За медленные осцилляции, на частоте альфа-ритма ответственна низкопороговая кальциевая проводимость на
соме того же нейрона (Pedroarena, Llinas, 1997). Другим важным свойством пейсмекерных нейронов является их реакция на внешние стимулы. Постсинаптические потенциалы, поступающие на пейсмекерный нейрон, могут влиять на смещение фазы пейсмекерной волны, вызывая ее перезапуск (reset). В результате этого пейсмекерная волна, имеющая эндогенное происхождение, синхронизируется с внешним стимулом. Входной сигнал вызывает гиперполяризацию нейрона — тормозную паузу в ритмических эндогенных потенциалах, после которой они вновь восстанавливаются на прежней частоте. Длительность тормозной паузы, определяющая величину фазового сдвига, зависит от параметров входного сигнала (Kazantsev, Nekorkin, Makarenko, Llinas, 2004). Таким образом, пейсмекерный нейрон управляется входными сигналами. Пейс-мекерные нейроны обладают также свойством пластичности, благодаря которой могут менять частоту своих эндогенных потенциалов.
Итак, гипотеза генерации гамма-ритма, основанная на ансамблевом взаимодействии нейронов, предполагает наличие по крайней мере двух пространственно разделенных очагов активности и передачу сигнала от одного к другому. Тогда как пейсмекерная гипотеза позволяет предположить существование изолированных очагов активности гамма-ритма, которые не связаны друг с другом последовательной передачей сигнала.
Установление механизма перезапуска пейсмекерной волны, приводящего к синхронизации пейсмекер-ной волны со стимулом, имеет важные
следствия. При повторении стимула усреднение вызванных потенциалов (ВП) в результате перезапуска пейс-мекерной волны не будет приводить к подавлению гамма-колебаний, так как они будут одинаково синхронизированы со стимулом. При регулярной подаче стимула с постоянным интервалом в результате формирования условного рефлекса на время пейсмекерные волны могут синхронизироваться с моментом времени, предшествующим подаче стимула, образуя механизм антиципации, предваряющей действие очередного стимула.
Проверка рассмотренных следствий, исходящих из пейсмекерной гипотезы происхождения гамма-ритма, привела к формированию следующей парадигмы исследования, получившей название метода микроструктурного анализа гамма-ритма (Данилова, 2005; Данилова и др., 2005). Он включает:
1) многократное повторение сенсорного стимула для получения усредненного ВП для каждого канала регистрации активности мозга;
2) выделение из усредненного ВП методом узкополосной частотной фильтрации так называемого вызванного гамма-ритма, синхронизированного по фазе со стимулом, что отвечает характеристикам пейсме-керных нейронов;
3)определение локализации в структурах мозга эквивалентного диполя на каждой частоте гамма-ос-цилляций на основании данных, полученных 16-канальной регистрацией вызванных потенциалов;
4) совмещение мозговой локализации каждого эквивалентного диполя на данной частоте с соответствую-
щим срезом структурной томограммы мозга обследуемого наблюдателя;
5) анализ распределения разных по частоте и локализации эквивалентных диполей на интервале антиципации и сенсорного ответа;
6) измерение активности узкополосных гамма-генераторов суммой локализованных эквивалентных диполей для интервала антиципации и сенсорного ответа.
Узкополосный гамма-ритм человека был исследован в опытах с многократным предъявлением индифферентных звуковых щелчков в одной серии и с выполнением на те же стимулы двигательной реакции — в другой.
Многократное повторение звукового стимула подтвердило известные данные о локализации максимальной амплитуды ВП под электродами, представляющими область слуховой коры. В составе усредненного ВП присутствуют узкополосные гамма-колебания в полосе частот 30-75 Гц, представленные на участке антиципации и сенсорного ответа (рис. 1). Однако узкополосные гамма-колебания, различающиеся частотой, появляются с разной вероятностью и имеют различную интенсивность. Временная дискретность активности узкополосных гамма-ос-цилляций в составе усредненной ЭЭГ отчетливо видна на частотно-временных гистограммах, где их активность измеряется количеством эквивалентных диполей для каждого кванта времени в 100 мс (рис. 2).
Решение обратной задачи — расчет координат эквивалентных токовых диполей узкополосных гамма-ос-цилляций по данным многоканальной ЭЭГ — показало их пространственную дискретность — точечную
Рис. 1
Широкополосная (30-45 Гц) и узкополосная частотная фильтрация ВП с шагом в 1 Гц в том же частотном диапазоне
Вертикальная линия — метка подачи стимула
F4 — отведение ЭЭГ, для которого получен ВП
Виден различный вклад частотно-специфических гамма-осцилляций в реакцию антиципации и сенсорный ответ (100 мс после стимула)
локализацию в структурах мозга (рис. 3).
При действии индифферентного звука эквивалентные дипольные источники разных по частоте осцилля-ций локализуются преимущественно в модально-специфической части височной коры, связанной с восприятием звука. Однако при привлечении внимания к стимулу часть их во время реакции антиципации звукового стимула и сенсорного ответа локализуется в передней поясной и фронтальной коре. При этом возникает частотно-фазовая синхронизация гамма-осцилляций, регистрируемых в слуховой коре и передних отделах мозга (поясной и фронтальной
коре). Последние результаты подтверждаются картиной фокусов ге-модинамической активности мозга, полученной методом фМРТ при анализе исполнительного внимания, которую описывают как переднюю мозговую нейронную сеть, включающую фронтальные доли и переднюю поясную кору (Duncan, 2004). Ее активация требуется как для выполнения инструкции, так и для процессов саморегуляции и контроля.
Итак, при сопоставлении следствий, вытекающих из пейсмекерной гипотезы происхождения гамма-ритма, с результатами проведенных экспериментов можно заключить, что
Рис. 2
Гистограмма частотно-временного распределения активности частотно-специфических гамма-осцилляций в составе усредненной ЭЭГ длительностью в 1,5 с после стимула
По горизонтальной шкале частота осцилляций от 30 до 45 Гц. Шкала времени разбита на кванты по 100 мс от начала стимула. Интенсивность гамма осцилляций представлена суммой выявленных эквивалентных дипольных источников для каждого кванта времени. Виден дискретный характер активности гамма-осцилляций. (Индивидуальные данные исп. М.С.)
Рис. 3
Проекция шести эквивалентных дипольных источников для гамма-осцилляций с частотой 35 Гц для временного окна 100 мс после стимула на аксиальный структурный МРТ срез мозга исп. М.С.
Видна точечная привязка диполя к локальному участку слуховой коры в условиях восприятия
индифферентных звуковых щелчков
полученные данные не противоречат этим следствиям.
Сохранение гамма-колебаний при усреднении ответов свидетельствует в пользу участия механизма перезапуска пейсмекерной волны, обеспечивающего ее синхронизацию со стимулом и тем самым препятствующего подавлению таких синхронизированных колебаний. Тот факт, что такая синхронизация наблюдается на отдельных частотах, указывает, что перезапуск пейсмекерной волны имеет место в отдельных пейсмекер-ных нейронах, обладающих разной частотой пейсмекерной активности.
Точечная привязка источников узкополосных гамма-осцилляций к локальным участкам мозга соответствует принципу отдельных пейсме-керных нейронов, а не ансамблевому механизму возникновения гамма-ритма. Появление источников узкополосных гамма-осцилляций в условиях активного внимания в передней поясной и фронтальной коре на участке антиципации стимула и сенсорного ответа также согласуется с
механизмом перезапуска пейсмекер-ных волн.
Гипотеза пейсмекерного происхождения гамма-ритма позволяет далее предположить, что в структурах мозга существует множество пейсме-керных нейронов, которые встроены в локальные нейронные сети и при деполяризации будут генерировать гамма-осцилляции на своих частотах. Системная интеграция пространственно удаленных нейронных сетей осуществляется за счет фазово-час-тотной синхронизации гамма-осцил-ляций их пейсмекерных нейронов. Нейроны-пейсмекеры локальных нейронных сетей в составе единой системы имеют общую резонансную частоту. Когерентность гамма-осцил-ляций в такой системе возникает в результате прихода к ним общего сигнала.
В заключение следует подчеркнуть, что интеграция структурной МРТ с локализацией частотно-специфических эквивалентных диполей позволяет глубже понять функции гамма-ритма.
Литература
Греченко Т.Н. Психофизиология. М.: Гардарики, 1999.
Данилова Н.Н. Гамма-осцилляции в когнитивной деятельности человека // ХХХ Всероссийское совещание по проблемам высшей нервной деятельности, посвященное 150-летию со дня рождения И.П. Павлова. СПб, 2000. С. 63-66.
Данилова Н.Н. Микроструктурный анализ гамма-ритма как метод изучения когнитивных процессов // Проблемы нейрокибернетики (материалы 14-й Меж-
дународной конференции по нейроки-бернетике). Ростов-н/Д, 2005. Т. 1. С. 184-186.
Данилова Н.Н., Астафьев С.В. Внимание человека как специфическая связь ритмов ЭЭГ с волновыми модуляторами сердечного ритма // Журн. высш. нервн. деят. 2000. Т. 50, № 5. С. 791-804.
Данилова Н.Н., Быкова Н.Б. Осцилля-торная активность мозга и информационные процессы // Психология: современные направления междисципли-
нарных исследований. Доклады конференции / Под ред. А.Л. Журавлева, Н.В. Тарабриной. М.: Изд-во ИП РАН, 2003. С. 271-283.
Данилова Н.Н., Быкова Н.Б. Роль частотно-специфических кодов в процессах внимания // Доклады второй Международной конференции, посвященной 100-летию со дня рождения А.Р. Лурия / Под ред. Т.В. Ахутиной, Ж.М. Глозман. М.: Смысл, 2003. С. 290-295.
Данилова Н.Н., Быкова Н.Б., Аниси-мов Н.В., Пирогов Ю.А., Соколов Е.Н. Гамма-ритм электрической активности мозга человека в сенсорном кодировании // Биомедицинская радиоэлектроника. 2002. № 3. С. 34-42.
Данилова Н.Н., Быкова Н.Б., Пирогов Ю.А., Соколов Е.Н. Исследование частотной специфичности осцилляторов гамма-ритма методами дипольного анализа и анатомической магнитно-резонансной томографии // Биомедицинские технологии и радиоэлектроника. 2005. №4-5. С. 89-97.
Данилова Н.Н., Ханкевич А.А. Гамма-ритм в условиях различения временных интервалов // Вестн. Моск. ун-та. Сер. 14. Психология. 2001. № 1. С. 51.
Соколов Е.Н. Восприятие и условный рефлекс: новый взгляд. М.: Изд-во Моск. ун-та, 2003.
Basar E. Brain function and oscillations. II: Integrative brain function. Neurophysiology and cognitive processes. Springer, 1999.
Basar E, Basar-Eroglu C, Karakas S, Schurman M. Brain oscillation in perception and memory // International Journal of Psychophysiology. 2000. Vol. 35. P. 95.
Basar E, Basar-Eroglu C, Karakas S, Schurman M. Gamma, alpha, delta, and theta oscillations govern cognitive processes // International Journal of Psychophysiology. 2001. Vol. 39. P. 241-248.
Duncan J. Selective attention in distributed brain system // M. Posner (ed.). Cognitive Neuroscience of attention. The Uilford Press. N. Y.;London, 2004. P. 105-113.
Eckhorn R, Bauer R, Jorden W, Brosch M, Kruse W, Munk M.H.J., Reitboeck H.J. Coherent oscillations: a mechanizm of feature linking in the visual cortex? Multiple electrode and correlation analysises in the cat // Biological Cybernetics. 1988. Vol. 60. P. 121-130.
Eckhorn R, Reitboeck H.J., Arndt M, Dickt P. Feature linking via synchronization among distriuted assemblies: Simulations of results from cat visual cortex // Neural Computetion. 1990. Vol. 2. P. 293.
Kazantsev V.B., Nekorkin V.I., Makaren-ko V.I., Llinas R. Self-referential phase reset based on inferior olive oscillator dynamics // PNAS. 2004. Vol. 101, № 52. P. 18183-18188.
Kojo I., Liinasuo M, Rovamo J. Spatial and temporal properties of illusory figures // Vision Res. 1993. Vol. 33. P. 897-901.
Logothetis N.K, Pauls J., Augath M, Tri-nath T, Oeltermann A. Neurophysiological investigation of the basis the fMRI signal // Nature. 2001. Jul. Vol. 12. 412 (6843). P. 150-157.
Lutzenberger W, Pulvermuller F, Birbau-mer N. Words and pseudowords elicit distinct patterns of 30-Hz activity in humans // Neurosci. Lett. 1994. Vol. 176. P. 115.
Mima T, Simpkins N, Oluwatimilehin T, HallettM. Force Level Modulates Human Cortical Oscillatory Activities // Neurosci. Lett. 1999. Vol. 275, № 2. P. 77-80.
Pedroarena Ch, Llinas R. Dendritic calcium conductances generate high-frequency oscillation in thalamocortical neurons // PNAS. 1997. Vol. 94. P. 724-728.
Posner M. L. Progress in attention research // M. Posner (ed.). Cognitive Neuroscience of attention. The Uilford Press. N. Y.;London, 2004. P. 3-9.
Posner M.L., Raichle M.E. (eds.). Overview: The neuroimaging of human brain function // Proceedings of the National Academy of Sciences USA, 1998. Vol. 95. P. 763-764.
Popivanov D, Mineva A., Krekule I. EEG Patterns in Theta-Frequency-Range and Gamma-Frequency-Range and Their Probable Relation to Human Voluntary Movement Organization // Neurosci. Lett. 1999. Vol. 267. №. 1. P. 5-8.
Pulvermuller F, Preissl H, Lutzenberger W, Birbaumer N. Spectral responses in the gamma-band: physiological signs of higher cognitive processes? // NeuroReport. 1995. Vol. 6. P. 2057.
Singer W. Response synchronization of cortical neurons: an epiphenomenon or a solution to the binding problem? // Ibro News. 1991. Vol. 19, № 1. P. 6.
Singer W, Gray C.M. Visual feature integration and the temporal correlation hy-
pothesis //Annu. Rev. Neurosci. 1995. Vol. 18. P. 555-586.
Tallon-Baudry C, Bertrand O, BouchetP, Pernier J. Gamma-range activity evoked by coherent visual stimuli in humans // Eur. J. Neurosci. 1995. Vol. 7. P. 1285-1291.
Tallon-Baudry C, Kreiter A., Bertrand O. Sustained and Transient Oscillatory Responses in the Gamma-Band and Beta-Band in a Visual Short-Term-Memory Task in Humans // Visual Neuroscience. 1999. Vol. 16, № 3. P. 449-459.
Tiitinen H, Sibkkonen J., Reinkainen K, Alho K, Lavikainen J., Naatanen R. Selective attention enhances the auditory 40-Hz transient response in humans // Nature. 1993. Vol. 364. P. 59-60.
iНе можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
Von der Malsburg C, Schneider W. Binding in models of perception and brain function // Current Opinion in Neurobiology. 1995. Vol. 5. P. 520-526.
Физиология мозга.
Мы часто сравниваем человеческий мозг со сложным компьютером. Эта аналогия не слишком удачна, но если рассуждать о реальных возможностях и функциях мозга, то количество логических процессов, которые в нем происходят, поразительно велико.
Человеческий мозг состоит из трех основных элементов:
- Глиальные клетки
- Нейроны
- Дендриты
1) Глиальные клетки
Название «глиальный» происходит от греческого слова «glia», означающего «клеить». Хотя эти клетки обладают мембранным потенциалом, глиальные клетки по большей части не имеют нервных окончаний и выполняют поддерживающую роль для головного и спинного мозга.
Выявлено 7 типов глиальных клеток, все они выполняют разные функции. Глиальные клетки поддерживают высокий уровень рибонуклеиновой кислоты (RNA), протеинов и энзимов (ферментов).
Один из энзимов, производимых глиальными клетками, является ацетилхолинестераза (AChE). Ацетилхолинестераза связана напрямую с памятью и способностью к обработке информации. Некоторые типы глиальных клеток, особенно астроциты, обеспечивают питание для нейронов.
Другие синтезируют миелин, который используется для предотвращения пересечения друг с другом нервов и нейронов. Микроглия и астроциты являются фагоцитарными, это значит, что они очищают центральную нервную систему от мертвых клеток и продуктов распада.
Глиальные клетки обладают способностью делиться и размножаться в течение всей жизни. Они имеют ответвления, но не имеют аксонов и дендритов. В последних исследованиях выяснилось, что некоторые глиальные клетки могут действовать как усилители, наподобие транзисторов.
Их назначение — это поддержка нервных связей и обеспечение функционирования нервной сети, объединяющей различные области коры головного мозга.
Человеческий мозг в 5 раз больше, чем мозг шимпанзе, однако нейронов содержит всего на 30-50% больше. Похоже, что интеллектуальные границы, отделяющий человека от обезьяны, являются следствием действия в человеческом мозге именно глиальных клеток, которые превосходят по численности нейроны примерно 5 к 1.
В результате новых технологических разработок в создании современных исследовательских приборов, ученые смогли изучить различные виды активности, происходящие в глиальных клетках. Исследования нейрофизиолога Гарри Линча (Gary Lynch) из калифорнийского университета в Ирвине показали, что в зародыше, еще в период до роста нейронов и аксонов, глиальные клетки проявляют повышенную активность.
Глиальные клетки делятся и перемещаются в мозге через интактные ткани. Они преодолевают большие расстояния в мозге, чтобы достичь активных областей мозга, а те, которые уже присутствуют на месте, демонстрируют невероятные реакции. Они выбрасывают ответвления и становятся очень большими. Все это происходит еще до того, как аксоны вырастают из нейронов.
2) Нейроны
Нейроны – нервные клетки мозга. Они образуют серое вещество, представляющее собой самый внешний 2-х миллиметровый слой мозга. Нейроны состоят из тела клетки, аксона и одного или более дендритов.
Функция нейронов – создавать и проводить нервные импульсы.
Ко второму триместру беременности развивающийся мозг уже способен вырабатывать примерно сотню нейронов в минуту. К двухлетнему возрасту ребенок может иметь уже сотню миллионов нейронов в мозге.
Люди со временем могут терять нейроны, особенно в той части мозга, которая менее всего задействована, но потеря нейронов с лихвой компенсируется увеличением количества дендритов.
.
Внешняя поверхность мозга, на которой располагаюся нейроны, состоит из извилин и борозд (складки и извилины мозга). Эта извилины и борозды увеличивают площадь поверхности расположения нейронов.
Если распрямить борозды и извилины мозга, мы получим поверхность, площадью примерно полтора квадратных фута.
3) Дендриты
Это слово происходит от греческого дерево. Аксоны и дендриты служат для связи различных нейронов. Дендриты образованы благодаря процессам в протоплазме нейронов, и передают импульсы к телу клетки нейрона. Обычно задействованы несколько сотен дендритов.
Они формируют связи, которые называются «синапсы», с другими нейронами. В результате, дендриты представляют собой систему «проводов» мозга. Они формируются мыслительными процессами, воздействием окружающей среды, обучением и жизненным опытом.
Установлено, что у образованного взрослого человека развивается примерно 1 триллион дендритов в мозге, что при физическом измерении составило бы примерно 100 000 миль (160 934,4 км.). На рисунке 1 показан нейрон и его дендриты.
ВОЛНОВАЯ АКТИВНОСТЬ МОЗГА
Типичному нейрону нужна 1 микросекунда, чтобы ответить на стимул, но когда миллионы нейронов реагируют в унисон, они производят «качающиеся» электрические разряды. Эти разряды создают ритм который получил название «мозговая волна».
Эти ритмы поддаются наблюдению посредством ЭЭГ. ЭЭГ записывает и измеряет огромное количество нейронов, реагирующих одновременно.
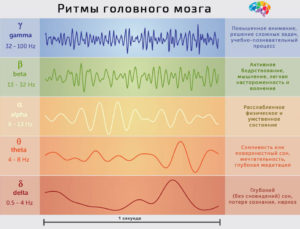
Эти ритмы волн мозговой активности формируются в несколько групп, в зависимости от их частот:
Бета, Альфа, Тета и Дельта (Beta, Alpha, Theta и Delta.
Майкл Маккензи
Электрическая активность мозга, может быть определена посредством ЭЭГ (электроэнцефалограммы), которая измеряет частоту электрического потенциала. Эта частота измеряется в циклах в секунду или Гц (Герц).
В любое определенное время эти частоты определяют Ваше настроение. Скорость частоты позволяет нам группировать наши мозговые волны в четыре категории.
Бета волны — самые быстрые мозговые волны, располагающиеся в частоте от 13 до 100 Гц. Во время Бета волновой активности мы находимся в нормальном бодрствующем состоянии, внимания и концентрации. Когда мы чувствуем себя взволнованными или обеспокоенными — это быстрые бета волны (30 гц ), Когда мы чувствуем угрозу, чрезвычайную опасность или вступаем борьбу или бегство — это сверхбыстрые бета волны.
Если закрыть глаза, расслабиться, станать пассивным и рассредоточенным активность мозговых волн замедлится, и появятся альфа-волны. Они располагаются в частоте от 8 до 12.9 Гц. Мы вступаем в состояние“сверхобучения” находящееся в пределах более высокого конца Альфа волн, и мы начинаем производить успокаивание нейрохимические вещества. Более глубокие структуры Альфа-ритма характерны для традиционной медитации.
Поскольку спокойствие и расслабление углубляются в сонливость, мозговые сдвигаются в сторону более медленных тета-волны. Диапазон частот тета-волн от4 до 7.9 Гц. Тета-волны часто сопровождются неожиданными, сказочными умственными изображениями. Весьма часто эти изображения могут сопровождаться яркими воспоминаниями, преобладают, как правило, воспоминания детства. Тета активность мозговых волн связана с заживлением, увеличенным творческого потенциала, внезапной способностью проникновения в суть (эврика), когда все внезапно становится ясным.
Даже очень продвинутые медитаторы могут достигать тета-состояния в течение короткого периода времени.
Дельта волны — самые медленные мозговые волны, располагающиеся в частоте от 0.1 до 3.9 Гц. Обычно, люди спят во время дельта волн, однако есть доказательство, что возможно остаться в сознании и в этом состоянии —чрезвычайно глубокого подобного трансу. Также в пределах дельта — волновой активности мозга значительно повышается продукция исцеляющего соматотропина.
Каждая из этих групп представляет собой особый тип корковой активности и соотносится с такими состояниями сознания, как тревога, спокойствие, сновидение или состояние сна.
Мы постоянно производим некоторое количество одновременно всех этих частот. Поэтому состояние нашего сознания отражает смешанную активность ритмов разных волн мозговой активности и их локализацию.
Ритм волн мозговой активности характеризуется самой большой мощностью волновой активности определенной категории. Например, человек с закрытыми глазами производит большое количество альфа и малое количество бета волн в визуальной части коры, т.к. он не обрабатывает визуальную информацию.
Когда глаза открыты, производство альфа – волн резко сокращается, а мощность бета–волн возрастет в результате обработки в визуальной части коры поступаюшей визуальной информации.
Каждый из ритмов волн мозговой активности и разные состояния сознания, соответствующие каждому типу волн. Классификация ритмов волн мозговой активности изменяется в процессе того, как ученые получают новые сведения о мозге и состояниях сознания. Например, многие из этих категорий теперь имеют различные подгруппы.
БЕТА ВОЛНЫ
Бета-волны – это быстрые волны, низкой амплитудой, приблизительно от 14 до 40 циклов в секунду (Hz).
Бета-волны генерируются естественным путем, когда мы находимся в состоянии бодрствования, тревожном состоянии сознания.
Изначально бета-волны представляют собой процесс обработки данных, включающий сотни мелких вычислений между двумя ближайшими областями коры, которые работают вместе для достижения результата («Что это был за звук или образ?», «Сколько будет 2 + 3?», «Это опасно?», «Я боюсь», «Что мне делать?»).
Существуют 3 основные подгруппы бета-волн: Гамма (от 35 до 40 Hz), Бета 2 (от 24 до 34 Hz) и Бета 1 (от 14 до 23).
Гамма волны, самые быстрые, отражают пиковую деятельность сознания. Чрезмерная активность бета 2 связана с повышенными эмоциональными состояниями, такими как волнение и страх. Частоты бета 1 связаны с познавательными процессами, такими как решение проблем и мышление.
АЛЬФА ВОЛНЫ
Альфа волны вибрируют в диапазоне примерно от 8 до 13 Hz. Альфа активность представляет собой вибрации между фрагментами коры и зрительным бугром, известным как корково-таламическая петля.
Альфа волны проявляются в период сенсорного покоя (например, в тихой комнате с закрытыми глазами), умственной релаксации, глубокой релаксации, медитации или умиротворенного сознания (диссоциации).
Альфа волны – вожделенный результат медитирующих.
Традиционные методы медитации требуют 10 лет практики, чтобы достичь производства идеальных альфа волн. Производство альфа волн сокращается в момент обработки данной частью мозга сенсорной информации, а также в процессе решения проблем и познавательной активности.
Увеличение количества альфа волн дает:
- чувство умиротворения
- улучшенное академическую успеваемость
- тепло в конечностях
- повышенную производительность на рабочем месте
- ощущение благополучия
- снижение тревожности, улучшение сна
- улучшение иммунной функции.
Считается, что самые креативные гении, такие, как Эйнштейн, постоянно пребывали в почти неизменном альфа состоянии.
Большинство из таких творческих людей имели плохую успеваемость в школе и считались неблагополучными учениками. Возможно, они были слишком сконцентрированы на творческой активности, чтобы уделять внимание учебе.
В последние несколько лет были выделены новые подгруппы альфа волн. Мю волны (иногда их называют Тальфа) пограничны между Альфа/Тета волнами (от 7 до 9 Hz). Их активное производство ассоциируется со здоровым состоянием сознания, дающим исключительную интуицию и опыт личной трансформации.
Некоторые исследователи уверены, что «здоровая» мю активность может снижать состояние беспричинного гнева и тревоги от скрытых проблемных воспоминаний детства или душевных травм прошлого. Примеры этих волн мозговой активности — резонанс Шумана или «пятая стадия» медитации.
ТЕТА ВОЛНЫ
Частоты тета волн — от 4 до 8 Hz.
Тета волны ассоциируются с состоянием сна, «сумеречным» состояние, состоянием гипнотического транса, БДГ – фазой сна и состоянием сновидений.
В этом состоянии увеличивается активность памяти. Память улучшается (особенно долговременная память), повышается доступ к подсознанию, возможность свободных ассоциаций, повышается креативность, имеют место неожиданные озарения.
Это таинственное, особое состояние сознания. Долгое время ученые не могли исследовать это состояние мозга, т.к. обычный человек не может долгое время в нем оставаться без того, чтобы ни свалиться в сон (что также дает большое количество тета волн).
ДЕЛЬТА ВОЛНЫ
Дельта волны – самые медленные волны мозговой активности с частотой, колеблющейся от 1 до 4 Hz. Дельта волны доминируют, когда мы засыпаем и продолжают преобладать в состоянии глубокого сна.
Некоторые исследователи уверены, что дельта-волны присутствуют у целителей в состоянии «целительства» и у экстрасенсов во время получения информации.
Следующая таблица представляет свод позитивных, ассоциируемых с активностью разных групп волн мозговой активности.
Позитивные факторы Категории волн мозговой активности
Возможно, связаны с пиком жизненной активности. Гамма 35 — 45 Hz
Очень активное внешнее внимание. Бета 2 22 — 35 Hz
Активное внешнее внимание. Бета 1 15-22 Hz
Релаксация, пассивное внимание. Медленные бета волны 12-15 Hz
Релаксация, внутреннее внимание, медитация, здоровое ментальное состояние. Альфа (Верхние) 9- 13 Hz
Глубокая медитация, проницательность, Резонанс Шуманна, гипноз Медленные альфа волны — Мю/ Тальфа 7-9Hz
Креативность, БДГ- фаза сна, гипнагогическое соостояние Тета 5-7Hz
Улучшение сна. Дельта 1 -4 Hz
В течение нескольких минут мозг обычно производит некоторое количество всех видов волн. Однако, для специфического вида активности или поведения мозг способен производить изначально волны одной группы.
По сути, волны мозговой активности подобны волнам озера. Когда дует сильный ветер, большие волны появляются далеко в озере (большая амплитуда, низкая частота). А когда мы бросаем в озеро камешек, появляются небольшие волны очень близко к месту волнения (низкая амплитуда, высокая часота).
Интересная зависимость в том, что когда частота увеличивается, амплитуда уменьшается. Рисунок 3 показывает взаимосвязь типов поведения, ассоциируемых с преобладанием какой-то одной группы частот.
ВОЛНЫ МОЗГОВОЙ АКТИВНОСТИ И ЗДОРОВЬЕ ЧЕЛОВЕКА
Здоровый мозг выполняет много важных ментальных функций одновременно, производя большое количество волн мозговой активности разных частот, отражающих эти функции.
При сегодняшнем стрессовом образе жизни мы часто демонстрируем повышенную бета активность. Чтобы преодолеть этот негатив, многие ищут способы производства альфа волн – умиротворенного существования, релаксации.
Когда мы повышаем нашу альфа и тета (включая мю) активность посредством конструктивных процессов – медитаций, упражнений, средствами аудио визуальной стимуляции (АВС), мы добиваемся изменений состояния сознания или «альфа активности».
Важно, чтобы мы научились производить альфа волны на ежедневной основе посредством медитации или АВС.
Однако, многие находят, что легче добиваться альфа активности путем применения деструктивных средств, таких, как наркотики или алкоголь. А также постоянное, неконтролируемое, ненормальное наличие низкочастотной альфа или тета активности является причиной усталости или болезненных состояний, ассоциируемых с бессонницей, депрессией, расстройствами внимания, предменструальным синдромом и синдромом хронической усталости.
Самый важный аспект, связывающий волны мозговой активности со здоровьем человека – это способность изменять эти состояния в соответствии с требованиями ситуации.
Новая неделя, новый день, новый год. Время жизни разбито на отрывки разной длительности, и все эти отрывки повторяются. Каждые несколько часов нам хочется есть. Каждый вечер мы ложимся спать. Каждые четыре недели организм женщины вырабатывает яйцеклетку. Большинство процессов, происходящих с нашим телом, циклично, и одни циклы завязаны на другие. И хотя старение организма периодическим процессом не назовёшь (ведь никто не молодеет!), его ход напрямую зависит от биоритмов человека, в частности, от цикла сна и бодрствования. Доказательства этому находятся и на уровне поведения, и на уровне отдельных органов, клеток и генов.
Старение и долголетие
Цикл статей, задуманных в рамках спецпроекта «биомолекулы» для фонда «Наука за продление жизни».
В этом цикле рассмотрим общие проблемы старения клеток и организмов, научные подходы к долголетию и продлению здоровой жизни, связь сна и старения, питания и продолжительности жизни (обратимся к нутригеномике), расскажем про организмы с пренебрежимым старением, осветим темы (эпи)генетики старения и анабиоза.
Конечно, феномен старения настолько сложен, что пока рано говорить о радикальных успехах в борьбе с ним и даже о четком понимании его причин и механизмов. Но мы постараемся подобрать наиболее интересную и серьёзную информацию о нащупанных связях, модельных объектах, разрабатываемых и уже доступных технологиях коррекции возрастзависимых нарушений.
Краткое содержание спецпроекта освещено в видеоролике «Стареть или не стареть? // Всё как у зверей». Подробности же узнаете из наших статей.
Следите за обновлениями!
Часы в мозге
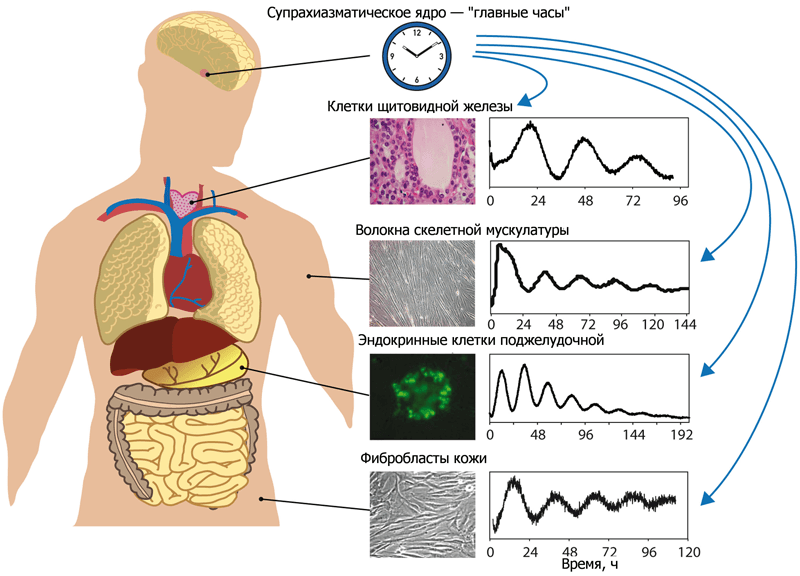
Наиболее заметный и один из самых важных в жизни человека биоритмов — циркадный, он же циркадианный (от слов circa — около, приблизительно и dias — день). Более простое название циркадных ритмов — ритмы сна и бодрствования . Это из-за них мы не можем работать сутками (а хотелось бы!) . Конечно, у циркадных ритмов существует и обратная, светлая, сторона: есть подозрение, что регулярная смена сна и бодрствования помогает организмам некоторое время не стареть . По крайней мере, доподлинно известно, что мозговые структуры, обеспечивающие работу «внутренних часов», у человека и мышей с возрастом проявляют явные признаки дегенерации. В число таких структур входят супрахиазматическое ядро (suprachiasmatic nucleus, SCN) гипоталамуса и голубое пятно (locus coeruleus, LC) — регион ствола мозга. Супрахиазматическое ядро — главный регулятор, управляющий работой других участков мозга и внутренних органов (рис. 1). Оно распространяет свое влияние на голубое пятно, а то, в свою очередь, посылает сигналы в кору больших полушарий, которая, как мы знаем, руководит направленным вниманием. От эффективности работы коры зависит и производительность человека.
Как показывает практика, механизмы смены сна и бодрствования можно объяснить даже детям — «„Проснись!“ — „Усни…“ — „Проснись!“ — „Усни…“ — „Проснись!“» [1]. — Ред.
У дрозофил нашли подобие «гена сна», что описано в статье «Бессонные ночи дрозофилы» [2]. Чисто теоретически это может привести к тому, что потребностью во сне можно будет управлять, но вряд ли мы это когда-то увидим. — Ред.
Есть предположение, что изначально (много миллионов лет назад) циркадные ритмы помогали организмам не умирать от кислорода, которого в тот момент в атмосфере стало аномально много для тогдашних обитателей планеты — «Прообраз биологических часов» [3]. — Ред.
Рисунок 1. Влияние супрахиазматического ядра гипоталамуса на работу различных клеток организма. Функционирование клеток всех типов тканей подчиняется центральному ритму, который задаёт супрахиазматическое ядро гипоталамуса. Оно «следит» за тем, чтобы сигналы от нервной и эндокринной систем приходили к клеткам в одно и то же время — фактически, синхронизирует их. Кстати, то же можно сделать и вне организма: выращивая в культурах несколько образцов различных тканей человека, можно эти культуры синхронизировать, если имитировать сигналы SCN. Такая синхронизация активности культур различных типов клеток одного и того же человека представлена на графиках.
В ходе исследований посмертных срезов мозга здоровых пожилых людей выяснилось, что с возрастом нейроны SCN дегенерируют. Изменяется и структура LC. Кроме того, активность лобных долей коры значительно падает с возрастом (и степень снижения этой активности напрямую отражается на интеллекте), что показано в исследованиях фМРТ [4]. Всё это приводит к тому, что со временем у людей исчезают острые пики активности при бодрствовании. То есть пожилые, конечно, бодрствуют, но внимательность и скорость мышления у них не так хороши, как раньше. Вероятно, причина этого — постепенное ухудшение работы мозговых регуляторов сна и бодрствования.
У пожилых по сравнению с молодыми эффективность сна снижена. С этим может быть связана старческая сонливость, возникающая даже тогда, когда человек определённо выспался. Судя по всему, возрастное падение качества сна не вызвано какими-то конкретными патологиями, это просто часть обычного процесса старения. Впрочем, так ли неизбежно само старение, вопрос.
Кроме того, старые хуже переносят вынужденный пропуск сна. Это показали эксперименты, в ходе которых 12 мужчин возрастом 21–31 год и 11 мужчин возрастом 61–70 лет не спали 40 часов (рис. 2). У пожилых субъективное ощущение сонливости было сильнее, чем у молодых, да и внимание из-за недосыпа падало заметнее [5].
Другой эксперимент с такой же длительностью провели в 2005 году [6]. Его результаты тоже представлены на рисунке 2 (закрашенные серым области). В нём двум группам участников-мужчин (опять пожилым и молодым) нужно было в течение 40 часов то спать по 75 минут, то бодрствовать по 150 минут, притом делать это по расписанию. Такой искусственный режим должен был выявить, насколько сон у людей одной возрастной группы более эффективен, чем у испытуемых из другой группы. Нетрудно догадаться, что молодые во время эксперимента и после него чувствовали себя лучше, чем пожилые, потому что лучше высыпались.
Рисунок 2. Субъективное восприятие качества сна и бодрствования у молодых и пожилых мужчин во время 40-часового эксперимента по лишению сна [5], а также эффективность сна во время эксперимента с множеством эпизодов сна [6]. Пожилые раньше начинают чувствовать сонливость, и субъективно она проявляется сильнее (тёмно-серая линия). Молодые более устойчивы к депривации сна (светло-серая линия). Кроме того, субъективно сон молодых (светло-серые закрашенные области) более эффективен, чем сон пожилых (тёмно-серые закрашенные области).
[4], рисунок адаптирован
«Гены циркадных ритмов» и старение
Работа любого органа — это, в конечном счёте, работа его генов. Наши «внутренние часы» — не исключение. В супрахиазматическом ядре экспрессируется ряд генов, малоактивных в других частях мозга и тела вообще. Среди таких генов BMAL1 (он же MOP3 и ARNT3), CLOCK и NPAS2 [7], [8]. Эти гены были выявлены в исследованиях с помощью нокаутных мышей — таких, которым методами генной инженерии нарушили работу одного или нескольких генов.
Как правило, продолжительность жизни у грызунов с одним или несколькими выключенными «генами периодичности» снижена. В частности, мыши с неработающим BMAL1 живут меньше своих собратьев. Под конец жизни у них проявляются все характерные признаки старения: их органы уменьшаются в размерах, теряется мышечная масса и подкожный жир, развивается старческая катаракта, повышается содержание активных форм кислорода в тканях [9]. При постоянной нехватке белков BMAL1 и CLOCK ухудшается память, снижается интеллект: животные хуже обучаются и быстрее забывают новую информацию [10].
BMAL1 и CLOCK действуют по-разному: если «выключить» работу гена CLOCK, не затрагивая BMAL1, жизнь мышей претерпевает менее глобальные изменения. Средний срок жизни грызунов без CLOCK на 15% короче, чем у животных дикого типа, а преждевременное старение проявляется у них только в изменении структуры кожи и развитии катаракты [11].
Изменения, описанные выше, происходят на уровне отдельных органов. Но ведь органы состоят из клеток, и настоящий экшен всегда в первую очередь разворачивается там. Поэтому имеет смысл посмотреть на то, что делают «гены циркадных ритмов» на клеточном уровне . Большинство их эффектов можно причислить к одной из нескольких категорий (рис. 3).
Вот один из примеров связи циркадных ритмов с обменом веществ в целом: «Найдена связь между обменом веществ и циркадным ритмом» [12].
Рисунок 3. Примеры проявлений старения на клеточном уровне. Подробное объяснение этих проявлений дано ниже в тексте в виде нумерованного списка.
- Изменение клеточного цикла. Клеточный цикл — чередование стадий роста и деления клетки. Разные типы клеток делятся с неодинаковой частотой, и эта частота не случайна. Распорядок жизни клеток подчиняется циркадным ритмам. Если последние по какой-то причине (например, из-за ненормированного рабочего дня или в результате старения) сбиваются, вероятность несвоевременного деления клеток возрастает, а с ней растёт и вероятность образования опухолей [13]. Биохимические процессы, контролирующие смену стадий клеточного цикла, зависят от ферментативных реакций, обеспечивающих проявление циркадных ритмов. Поэтому если будут нарушены последние, то пострадают и первые. Например, клетка может начать делиться, хотя ей уже не стоит это делать. А ведь бесконтрольное деление — признак раковой клетки.
- Нестабильность генома. Непостоянный состав ДНК в клетке ничего хорошего не сулит. Нестабильность генома означает повышенное число мутаций и повышенную вероятность злокачественного перерождения клетки. Конечно, существует ряд механизмов, которые геномной нестабильности противостоят. Это, например, действие белка SIRT6 [9] (по роду деятельности это NAD-зависимая деацетилаза). Он руководит в том числе работой белков BMAL1 и CLOCK [10]. В свою очередь, изменения их активности оказывают прямое воздействие на SIRT6, а значит, и на стабильность генома.
Мыши с недостатком SIRT6 умирают очень быстро — в возрасте четырёх недель. Выглядят они при этом неважно: теряют мышечную массу, их спинки горбятся, число лимфоцитов в крови снижается, а вместе с этим ухудшается иммунитет. Вновь мы видим признаки, характерные для старых животных. - Снижение активности теломераз. Теломеразы — это ферменты, которые не дают укорачиваться теломерам — бессмысленным фрагментам ДНК, находящимся на концах хромосом и защищающим «осмысленные» гены ближе к центру этих хромосом от исчезновения. Перед тем как клетке приходит пора поделиться, её хромосомы должны удвоиться. Но из-за особенностей механизма такого удвоения хромосомы каждый раз немного укорачиваются на концах. До поры до времени их гены от повреждения защищают теломеры. Приблизительно после 50 делений теломеры сокращаются настолько, что фактически исчезают. После этого начинается повреждение генов, а с ним мутации клеток и их старение.
Активность комплексов теломераз и их составляющих, в частности белка под названием TERT, зависит от циркадных ритмов. Экспрессия мРНК теломеразного комплекса напрямую регулируется белками CLOCK и BMAL (они соединяются в единую молекулу, называемую гетеродимером) [14]. Видимо, поэтому мыши с дефицитом белка CLOCK имеют более короткие теломеры и, как следствие, более короткую продолжительность жизни: у них хуже работают теломеразы. - Эпигенетические модификации различных генов. Важен не только состав генов, но и то, где, когда и насколько интенсивно образуются кодируемые ими белки. Чтобы сделать ген более или менее доступным для транскрипции (считывания информации, то есть её перевода в форму РНК), нужно либо метилировать его, либо деацетилировать гистоны вокруг него. Как правило, метилирование подавляет экспрессию гена (т.е. кодируемых этим геном белков в итоге вырабатывается меньше), а деацетилирование гистонов, наоборот, усиливает (ДНК намотана вокруг гистонов, и когда плотность этой «обмотки» ослабевает, становится проще считывать последовательность нуклеотидов). Деацетилаза гистонов SIRT1 усиливает экспрессию генов BMAL1 и CLOCK. А они, как мы помним, участвуют в регуляции циркадных ритмов. Их активность с возрастом снижается. Возможно, это даёт обратную связь SIRT1, в результате чего меняется и его экспрессия. Итог: с возрастом изменяется доступность многих генов, а это не может не сказаться на функциях организма [15].
- Потеря протеостаза. Постоянство внутренней среды организма (гомеостаз) — один из признаков того, что этот организм ещё жив. Внутренняя среда включает в себя и белки тоже. Каждый белок должен присутствовать в некой определённой концентрации, а его молекулы должны быть «свёрнуты» определённым образом. Идеальное состояние белков в теле называется протеостаз.
С возрастом способность клеток обезвреживать чужеродные вещества и продукты обмена и нейтрализовать последствия неправильной укладки белков снижается. Часть процессов детоксикации, которые проходят в клетках печени, регулируется циркадными транскрипционными факторами (контролёрами синтеза РНК) PAR-bZip [16]. То есть с возрастом, когда нарушаются циркадные ритмы, снижается и способность к протеостазу, потому что её контролируют циркадные транскрипционные факторы. - Распознавание питательных веществ. Понять, есть ли в окружении клетки что-то пригодное в пищу, помогает метаболический путь TOR (target of rapamycin). Биохимические реакции в составе этого пути идут слишком интенсивно при диабете и других нарушениях метаболизма, а также… да, вы догадались: у мышей, лишённых гена BMAL1. Продолжительность их жизни снижена, но её можно повысить на 50%, вводя ингибитор пути TOR — рапамицин [17].
- Работа митохондрий. В митохондриях постоянно проходят реакции окисления и восстановления, и именно они служат основным источником энергии для большинства клеток. Одну из главных ролей в этих процессах играет метаболический путь NAD+. Его работа напрямую зависит от циркадных ритмов. В частности, у мышей, лишённых гена BMAL1, энергетический обмен в митохондриях нарушен [18].
- Истощение пула стволовых клеток. Циркадные ритмы поддерживают баланс самообновления множества стволовых клеток. Они же регулируют, будут ли стволовые клетки дифференцироваться в другие типы клеток. Баланс этот весьма важен. Если стволовые клетки дают начало себе подобным слишком редко, организм медленно восстанавливается после повреждений. Если же стволовые клетки делятся очень часто, их способности могут преждевременно исчерпаться. Ткани различных органов перестанут эффективно обновляться, и тогда старение проявит себя.
Интересно, что работа разных генов воздействует на деление стволовых клеток неодинаково. У мышей, лишённых гена BMAL1, увеличено число покоящихся стволовых клеток (плюс рано начинается старение эпидермиса), а у мышей, лишённых генов Period1/Period2, наоборот: количество неделящихся стволовых клеток снижено [19]. - Межклеточная коммуникация. Надо признать, что в этой области известно ещё немного. Правда, уже сейчас из экспериментов с очень старыми мышами ясно, что с возрастом синхронизация работы нейронов супрахиазматического ядра нарушается. Нарушение происходит на уровне нервных контактов [20]. Клетки не могут работать согласованно, потому что теряют способность передавать или воспринимать сигналы своих соседей (а может, и то, и другое). Поскольку речь идёт о «центре сна», то понятно, почему сон ухудшается в старости: нейроны SCN просто больше не могут между собой договориться.
- Солевой обмен и артериальное давление. Мыши, у которых отсутствует ген Cry2 (криптохром-2), имеют аномально высокое артериальное давление. Оно особенно сильно зависит от содержания соли в организме, т.к. у таких грызунов вырабатываются огромные количества альдостерона — гормона, вызывающего задержку воды и ионов натрия в жидкостях организма [21]. Это бы не имело значения для повествования о сне, если бы не тот факт, что Cry2 — ген, влияющий на циркадные ритмы [22].
Исследования обычно проводятся на больших группах животных, и данные по этим животным усредняются. Но мы-то помним, что каждый организм имеет свой уникальный геном, и от того, как гены в его составе взаимодействуют между собой, зависит очень многое. У двух мышей может быть нарушена работа одного и того же CLOCK, но на уровне отдельных органов и организма в целом это нарушение проявится у них совершенно по-разному. Да даже если с вариантами генов всё в порядке, два организма не будут стариться одинаково. Дело в том, что роль в силе и характере изменений сна с возрастом играет и генотип конкретного организма. Это было подтверждено исследованиями на мышах [23], [24], в которых качество сна грызунов оценивали по элетроэнцефалограммам, а также смотрели, как с возрастом у этих грызунов ухудшается зрение.
Лабораторные мыши бывают нескольких линий (это понятие довольно близко по смыслу к термину «порода»), притом каждая линия имеет своё обозначение из цифр и букв . Грызуны одной линии появились на свет в результате скрещиваний близких родственников. Они похожи друг на друга как внешне, так и внутренне — и по генотипу, и по фенотипу. Чаще всего используют мышей линий C57BL/6, DBA/2J, AKR/J и некоторых других.
Для крыс это тоже верно: «Грызун особого назначения» [25].
У грызунов линии C57BL/6 чаще других с возрастом развивается катаракта, а значит, почти пропадает зрение. Видимо, поэтому под старость (в возрасте примерно год) эти сумеречные животные всё более активны в светлое время суток и всё менее активны в темноте. Кроме того, пожилые C57BL/6 бодрствуют дольше остальных, а AKR/J дольше всех спят. Больше всего времени в стадии REM-сна проводят мыши линии DBA/2J, а меньше всего — AKR/J. Если годовалым мышам этих трёх линий некоторое время мешать спать, а потом дать им возможность выспаться, то быстрее всех к своему обычному режиму возвращаются грызуны C57BL/6.
Мы выяснили, как нарушение работы «генов циркадных ритмов» влияет на состояние отдельных клеток. А как на них действует нарушения сна, столь частые в преклонном возрасте?
Хотя сон считается временем покоя, во время сна очищение нейронов от «отработанных» продуктов обмена веществ происходит быстрее, чем при бодрствовании [26]. Кстати, ночью очищается не только нервная система. Во время сна также усиливается или ослабевает экспрессия ряда генов. В тканях лёгких экспрессия 3% генов различается во сне и при бодрствовании. В тканях сердца таких «сон-зависимых» генов 6%. Во время сна содержание маркеров клеточного стресса в тканях лёгких, сердца и мозга снижено [27].
Возможно, одна из функций сна — избавление организма от отработанных метаболитов и общее восстановление клеток после стресса. Если это предположение окажется верным, оно сможет объяснить некоторые факты. Например, известно, что независимо от национальности у женщин 46–57 лет, имеющих частые жалобы на качество сна, особенно высок риск метаболического синдрома [28]. Впрочем, последнее может быть связано с тем, что в дополнительные часы бодрствования эти женщины едят [29]. А значит, они потребляют больше калорий в сутки, чем женщины без проблем со сном. В пользу этой гипотезы свидетельствует то, что экспериментальное нарушение сна не вызывало у крыс метаболического синдрома [30].
По данным эпидемиологических исследований, депривация (ограничение времени) сна повышает вероятность дислипидемии, диабета 2 типа и нетолерантности к глюкозе (таб. 1).
| Первый автор статьи, ссылка | Год | Число участников | Продолжительность исследования | Результаты |
|---|---|---|---|---|
| Chaput et al. [32] | 2007 | 740 | 3 года | Регулярный сон длительностью менее 6 часов вызывает нарушение толерантности к глюкозе. |
| Mallon et al. [33] | 2005 | 2663 | 12 лет | У мужчин частые пробуждения и короткий сон связаны с повышенной вероятностью диабета. |
| Nilsson et al. [34] | 2004 | 6599 | 14,8 ± 2,4 года | Нарушения сна повышают риск развития диабета. |
| Tuomilehto et al. [35] | 2008 | 2800 | 2 года | Слишком короткий (≤6 ч) или слишком длинный (≥8ч) сон повышают вероятность развития диабета 2 типа у женщин среднего возраста. У мужчин аналогичного эффекта не нашли. |
| Meisinger et al. [36] | 2005 | 8300 | 11 лет | У людей обоих полов сложности с поддержанием сна (частые просыпания и т.п.) повышают риск развития диабета 2 типа. |
| Hayashino et al. [37] | 2007 | 6509 | 6 лет | У взрослых без серьёзных проблем со здоровьем нарушения засыпания связаны с повышенным риском диабета. |
| Kawakami et al. [38] | 2004 | 2649 | 8 лет | Нарушения сна связаны с повышением риска диабета в 2-3 раза. |
| Choi et al. [39] | 2008 | 4222 | 1 год | И слишком короткий, и слишком длинный сон ассоциируются с повышенным риском метаболического синдрома. |
| Gangwisch et al. [40] | 2007 | 8992 | 10 лет | Кратковременный сон может быть важным фактором риска диабета. |
| Xu et al. [41] | 2010 | 10143 | 10 лет | Короткий ночной сон и частый дневной сон связаны с проявлением диабета. |
| Rafalson et al. [42] | 2010 | 1455 | 6 лет | Короткий ночной сон связан с нарушением содержания глюкозы в крови натощак, вызванным резистентностью к инсулину. |
| Yaggi et al. [43] | 2006 | 1709 | 18 лет | И слишком короткий, и слишком длинный сон повышают риск развития диабета. |
| Hall et al. [44] | 2008 | 1214 | Одномоментное исследование | Продолжительность сна связана со степенью риска метаболического синдрома. |
| Facco et al. [45] | 2010 | 189 | В течение беременности | Малая продолжительность сна связана с нарушением толерантности к глюкозе во время беременности. |
| Qui et al. [46] | 2010 | 1290 | В течение беременности | Гестационный диабет (диабет беременных) и нарушение толерантности к глюкозе чаще развиваются у тех, кто мало спит. |
Помимо нарушений метаболизма, ошибок репликации и повышенным по сравнению с нормой процентом гибнущих клеток [30], депривация сна может повлечь за собой негативные последствия для иммунной системы. У пациентов с постоянным недосыпом днём в крови повышается содержание маркеров воспаления — фактора некроза опухолей (TNF), интерлейкинов 1 и 6, а также кортизола [31], [47]. А ведь воспаление идёт рука об руку с повышенным риском множества заболеваний, начиная от инсульта и заканчивая болезнью Альцгеймера. Например, при последней клетки микроглии (это макрофаги в мозге) выделяют заметные количества интерлейкинов 12 и 23 — одних из важнейших сигналов воспаления. В норме этого, разумеется, не происходит, ведь ни болезни Альцгеймера, ни воспаления нет. Судя по всему, команду микроглии вырабатывать факторы воспаления даёт сам бета-амилоид. Далее, при болезни Альцгеймера астроциты (разновидность глиальных клеток, питают и поддерживают нейроны, направляют их рост у зародышей) становятся восприимчивыми к IL-12 и IL-23 (опять же, в норме такого не наблюдается.) Отложения бета-амилоида увеличиваются в размерах, клеток астроглии становится всё больше, а нейронов рядом с ними — всё меньше [48]. Если снизить выработку IL-12 и IL-23 в клетках глии, патология замедлит своё развитие.
Во взаимосвязях воспаления, выделения интерлейкинов и работы астроцитов при болезни Альцгеймера ещё предстоит разобраться, но уже сейчас ясно, что такие взаимосвязи существуют. На самом деле, подобных корреляций выявили уже немало. А о связи нарушений сна и различных заболеваний (нервных, и не только) будет отдельная статья.
Литература
- «Проснись!» — «Усни…» — «Проснись!» — «Усни…» — «Проснись!»;
- Бессонные ночи дрозофилы;
- Прообраз биологических часов;
- Schmidt C., Peigneux P., Cajochen C. (2012). Age-related changes in sleep and circadian rhythms: impact on cognitive performance and underlying neuroanatomical networks. Front. Neurol. 3, 118;
- Adam M., Rétey J.V., Khatami R., Landolt H.P. (2006). Age-related changes in the time course of vigilant attention during 40 hours without sleep in men. Sleep. 29, 55–57;
- Mirjam Münch, Vera Knoblauch, Katharina Blatter, Carmen Schröder, Corina Schnitzler, et. al.. (2005). Age-related attenuation of the evening circadian arousal signal in humans. Neurobiology of Aging. 26, 1307-1319;
- Fonseca Costa S.S. and Ripperger J.A. (2015). Impact of the circadian clock on the aging process. Front. Neurol. 6, 43;
- Elizabeth A. Yu, David R. Weaver. (2011). Disrupting the circadian clock: Gene-specific effects on aging, cancer, and other phenotypes. aging. 3, 479-493;
- Raul Mostoslavsky, Katrin F. Chua, David B. Lombard, Wendy W. Pang, Miriam R. Fischer, et. al.. (2006). Genomic Instability and Aging-like Phenotype in the Absence of Mammalian SIRT6. Cell. 124, 315-329;
- Selma Masri, Paul Rigor, Marlene Cervantes, Nicholas Ceglia, Carlos Sebastian, et. al.. (2014). Partitioning Circadian Transcription by SIRT6 Leads to Segregated Control of Cellular Metabolism. Cell. 158, 659-672;
- Wei-Dar Chen, Ming-Shien Wen, Shian-Sen Shie, Yu-Lun Lo, Hung-Ta Wo, et. al.. (2014). The circadian rhythm controls telomeres and telomerase activity. Biochemical and Biophysical Research Communications. 451, 408-414;
- Найдена связь между обменом веществ и циркадным ритмом;
- Feillet C., van der Horst G.T., Levi F., Rand D.A., Delaunay F. (2015). Coupling between the circadian clock and cell cycle oscillators: implication for healthy cells and malignant growth. Front. Neurol. 6, 1–7;
- Yuliya V. Dubrovsky, William E. Samsa, Roman V. Kondratov. (2010). Deficiency of circadian protein CLOCK reduces lifespan and increases age-related cataract development in mice. aging. 2, 936-944;
- Gad Asher, David Gatfield, Markus Stratmann, Hans Reinke, Charna Dibner, et. al.. (2008). SIRT1 Regulates Circadian Clock Gene Expression through PER2 Deacetylation. Cell. 134, 317-328;
- Frédéric Gachon, Fabienne Fleury Olela, Olivier Schaad, Patrick Descombes, Ueli Schibler. (2006). The circadian PAR-domain basic leucine zipper transcription factors DBP, TEF, and HLF modulate basal and inducible xenobiotic detoxification. Cell Metabolism. 4, 25-36;
- Rohini V. Khapre, Anna A. Kondratova, Sonal Patel, Yuliya Dubrovsky, Michelle Wrobel, et. al.. (2014). BMAL1-dependent regulation of the mTOR signaling pathway delays aging. aging. 6, 48-57;
- K. M. Ramsey, J. Yoshino, C. S. Brace, D. Abrassart, Y. Kobayashi, et. al.. (2009). Circadian Clock Feedback Cycle Through NAMPT-Mediated NAD+ Biosynthesis. Science. 324, 651-654;
- S. A. Brown. (2014). Circadian clock-mediated control of stem cell division and differentiation: beyond night and day. Development. 141, 3105-3111;
- S. Farajnia, S. Michel, T. Deboer, H. T. vanderLeest, T. Houben, et. al.. (2012). Evidence for Neuronal Desynchrony in the Aged Suprachiasmatic Nucleus Clock. Journal of Neuroscience. 32, 5891-5899;
- Masao Doi, Yukari Takahashi, Rie Komatsu, Fumiyoshi Yamazaki, Hiroyuki Yamada, et. al.. (2010). Salt-sensitive hypertension in circadian clock–deficient Cry-null mice involves dysregulated adrenal Hsd3b6. Nat Med. 16, 67-74;
- Kristin Eckel-Mahan, Paolo Sassone-Corsi. (2010). Blood Pressure AsSAuLTed by the Circadian Clock. Cell Metabolism. 11, 97-99;
- Sibah Hasan, Yves Dauvilliers, Valérie Mongrain, Paul Franken, Mehdi Tafti. (2012). Age-related changes in sleep in inbred mice are genotype dependent. Neurobiology of Aging. 33, 195.e13-195.e26;
- Gareth Banks, Ines Heise, Becky Starbuck, Tamzin Osborne, Laura Wisby, et. al.. (2015). Genetic background influences age-related decline in visual and nonvisual retinal responses, circadian rhythms, and sleep. Neurobiology of Aging. 36, 380-393;
- Грызун особого назначения;
- L. Xie, H. Kang, Q. Xu, M. J. Chen, Y. Liao, et. al.. (2013). Sleep Drives Metabolite Clearance from the Adult Brain. Science. 342, 373-377;
- Ron C Anafi, Renata Pellegrino, Keith R Shockley, Micah Romer, Sergio Tufik, Allan I Pack. (2013). Sleep is not just for the brain: transcriptional responses to sleep in peripheral tissues. BMC Genomics. 14, 362;
- Hall M.H., Okun M.L., Sowers M., Matthews K.A., Kravitz H.M., Hardin K. et al. (2012). Sleep is associated with the metabolic syndrome in a multi-ethnic cohort of midlife women: the SWAN Sleep Study. Sleep. 35, 783–790;
- Найдена связь между обменом веществ и циркадным ритмом;
- Vetrivelan R., Fuller P.M., Yokota S., Lu J., Saper C.B. (2012). Metabolic effects of chronic sleep restriction in rats. Sleep. 35, 1511–1520;
- Laila AlDabal. (2011). Metabolic, Endocrine, and Immune Consequences of Sleep Deprivation. TORMJ. 5, 31-43;
- J.-P. Chaput, J.-P. Després, C. Bouchard, A. Tremblay. (2007). Association of sleep duration with type 2 diabetes and impaired glucose tolerance. Diabetologia. 50, 2298-2304;
- L. Mallon, J.-E. Broman, J. Hetta. (2005). High Incidence of Diabetes in Men With Sleep Complaints or Short Sleep Duration: A 12-year follow-up study of a middle-aged population. Diabetes Care. 28, 2762-2767;
- P. M. Nilsson, M. Roost, G. Engstrom, B. Hedblad, G. Berglund. (2004). Incidence of Diabetes in Middle-Aged Men Is Related to Sleep Disturbances. Diabetes Care. 27, 2464-2469;
- Henri Tuomilehto, Markku Peltonen, Markku Partinen, Juha Seppä, Timo Saaristo, et. al.. (2008). Sleep duration is associated with an increased risk for the prevalence of type 2 diabetes in middle-aged women – The FIN-D2D survey. Sleep Medicine. 9, 221-227;
- Meisinger C., Heier M., Loewel H.; MONICA/KORA Augsburg Cohort Study. (2005). Sleep disturbance as a predictor of type 2 diabetes mellitus in men and women from the general population. Diabetologia. 48, 235–241;
- Hayashino Y., Fukuhara S., Suzukamo Y., Okamura T., Tanaka T., Ueshima H.; HIPOP-OHP Research group. (2007). Relation between sleep quality and quantity, quality of life, and risk of developing diabetes in healthy workers in Japan: the High-risk and Population Strategy for Occupational Health Promotion (HIPOP-OHP) Study. BMC Public Health. 7, 129;
- N. Kawakami, N. Takatsuka, H. Shimizu. (2004). Sleep Disturbance and Onset of Type 2 Diabetes. Diabetes Care. 27, 282-283;
- K M Choi, J S Lee, H S Park, S H Baik, D S Choi, S M Kim. (2008). Relationship between sleep duration and the metabolic syndrome: Korean National Health and Nutrition Survey 2001. Int J Obes Relat Metab Disord. 32, 1091-1097;
- Gangwisch J.E., Heymsfield S.B., Boden-Albala B., Buijs R.M., Kreier F., Pickering T.G. et al. (2007). Sleep duration as a risk factor for diabetes incidence in a large U.S. sample. Sleep. 30, 1667–1673;
- Q. Xu, Y. Song, A. Hollenbeck, A. Blair, A. Schatzkin, H. Chen. (2010). Day Napping and Short Night Sleeping Are Associated With Higher Risk of Diabetes in Older Adults. Diabetes Care. 33, 78-83;
- Lisa Rafalson, Richard P. Donahue, Saverio Stranges, Michael J. Lamonte, Jacek Dmochowski, et. al.. (2010). Short Sleep Duration is Associated with the Development of Impaired Fasting Glucose: The Western New York Health Study. Annals of Epidemiology. 20, 883-889;
- H. K. Yaggi, A. B. Araujo, J. B. McKinlay. (2006). Sleep Duration as a Risk Factor for the Development of Type 2 Diabetes. Diabetes Care. 29, 657-661;
- Hall M.H., Muldoon M.F., Jennings J.R., Buysse D.J., Flory J.D., Manuck S.B. (2008). Self-reported sleep duration is associated with the metabolic syndrome in midlife adults. Sleep. 31, 635–643;
- Francesca L. Facco, Jamie Kramer, Kim H. Ho, Phyllis C. Zee, William A. Grobman. (2010). Sleep Disturbances in Pregnancy. Obstetrics & Gynecology. 115, 77-83;
- Qiu C., Enquobahrie D., Frederick I.O., Abetew D., Williams M.A. (2010). Glucose intolerance and gestational diabetes risk in relation to sleep duration and snoring during pregnancy: a pilot study. BMC Womens Health. 10, 17;
- Luciana Besedovsky, Tanja Lange, Jan Born. (2012). Sleep and immune function. Pflugers Arch — Eur J Physiol. 463, 121-137;
- Frank L. Heppner, Richard M. Ransohoff, Burkhard Becher. (2015). Immune attack: the role of inflammation in Alzheimer disease. Nat Rev Neurosci. 16, 358-372.
Расшифровка показателей ЭЭГ головного мозга
ЭЭГ (электроэнцефалография) головного мозга – высокоинформативный метод диагностики состояния центральной нервной системы, основанный на регистрации биоэлектрических потенциалов коры головного мозга в процессе его жизнедеятельности. Результаты исследования записываются на бумажную ленту или выводятся на монитор компьютера. Расшифровку результатов ЭЭГ головного мозга у взрослых нейрофизиологи Юсуповской больницы проводят с помощью компьютерной программы.
Заключение пациент получает на второй день. Если результаты расшифровки ЭЭГ трактуются неоднозначно, их обсуждают на заседании экспертного совета с участием профессоров и врачей высшей категории.
Записаться на консультацию
Показания к ЭЭГ исследованию
Если по результатам ЭЭГ исследования пациент не нуждается в медикаментозной коррекции, неврологи наблюдают его в динамике, выполняют повторные исследования, проводят ЭЭГ видео мониторинг дневного и ночного сна, применяют другие методы нейровизуализации.
Электроэнцефалограмма предоставляет возможность:
|
оценить характер и степень нарушения работы мозга |
установить сторону и расположение патологического очага |
|
изучить смену сна и бодрствования |
уточнить результаты других видов диагностики (компьютерной томографии), когда у пациента есть признаки поражения центральной нервной системы, а другие методы исследования не выявляют структурного дефекта |
|
провести мониторинг эффективности действия лекарственных препаратов |
определить, в каких участках головного мозга начинаются эпилептические приступы |
|
оценить, как работает мозг между судорогами |
установить причины обмороков, панических атак кризов |
ЭЭГ проводят при наличии следующих показаний:
- эпилепсия;
- бессонница, нарушение качества сна;
- расстройство сна (хождение, говорение во сне);
- ночное апноэ сна;
- судороги без установленной причины;
- эндокринные заболевания;
- сосудистая патология головного мозга;
- черепно-мозговые травмы;
- воспалительные заболевания центральной нервной системы.
При частых головных болях, вегетососудистой дистонии, головокружениях также проводится ЭЭГ. Исследование показано пациентам, которые постоянно ощущают усталость, перенесли инсульт или микроинсульт, нейрохирургическое оперативное вмешательство.
Противопоказания и подготовка к ЭЭГ
Абсолютных противопоказаний для выполнения электроэнцефалографии нет. Если у пациента имеются приступы судорог, он болен ишемической болезнью сердца, артериальной гипертензией, страдает психическими расстройствами, во время процедуры ЭЭГ в клинике неврологии Юсуповской больницы присутствует врач-анестезиолог. Он оказывает неотложную помощь в случае нестандартных ситуаций.
За 2 часа до процедуры нужно покушать. ЭЭГ проводится в спокойном состоянии, поэтому переживать и нервничать при проведении исследования нельзя. Если врачу нужно выявить судорожную активность мозга, он предложит пациенту немного поспать перед исследованием. До лечебного учреждения не рекомендуется добираться, будучи за рулём. ЭЭГ не проводится пациентам с признаками острой респираторно-вирусной инфекции. Исследование не противопоказано детям и беременным женщинам. В период беременности ЭЭГ выполняется без функциональных проб.

Норма ЭЭГ у взрослых
Расшифровка результатов ЭЭГ состоит из трёх разделов:
- описание ведущих видов активности и графических элементов;
- заключение после описания с интерпретированными патофизиологическими материалами;
- корреляция показателей двух первых частей с клинической картиной заболевания.
Основным описательным термином в ЭЭГ является «активность». Он оценивает любую очерёдность волн. Основными видами активности, которые записываются в ходе исследования и впоследствии подвергают расшифровке, а также дальнейшему изучению, являются частота, амплитуда и фаза волн. Частота оценивается количеством волновых колебаний за секунду. Она выражается в единицах измерения – герцах (Гц). В описании нейрофизиолог указывает среднюю частоту изучаемой активности.
На ЭЭГ определяют основные ритмы мозга:
- дельта – от 0,3 до 4 Гц;
- тета – от 4 до 8 Гц;
- альфа – от 8 до 13 Гц;
- низкочастотный бета ритм – от 13 до 25 Гц;
- высокочастотный бета ритм – от 25 до 35Гц;
- бета – от 35 до 50Гц.
Ритмам соответствуют виды активности. На ЭЭГ можно увидеть особые виды биоэлектрической активности мозга:
- плоскую ЭЭГ;
- высокочастотную асинхронную низкоамплитудную («махристую») активность;
- низкоамплитудную медленную полиморфную активность;
- полиритмичную активность.
К патологическим образам электроэнцефалограммы относятся:
- спайк;
- медленный спайк;
- пик;
- острая волна.
В норме альфа-ритм преобладает в затылочных отделах мозга. Он убывает по амплитуде от затылка ко лбу. В лобных отделах не регистрируется при биполярном отведении с электродов, которые наложены по сагиттальным линиям с малыми межэлектродными расстояниями. Симметричен по амплитуде и частоте в левом и правом полушариях. На нормальной ЭЭГ наблюдается функциональная асимметрия с преобладанием по заполнению поверхности, обращённой к костям черепа, и незначительным превышением амплитуды больше в правом полушарии головного мозга. Это следствие функциональной асимметрии мозга. Она связана с большей активностью левого полушария.

Патологически изменённая мозга
Патологическими проявлениями на ЭЭГ являются медленные ритмы – тета и дельта. Чем ниже их частота и выше амплитуда, тем более выражен патологический процесс. Медленноволновая активность появляется при следующих патологических процессах:
- дистрофических заболеваниях;
- демиелинизирующих и дегенеративных поражениях головного мозга;
- сдавлении мозговой ткани;
- ликворной гипертензии;
- наличии некоторой заторможенности, явлений деактивации, снижении активизирующих влияний ствола головного мозга.
Высокочастотные ритмы (бета-1, бета-2, гамма-ритм) также являются критерием патологии. Выраженность её тем больше, чем больше частота сдвинута в сторону высоких частот и чем больше увеличена амплитуда высокочастотного ритма. Высокочастотная компонента ЭЭГ возникает при ирритации структур головного мозга (раздражении мозговых центров).
Электрические ритмы головного мозга
Понятием «ритм» на ЭЭГ считается тип электрической активности, который относится к определённому состоянию мозга и координируется соответствующими механизмами. При расшифровке показателей ритма ЭЭГ головного мозга нейрофизиологи учитывают его частота, соответствующую состоянию участка мозга, амплитуду и характерные изменения при функциональных сменах активности.
Отдельная категория видов ритмов, проявляющихся в условиях сна или при патологических состояниях, включает в себя 3 разновидности данного показателя:
- дельта-ритм определяется у коматозных больных и в фазе глубокого сна, фиксируется при записи сигналов от областей коры мозга, расположенных на границе с поражёнными злокачественными новообразованиями участков;
- тета-ритм обладает интервалом частоты в пределах 4–8 Гц, проявляется при сне, отвечает за качественное усвоение информации, лежит в основе самообучения;
- сигма-ритм отличается частотой 10–16 Гц, считается одним из заметных и главных колебаний спонтанной электроэнцефалограммы, возникает при естественном сне на начальной его стадии.
По итогам, полученным при записи ЭЭГ, определяется показатель, который характеризует полную всеохватывающую оценку волн – биоэлектрическую активность мозга. Врач функциональной диагностики проверяет параметры ЭЭГ – частоту, ритмичность и присутствие резких вспышек, которые провоцируют характерные проявления. На этих основаниях нейрофизиолог делает окончательное заключение.
ЭЭГ мониторинг головного мозга у детей
Выделяют несколько методик записи ЭЭГ у детей:
- дневная ЭЭГ – первое исследование, которое заключается в кратковременной записи биопотенциалов головного мозга с выполнением функциональных проб (фотостимуляции и гипервентиляции для выявления скрытых изменений;
- ЭЭГ с депривацией (лишением сна) проводится при неинформативности рутинной ЭЭГ;
- длительная (продолженная) ЭЭГ с регистрацией дневного сна выполняется при подозрении на наличие пароксизмов или вероятности проявления изменений в ЭЭГ во время сна;
- ЭЭГ ночного сна позволяет фиксировать изменения на ЭЭГ во время бодрствования перед засыпанием, в состоянии дремоты, во время собственно ночного сна и пробуждения.
Проведение ЭЭГ мониторинга сопровождается видеофиксацией с возможностью записи в полной темноте и подключением дополнительных датчиков. Все используемые нейрофизиологами Юсуповской больницы приборы являются оборудованием экспертного класса и, согласно Федеральному Закону №102-ФЗ «Об обеспечении единства измерений», проходит регулярные поверки метрологических характеристик.
Для того чтобы подготовить ребёнка к ЭЭГ во время сна, врачи рекомендуют:
- в день исследования разбудить малыша на 1,5 — 2 часа раньше обычного времени пробуждения и в течение дня, не давая ему спать, играть с ним в активные игры;
- ограничить количество выпиваемой жидкости, употребление в пищу сладкого, солений и острых блюд;
- после 18.00 играть только в тихие спокойные игры;
- гулять на свежем воздухе в спокойном месте;
- исключить просмотр телевизора, компьютерные и видеоигры.
Исследование проводится в комнате, изолированной от световых и звуковых раздражителей. Запись производится на автономный блок, в котором находится карта памяти. Исследование синхронно записывается на жёсткий диск для проведения оценки, распечатки значимых фрагментов и записи отдельных фрагментов на мобильный носитель информации.
Остались вопросы? Мы вам перезвоним

Мы с радостью проконсультируем вас и ответим на все интересующие вопросы.
Перезвоните мне
Расшифровка показателей ЭЭГ у взрослого
Для того чтобы расшифровать ЭЭГ и предоставить точные результаты, не упустить никаких мельчайших проявлений на записи, нейрофизиологи учитывают все важные моменты, которые могут отразиться на исследуемых показателях, таких как:
- возраст пациента;
- наличие определённых заболеваний;
- возможные противопоказания.
По окончании сбора всех данных ЭЭГ и их обработки врач функциональной диагностики проводит анализ и формирует итоговое заключение, которое предоставляет для принятия дальнейшего решения по выбору метода терапии. Любое нарушение активностей может быть признаком заболеваний, обусловленных определёнными факторами.
Нарушениями ЭЭГ считается:
- постоянная фиксация альфа-ритма в лобной доле;
- постоянное нарушение волновой синусоидальности;
- присутствие частотного разброса;
- превышение разницы между полушариями до 35%;
- амплитуда ниже 25 мкВ и свыше 95 мкВ.
При выявлении высокой амплитуды дельта-ритма нейрофизиолог может предположить наличие объёмного образования головного мозга. Завышенные значения тета и дельта-ритма, которые регистрируются в затылочной области, свидетельствуют о нарушении функции кровообращения, заторможенности задержку в развитии ребёнка.

Расшифровка ЭЭГ головного мозга у детей
ЭЭГ у детей имеет особенности. Запись ЭЭГ недоношенного ребёнка, родившегося на 25–28 неделе гестации, выглядит кривой в виде медленных вспышек дельта и тета-ритмов, которые периодически сочетаются с острыми волновыми пиками длиной 3–15 секунд при снижении амплитуды до 25 мкВ. У доношенных новорожденных детей эти значения разделяются на 3 вида показателей:
- при бодрствовании (с периодической частотой 5 Гц и амплитудой 55–60 Гц);
- в активной фазе сна (при стабильной частоте 5–7 Гц и быстрой заниженной амплитудой);
- во время спокойного сна со вспышками дельта колебаний при высокой амплитуде.
На протяжении 3-6 месяцев жизни малыша количество тета-колебаний постоянно растёт. Для дельта-ритма характерен спад. С 7 месяцев до одного года у ребёнка формируются альфа-волны, а дельта и тета постепенно угасают.
На протяжении следующих 8 лет на ЭЭГ медленные волны постоянно заменяются быстрыми альфа и бета-колебаниями. До 15 лет в основном преобладают альфа-волны. К 18 годам формирование биологической активности мозга завершается. Для того чтобы пройти обследование и расшифровку результатов ЭЭГ, звоните по телефону Юсуповской больницы. Контакт центр работает каждый день круглосуточно. Нейрофизиологи анализируют ЭЭГ в динамике, сравнивают результаты исследования с нормой ЭЭГ.
Ночной видеомониторинг ЭЭГ
Видео ЭЭГ мониторинг является единственным объективным методом диагностики многих заболеваний центральной нервной системы. С помощью исследования неврологи определяют специфических нарушений в инициальной фазе записи ЭЭГ во время приступа. Система позволяет провести длительное обследование. На жёсткий диск синхронно записывается следующая информация:
- запись ЭЭГ на цифровом электроэнцефалографе;
- физиологические сигналы организма по полиграфическим каналам;
- аудиоинформация с двух микрофонов;
- видеоинформация от двух видеокамер;
- маркеры, отражающие те или иные события, которые врач отмечает в ходе записи.
ЭЭГ ночной мониторинг, стоимость которого в Москве от 1200 рублей, осуществляется в следующих случаях:
- при необходимости подтверждения диагноза эпилепсии;
- для уточнения формы эпилепсии и локализации эпилептических очагов;
- С целью подтверждения медикаментозной ремиссии эпилептической болезни и сдекватности проводимого противоэпилептического лечения;
- для решения вопроса об отмене противоэпилептической терапии;
- при пароксизмальных расстройствах сознания и пароксизмальных двигательных расстройствах;
- для уточнения причины однократного эпилептического приступа;
- с целью уточнения причины редких приступов (неправильно установленный диагноз, неполная компенсация);
- при рецидиве приступов на фоне постоянного приёма лекарственных препаратов.
Ночной ЭЭГ видеомониторинг выполняют при задержке речи неясного генеза, прогрессирующем снижении когнитивных функций, минимальной мозговой дисфункции. Исследование необходимо делать пациентам, страдающим аффективно–респираторными пароксизмами, фебрильными судорогами, нарушениями дневного и ночного сна. Показаниями для ночного видео ЭЭГ мониторинга являются:
- энурез, энкопрез (ночное недержание мочи и кала);
- беттолепсия (преходящие нарушения сознания, наступающие на пике приступа кашля);
- неэпилептические пароксизмы (ночные страхи, нарколепсия, снохождения);
- пароксизмы головокружения неясной природы, которые возникают без объективной симптоматики.
Видео ЭЭГ мониторинг (цена зависит от длительности процедуры) нейрофизиологи выполняют при миоклонии и сходных с ними состояниях: миоклонусе во сне, – вегетативном миоклонусе, опсоклонусе (синдроме танцующих глаз), доброкачественном инфантильном миоклонусе.
ЭЭГ в Юсуповской больнице
ЭЭГ в Юсуповской больнице проводится с помощью современной диагностической аппаратуры в соответствии с международным протоколом. Это гарантирует соблюдение мировых стандартов качества. Анализ ЭЭГ и расшифровку результатов исследования с использованием компьютерной программы проводят кандидаты медицинских наук, неврологи-нейрофизиологи. Если результаты ЭЭГ трактуются неоднозначно, их обсуждают на заседании экспертного совета с участием профессоров и врачей высшей категории.
Для лечения пациентов в клинике неврологии созданы все условия:
- Палаты европейского уровня комфорта;
- Обеспечение индивидуальными средствами личной гигиены и диетическим питанием;
- Вежливое обслуживание персоналом, имеющим высокий уровень профессиональной подготовки.
Благодаря наличию современных электроэнцефалографов, специально оборудованной лаборатории, врачи функциональной диагностики выполняют все виды процедур:
- «Рутинную» ЭЭГ;
- Дневной и ночной мониторинг;
- Суточное исследование.
Длительное ЭЭГ исследование проводится в течение 1-2 суток. Пациенты в это время находятся в палатах повышенной комфортности. Их обеспечивают индивидуальными средствами личной гигиены и питанием, качество которого не отличается от домашней кухни. Персонал внимательно относится к пожеланиям пациентов.

Заведующий отделением неврологии, врач-невролог, к.м.н.
Список литературы
- МКБ-10 (Международная классификация болезней)
- Юсуповская больница
- «Диагностика». — Краткая Медицинская Энциклопедия. — М.: Советская Энциклопедия, 1989.
- «Клиническая оценка результатов лабораторных исследований»//Г. И. Назаренко, А. А. Кишкун. г. Москва, 2005 г.
- Клиническая лабораторная аналитика. Основы клинического лабораторного анализа В.В Меньшиков, 2002 .
Профильные специалисты
Консультация заведующего отделением неврологии, первичная 6 050 руб.
Консультация заведующего отделением неврологии, повторная 5 170 руб.
Консультация ведущего специалиста отделения неврологии, первичная 5 500 руб.
Консультация ведущего специалиста отделения неврологии, повторная 4 620 руб.
Вы сейчас находитесь:
Расшифровка показателей ЭЭГ головного мозга
Нами управляют циркадные ритмы. Эти биологические часы влияют на то, как мы спим, расходуем энергию и перевариваем пищу. Разбираемся, как с ними подружиться.
Наш режим сна и график активности да и самочувствие в целом подчиняются суточным циклам. Поэтому иногда, что бы мы ни делали, бывает сложно собраться на работе после обеда или заставить себя пойти на тренировку утром. В этой статье разберемся, как подружиться со своими биологическими часами, чтобы использовать их себе на пользу.
Это первая из серии статей про режим сна и самочувствие. В них проверенная информация и простые рекомендации, которые помогут вам чувствовать себя лучше, не меняя образ жизни кардинально.
Содержание
- 1. Что такое циркадные ритмы
- 2. Как работают наши внутренние часы
- 3. Как циркадные ритмы влияют на наше здоровье
- 4. Почему опасно нарушать циркадные ритмы
- 5. Как завести свои внутренние часы заново
- 6. На заметку
Что такое циркадные ритмы
Около 20% всех наших генов «включаются» и «выключаются» во время одного полного цикла.
Главный механизм биологических часов — это супрахиазматическое ядро (СХЯ) гипоталамуса. Этот отдел мозга отвечает за реакцию на стресс, половое поведение, координацию действий и другие важные функции. Это ядро получает информацию от светочувствительных клеток сетчатки глаз и других рецепторов и на ее основе синхронизирует работу биоритмов.
Также супрахиазматическое ядро сообщает эпифизу и эндокринной железе, когда пора вырабатывать гормон сна мелатонин. Концентрация мелатонина возрастает вечером, достигает пика ночью и снижается днем.
А с другим важным гормоном, кортизолом, обратная история. Его концентрация повышается к утру, когда нам нужно быть бодрыми, и снижается к вечеру, когда нас начинает клонить в сон.
Как работают наши внутренние часы
Гены, отвечающие за работу внутренних часов, называются period и timeless. Их активность колеблется в течение дня и регулируется петлевым механизмом обратной связи. Как только уровень белков, кодируемых этими генами, достигает определенного уровня, синтез этих белков прекращается. Уровень падает — синтез возобновляется.
Свет и его отсутствие — главные, хотя и не единственные, регуляторы циркадных ритмов. Холодный синий свет от офисных ламп, экранов компьютеров, телевизоров и смартфонов сбивает эти ритмы. В итоге организм «думает», что световой день в разгаре. Красный и зеленый свет тоже негативно влияют на ход внутренних часов.
Циркадные ритмы «включаются» и «выключаются» светом. Яркий искусственный свет запускает каскады химических реакций и сбивает правильный режим дня.
Циркадные ритмы у человека — это не отдельный орган, их нельзя увидеть или почувствовать. Но они необходимы для здоровья и нормальной жизнедеятельности — и сохраняются даже у многих слепых людей.
Если смотреть по ночам сериалы, поздно и плотно ужинать, работать в ночную смену и ложиться спать с рассветом, слаженная работа генов и циркадных ритмов нарушается. Какие-то метаболические процессы запускаются позже обычного, а какие-то останавливаются совсем.
Как циркадные ритмы влияют на наше здоровье
Ночные смены могут повышать риск рака — при сбитых циркадных ритмах организму сложнее предотвращать образование опухолей. Международное агентство по изучению рака даже отнесло сменную работу к канцерогенам. Работа с постоянным ночным графиком, а не скачущим режимом, в этом плане может быть менее опасной.
Ученые связывают нарушения циркадных ритмов с серьезными, но предотвратимыми заболеваниями: диабетом 2-го типа, болезнями сердечно-сосудистой системы, ожирением, инсультом и раком. Чтобы понять, как развиваются эти болезни, нужно взглянуть на то, что происходит, когда мы нарушаем гигиену сна.
Как циркадные ритмы влияют на пищеварение
Желудочно-кишечный тракт вырабатывает наибольшее количество ферментов, желудочного сока и сопутствующих веществ в первой половине дня. Поэтому желательно завтракать плотно, но ужинать чем-то легким.
Также с утра наиболее активно работает перистальтика. Если плотно есть на ночь и поздно просыпаться, возрастает риск запоров, колик, вздутия и несварения, потому что процессы переваривания замедляются.
Как циркадные ритмы влияют на головной мозг
Здоровый сон — это время, когда мозг буквально промывается и очищается с помощью спинномозговой жидкости или ликвора. Эта жидкость выводит продукты обмена, в том числе токсичные соединения, которые ухудшают функции памяти. Также во сне активно восстанавливаются миелиновые оболочки — они нужны для передачи сигналов между нейронами.
Нарушение фаз сна прерывает эти важные процессы. В результате мы просыпаемся уставшими, вялыми и не готовыми к серьезной интеллектуальной работе. Если постоянно игнорировать свои биологические ритмы, это может привести к нервно-психическим расстройствам.
Как циркадные ритмы влияют на риск заболеваний
Бессонница, недосып и плохое качество сна ведут к гипертонии и развитию резистентности к инсулину, из-за чего повышается уровень глюкозы в крови. Эти симптомы, сигнализируют о нарушениях метаболизма и болезнях сердечно-сосудистой системы.
Исследования показывают, что люди, работающие в ночную смену, чаще страдают от ожирения, диабета 2-го типа и гипертонии.
Риск развития этих заболеваний возрастает и у людей с нарушенными циркадными ритмами.
Почему опасно нарушать циркадные ритмы
Низкое качество сна приносит и другие, менее очевидные проблемы. Невыспавшийся человек легко набирает вес и с трудом сбрасывает его. Ему чаще хочется сладкого и фастфуда, чем здоровой пищи, потому что организм пытается компенсировать недостаток энергии тягой к простым углеводам.
Также при нарушении биоритмов становится сложнее заснуть и проснуться, развивается зависимость от кофеина. Спать хочется как можно дольше, но сон перестает восполнять силы. Повышается риск депрессии, возникают перепады настроения в течение дня и всплески негативных эмоций. А организм становится более уязвимым к болезням и инфекциям.
Как завести свои внутренние часы заново
Хорошая новость: сломанные биологические часы можно отремонтировать. Вместе с правильным распорядком дня к вам вернутся продуктивность и здоровый сон. Восстановление циркадных ритмов и режима дня не означает, что нужно ложиться спать сразу после заката, особенно если вы «сова». Главное — избегать искусственного света и засыпать в промежутке времени, когда вырабатывается мелатонин, то есть с 12 до 4 ночи.
Облегчить засыпание поможет отказ от гаджетов за час-два до сна. Также вечером стоит включать лампы с теплым приглушенным светом вместо ярких ламп дневного света. Чтобы восстановить режим сна, нужно ложиться каждый день примерно в одно и то же время, даже если это выходной.
На заметку
Если вы часто чувствуете усталость и рассеянность в течение дня и плохо спите, возможно вы сбили свои биологические часы. Вот что поможет привести все в норму:
- Если очень нужно проверить перед сном соцсети или посмотреть кино с планшета, включите ночной режим — с ним подсветка становится желтоватой и менее яркой.
- Перед сном переключайтесь с визуального контента на аудио: слушайте подкасты и аудиокниги.
- Откажитесь от алкоголя поздним вечером — он ухудшает качество сна.
- Ложитесь спать слегка голодными.
- Купите плотные, блокирующие свет шторы и открывайте их сразу же при пробуждении.
- Во второй половине дня выбирайте напитки без кофеина.
- Используйте беруши и маску для сна, если посторонние шумы и свет с улицы прерывают ваш сон.
Генетика тоже может влиять на паттерны сна: например, бессонница может передаваться по наследству. Выявить генетическую предрасположенность к бессоннице и особенности метаболизма кофеина можно с помощью Генетического теста Атлас.
- Sachin Panda, The Circadian Code
- Koch C.E. et al., Interaction between Circadian Rhythm and Stress 2017
- S. Panda et al., Coordinated Transcription of Key Pathways in the Mouse by the Circadian Clock
- Blue light has a dark side
- Circadian rhythms fact sheet
- Thomas C. Erren et al., Shift Work and Cancer 2010
- Bennett J.E. et al. (2018). NCD Countdown 2030: worldwide trends in non-communicable disease mortality and progress towards Sustainable Development Goal target 3.4
- NHS Prevalence, Achievements and Exceptions workbooks 2016
- The role of sleep and wakefulness in myelin plasticity
- Night shift work, short sleep and obesity