Подборка по базе: Тест 1, 2 по теме Полезные ископаемые.docx, Самостоятельная работа к теме 1 Тулупова Ю.А. гимназия 7 Арсенье, Самостоятельная работа по теме 1.1 история.docx, Самостоятельная работа по теме 1.5.docx, Самостоятельная работа по теме 1.3.docx, Самостоятельная работа по теме 1.1.docx, Задания по теме Abphf 11.doc, Самостоятельная работа по теме 3.3..docx, Самостоятельная работа по теме 3.4..docx, Самостоятельная работа по теме 4.3..docx
Контрольные вопросы к лекции по теме «Кинетика химических реакций»
- Как определяется константа скорости химической реакции? Что означают химические символы в квадратных скобках?
Константу скорости k можно определить экспериментально: она численно равна скорости реакции в тот момент, когда концентрации исходных веществ равны 1 моль/л: v = k[А][Б] = k[1][1], следовательно, в этот момент v = k.
Состояние системы, характеризующееся равными скоростями прямой и обратной реакций, называют состоянием химического равновесия
В условиях химического равновесия концентрации всех веществ в системе не изменяются со временем. Это означает, что каждого вещества за единицу времени расходуется столько же, сколько вновь образуется.
Концентрации веществ в условиях химического равновесия называют равновесными концентрациями.
Равновесные концентрации обозначают символом вещества в квадратных скобках — [N2], [NH3] и измеряют в моль/л.
- В чем различие между порядком и молекулярностью химической реакции?
Под молекулярностью реакции понимают число молекул, которые одновременно взаимодействуют, осуществляя элементарный акт химического превращения. В отличие от порядка реакции молекулярность не может быть ни нулевой, ни дробной.
Порядок реакции по отношению к веществу — это показатель степени, до которого повышается его концентрация в уравнении скорости.
Порядок реакции определяется кинетическим уравнением и равен сумме показателей степеней при концентрациях реагирующих веществ.
Молекулярность химических реакций показывает, сколько молекул реагентов участвует в реакции. Ключевое различие между порядком реакции и молекулярностью состоит в том, что Порядок реакции определяет соотношение между концентрацией химического вещества и реакцией, в которой он проходит, тогда как молекулярность указывает, сколько молекул реагента участвует в реакции.
- К реакциям какого типа неприменимо понятие молекулярности?
Молекулярность реакции – число молекул, участвующих в элементарном акте химического превращения.
Мономолекулярные реакции: A→B
Бимолекулярные реакции: A+B→C+D
Тримолекулярные реакции: A+B+C→D+E+F
Участие в элементарном акте более трех молекул одновременно маловероятно.
- Как определить, что данная реакция является реакцией первого порядка?
Д
Это реакции изомерного превращения, гидролиза и др.
- Почему увеличение скорости движения молекул не является достаточно убедительным для объяснения резкого увеличения скорости химической реакции при нагревании?
Для каждой конкретной реакции температурный коэффициент определяется опытным путем. Он показывает, во сколько именно раз возрастает скорость данной химической реакции (и ее константа скорости) при повышении температуры на каждые 10 градусов.
Правило Вант-Гоффа используется для приближенной оценки изменения константы скорости реакции при повышении или понижении температуры. Более точное соотношение между константой скорости и температурой установил шведский химик Сванте Аррениус:
Чем больше Ea конкретной реакции, тем меньше (при данной температуре) будет константа скорости k (и скорость) этой реакции. Повышение Т приводит к увеличению константы скорости, это объясняется тем, что повышение температуры приводит к быстрому увеличению числа «энергичных» молекул, способных преодолевать активационный барьер Ea .
Можно изменить скорость реакции, используя специальные вещества, которые изменяют механизм реакции и направляют ее по энергетически более выгодному пути с меньшей энергией активации.
Катализаторы – это вещества, участвующие в химической реакции и увеличивающие ее скорость, но по окончании реакции остающиеся неизменными качественно и количественно.
Ингибиторы – вещества, замедляющие химические реакции.
- Какой физический факт позволяет ввести понятие об энергии активации?
Энергия активации в физике — минимальное количество энергии, которое должны получить электроны донорной примеси, для того чтобы попасть в зону проводимости.
В химической модели, известной как Теория активных соударений (ТАС), есть три условия, необходимых для того, чтобы произошла реакция:
Молекулы должны столкнуться. Это важное условие, однако его не достаточно, так как при столкновении не обязательно произойдёт реакция.
Молекулы должны обладать необходимой энергией (энергией активации). В процессе химической реакции взаимодействующие молекулы должны пройти через промежуточное состояние, которое может обладать большей энергией. То есть молекулы должны преодолеть энергетический барьер; если этого не произойдёт, реакция не начнётся.
Молекулы должны быть правильно ориентированы относительно друг друга.
- Как изменяется при постоянной температуре энтальпия реакции при изменении энергии активации прямой реакции?

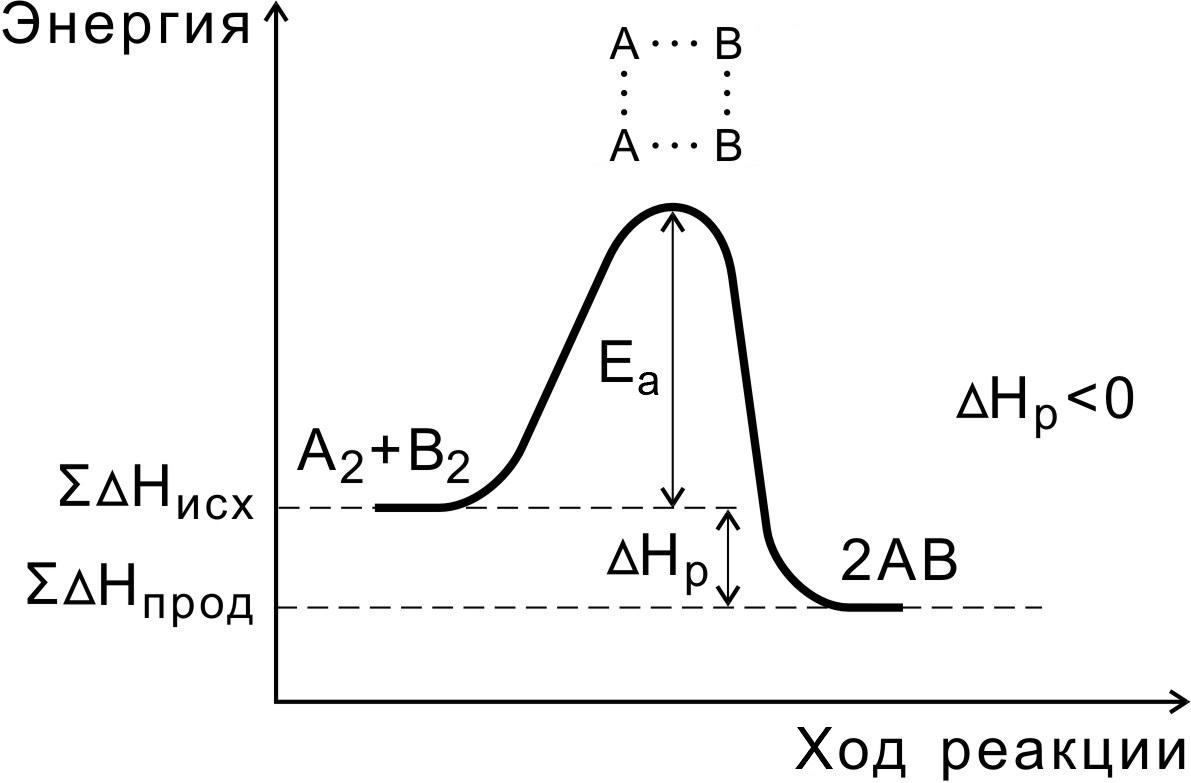
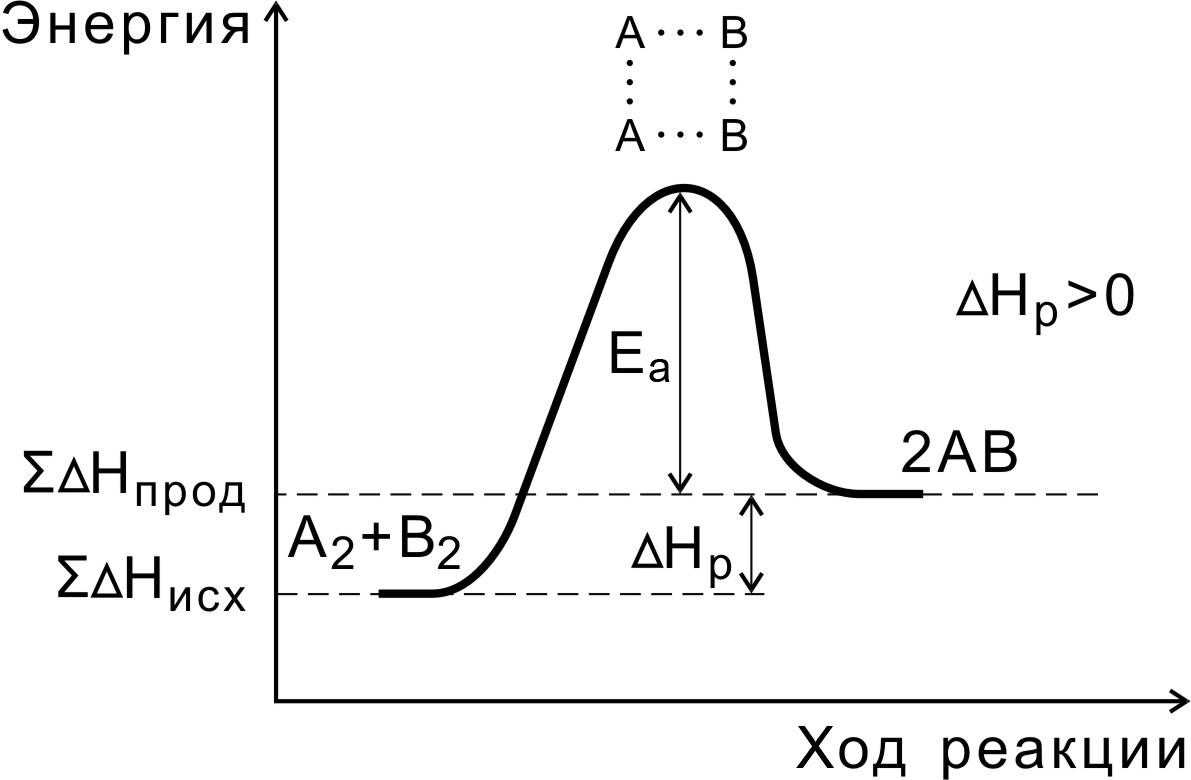
Энергия активации реакции приближённо равна превышению средней энергии активированного комплекса над средним уровнем энергии реагентов.
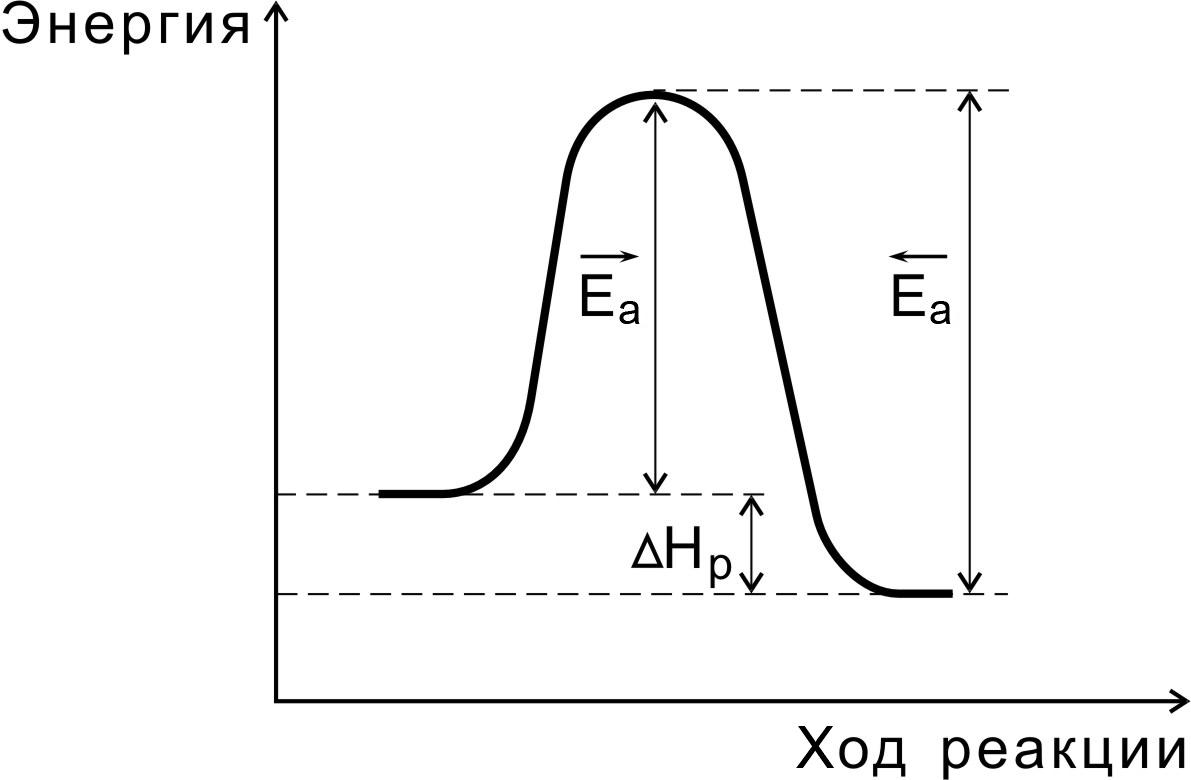
Очевидно, что если прямая реакция является экзотермической, то энергия активации обратной реакции Е’А выше, нежели энергия активации прямой реакции EA.
В ходе химической реакции число активных молекул уменьшается, но в результате столкновений молекул реагирующих веществ, происходит перераспределение энергии. Поэтому доля активных молекул Nакт/ N0 непрерывно восстанавливается и реакция не прекращается.
Связь энергии активации с тепловым эффектом реакции ∆Н. Экзотермическая Эндотермическая Е*1– прямая реакция, Е*2– обратная реакция. Энергия реакционной системы должна пройти через максимум — потенциальный (энергетический) барьер. Величина барьера соответствует энергии активации. ∆Н = Е*1-Е*2. Экзотермическая: Е*1< Е*2 ∆Н<0 Эндотермическая: Е*1> Е*2 ∆Н>0
- Как можно изменить энергию активации?
И
А + В =АВ:
Энергия активации Еа равна разности энергий переходного (ЕПС) и исходного (Еисх) состояний:
Еа = ЕПС – Еисх.
Энергия активации определяет скорость реакции: чем меньше значение Еа, тем выше скорость реакции.
При низкой (для определённой реакции) температуре большинство молекул обладают энергией меньшей, чем энергия активации, и неспособны преодолеть энергетический барьер. Однако в веществе всегда найдутся отдельные молекулы, энергия которых значительно выше средней. Даже при низких температурах большинство реакций продолжают идти. Увеличение температуры позволяет увеличить долю молекул, обладающих достаточной энергией, чтобы преодолеть энергетический барьер. Таким образом повышается скорость реакции.
- Почему столкновения молекул не всегда приводят к взаимодействию, даже если молекулы обладают энергией активации?
Энергия активации есть избыточное количество энергии, которым должна обладать реагирующая частица для преодоления потенциального барьера, разделяющего исходное и конечное состояние системы. Туннельный эффект – переход системы из исходного в конечное состояние, минуя вершину потенциального барьера при E>Eакт — необходимое, но недостаточное условие для протекания реакции. Требуется еще соударение молекул и их определенное расположение друг относительно друга.
- Что представляет собой активированный комплекс?
Активированный комплекс представляет собой промежуточное состояние, которое образуется в процессе превращения реагентов в продукты.
Активированный комплекс представляет собой структуру, которая приводит к максимальной точке энергии вдоль пути реакции.
Энергия активации – это своеобразный энергетический барьер, который отделяет исходные вещества от продуктов реакции. При этом в ходе реакции из частиц реагирующих веществ образуется промежуточная неустойчивая группировка, называемая переходным состоянием или активированным комплексом (в точке С), последующий распад которого приводит к образованию конечного продукта АВ.
- Как влияют на протекание химических реакций большие положительные значения энтальпий активации и большие положительные энтропии активации?
- Чем отличаются механизмы SN1 и SN2? Чем характеризуется активированный комплекс в каждом из этих механизмов?
В
Энергетические диаграммы для предельных случаев механизмов SN1 (a) и SN2 (б).
Переходные состояния SN2-механизма (в)
Закономерности протекания реакций по механизму SN1
Такие диссоциативные реакции имеют следующие характерные следствия:
Поскольку стадия ионизации определяет скорость всей реакции, реакции подчиняются кинетическому уравнению первого порядка: скорость = Таким образом скорости ионизации субстратов не должны зависеть ни от природы, ни от концентраций нуклеофильных реагентов Nu.
Из энергетических диаграмм следует, что энергии переходных состояний стадий ионизации R-Z близки к энергиям продуктов первой стадии — карбокатионов. Следовательно, переходные состояния «похожи» на карбокатионы и в структурном смысле, тогда структурные взаимодействия, которые понижают энергии карбокатионов, должны понижать и энергию переходных состояний.
Ионизация зависит как от полярности и ионизирующих сил растворителей, так и от присутствия в растворах ионов Z−, которые влияют на диссоциацию.
Если карбокатионы, образующиеся при ионизации, достаточно стабильны, они примут плоскую конфигурацию, которая ахиральна и наиболее выгодную энергетически.
Закономерности протекания реакций по механизму SN2
В классическом SN2 механизме замещения описывается синхронная одностадийная реакция, в которой переходные состояния представляют собой тригональные бипирамиды с пентакоординированными атомами углерода .
В SN2 -механизме отсутствует какой-либо интермедиат в процессе согласованного замещений групп Z на Nu . В таких процессах главными энергетическими факторами являются взаимодействия несвязывающих орбиталей нуклеофилов (ВЗМО) с разрыхляющими σ*-орбиталями связей C−Z (НСМО). Такой механизм имеет следствия:
Реакции имеют общий второй кинетический порядок: скорость =
Н
уклеофилы участвуют в образовании переходных состояний, поэтому скорость должна зависеть как от концентрации, так и от природы нуклеофилов, что резко отличает SN2 механизм от механизма SN1. Синхронные SN2-реакции должны быть стереоспецифическими. Атака нуклеофилов наблюдается с тыла. Нуклеофильные агенты Nu: атакуют субстраты RZ со стороны, противоположной уходящим группам Z, таким образом, чтобы образование связей C-Nu сопровождается синхронными расщеплениями связей C-Z в тригональных бипирамидальных переходных состояниях с пентакоординированными атомомами углерода (рис.в). Примером этого процесса, является замещение атомов йода в (+)−2-йодалканах под действием радиоактивных йодид-ионных изотопов (Ингольд, Хьюз, 1935):
Каждому элементарному акту замещения атомов йода на изотопы соответствует обращение (инверсия) конфигураций. В переходных состояниях согласованных SN2 -реакций степень координации центральных атомов углерода увеличиваются до пяти, а сами переходные состояния представляют собой тригональные бипирамиды. Исходя из этого, скорости таких реакций должны быть в очень сильной степени чувствительны к пространственным факторам, в первую очередь к объемам заместителей при центральных атомах углерода.
- Какой из двух механизмов: SN1 или SN2 – должен иметь большую энергию активации?
Механизм реакции SN2 или реакции бимолекулярного нуклеофильного замещения (англ. substitutionnucleophilicbimolecular) происходит в одну стадию, без промежуточного образования интермедиата.
Скорости SN2 -реакций для алкилгалогенидов, а также алкилсульфонатов уменьшаются в ряду первичный — вторичный – третичный заместитель: CH3>C2H5>RCH2>R2CH>R3C.
Реакции SN1
Механизм реакции SN1 или реакции мономолекулярного нуклеофильного замещения (англ. substitutionnucleophilicunimolecular) включает следующие стадии:
1. Ионизация субстрата с образованием карбкатиона (медленная стадия):
R−X → R+ + X−
2. Нуклеофильная атака карбкатиона (быстрая стадия):
R+ + Y− → R−Y
или (если в качестве нуклеофила выступает нейтральная частица):
R+ + Y−Z → R−Y+−Z
3. Отщепление катиона (быстрая стадия):
R−Y+−Z → R−Y + Z+
П

Условный энергетический профиль реакции мономолекулярного нуклеофильного замещения представлен на диаграмме. Условный энергетический профиль реакции SN1
Скорость реакции SN1 (в упрощённом виде) не зависит от концентрации нуклеофила и прямо пропорциональна концентрации субстрата:
Скорость реакции = k × [RX]
Т
Важно иметь в виду, что SN1 механизм реализуется только в случае относительной устойчивости промежуточного карбкатиона, поэтому по такому пути, обычно, реагируют только третичные ((R)3C-X) и вторичные ((R)2CH-X) алкилпроизводные.
Реакции SN2
Условный энергетический профиль реакции SN2
Механизм реакции SN2 или реакции бимолекулярного нуклеофильного замещения (англ. substitutionnucleophilicbimolecular ) происходит в одну стадию, без промежуточного образования интермедиата. При этом атака нуклеофила и отщепление уходящей группы происходит одновременно:
R−X + Y− → [Y⋯R⋯X]− → R−Y + X−
П
Условный энергетический профиль реакции бимолекулярного нуклеофильного замещения представлен на диаграмме.
Скорость реакции SN2 зависит как от концентрации нуклеофила, так и концентрации субстрата:
Скорость реакции = k × [RX] × [Y]
Так как в процессе реакции атака нуклеофилом может происходить только с одной стороны, результатом реакции является стереохимическая инверсия образующегося продукта.
Ещё в 1895 году этот эффект обнаружил латышский химик Пауль Вальден («обращение Вальдена»), однако он не смог его объяснить. В 1935 году Хьюз исследуя реакцию оптически активного 2-йодоктана с йодид-ионом обнаружил, что реакция имеет общий второй кинетический порядок и первый по каждому из реагентов, а также, что скорость рацемизации в два раза выше скорости внедрения йода в молекулу йодоктана. Так было сформулировано стереохимическое SN2 правило:
В реакциях бимолекулярного нуклеофильного замещения атакующий нуклеофил стереохимически инвертирует молекулу, в которой он замещает уходящую группу.
Сравнение реакций SN1 и SN2

- На каком основании можно утверждать, что реакция H2 + I2 = 2HI не является простой бимолекулярной реакцией?
Бимолекулярные – реакции, в которых химическое превращение осуществляется путём взаимодействия двух молекул: H2 + I2 =2HI
Для того чтобы могла образоваться молекула HI, должны разорваться связи между атомами водорода в молекуле H2 и атомами йода в молекуле I2 и образоваться новые связи между атомами водорода и йода.
Разрыв старых и образование новых связей происходит при столкновении молекул водорода и йода. При этом образуется неустойчивая система H2I2, в которой становится возможным перераспределение электронной плотности между атомами и формирование новых связей. Образовавшееся соединение H2I2 быстро распадается на две молекулы HI. Это неустойчивое промежуточное соединение H2I2 называется активированный комплекс.
Т
H2 + I2 = H2I2;
2) распад активированного комплекса на две молекулы HI
H2I2 = 2HI.
В активированном комплексе связи H–I начинают образовываться одновременно с разрывом связей Н–Н и I– I
На рисунке показано, как меняется потенциальная энергия системы в процессе этих превращений.
- Каков механизм реакций: SN1 или SN2 – более вероятен для реакций с участием октаэдрических комплексных ионов?
механизм реакций: SN2 с участием октаэдрических комплексных ионов более вероятен
от же комплекс получается и при добавлении к раствору FeCl2 раствора цианида калия KCN:
[Fe(H2O)6]2 + 6CN
= [Fe(CN)6]4
+ 6H2O .
Это говорит о том, что цианидный комплекс прочнее аквакомплекса. Кроме того магнитные свойства цианидного комплекса указывают на отсутствие неспаренных электронов у атома железа. Все это связано с несколько иным электронным строением этого комплекса:
Более » сильные» лиганды CN образуют более прочные связи с атомом железа, выигрыша в энергии хватает на то, чтобы » нарушить» правило Хунда и освободить 3d-орбитали для неподеленных пар лигандов. Пространственное строение цианидного комплекса такое же, как и аквакомплекса, но тип гибридизации другой – d2sp3.
- Каков отличительный признак сопряженной реакции?
Сопряженные реакции (одна реакция идет в присутствии другой). Примером такого процесса являются следующие реакции:
1. HBrO3 + 3H2SO3 = HBr + 3H2 SO4 ;
2. HBrO3 + 3H3AsO3 = HBr + 3H3AsO4 .
Вторая реакция идет только в присутствии первой, так как H2SO3 более сильный восстановитель, чем H3 AsO3 , и в системе протекают реакции
- HBrO3 + H2SO3 = HBrO2 + H2SO4HBrO2 –
более сильный окислитель, чем H3AsO3 . Отсюда
- HBrO2 + 2H3AsO3 = HBr + 2H3AsO4 .
В процессах данного типа одна реакция как бы индуцирует протекание другой. Это явление называется химической индукцией.
- Каков отличительный признак цепной реакции?
Цепные реакции распространены в химии. Эти реакции вызываются свободными радикалами, активными частицами, образовавшимися из валентнонасыщенных молекул. По цепному механизму протекают многие фотохимические реакции, реакции горения.
Основными стадиями цепных реакций являются:зарождение, продолжение, разветвление и обрыв цепи.
Различают два типа цепных реакций: реакции с неразветвлёнными и с разветвлёнными цепями. Зарождение цепи – это стадия цепной реакции, в результате которой возникают радикалы из валентнонасыщенных молекул.
Образование радикалов может происходит за счёт или внешнего источника энергии ( световое излучение, тепло, электроразряди др.), или обменного взаимодействия молекул, или введенияпосторонних веществ, неустойчивых в данных условиях (пероксиды, гидропероксиды).
Например, при взаимодействии водорода с хлором образование радикалов происходит под действием кванта света:
| H2 + Cl2 = 2HCl | |
| Cl2 + hν = 2Cl
Cl. + H2 = HCl + H H. + Cl2 = HCl + Cl |
зарождение цепи;
продолжение цепи; продолжение цепи; |
| H. + H. = H2
Cl. +Cl. = Cl2 |
обрыв цепи;
обрыв цепи. |
Продолжение цепи – стадия цепной реакции, протекающая с сохранением общего числа свободных радикалов. Разветвление цепи – это стадия, в которой единичная реакция одного свободного радикала приводит к образованию нескольких свободных радикалов (число свободных связей увеличивается).
Примером такого процесса служит реакция окисления водорода:
| H2 + O2 = 2H2O | |
| H2 + O2 = H. + HO2
H. + O2 = OH. + . O. OH. + H2 = H2 O + H. O. + H2 = OH. + H |
зарождение цепи;
разветвление цепи; продолжение цепи; разветвление цепи; |
| H. + стенка = 1/2H2 | обрыв цепи; |
Обрыв цепи – стадия реакции, в результате которой исчезают свободные радикалы. Это может произойти в результате или рекомбинации свободных радикалов (образование исходных молекул), или столкновения со стенкой сосуда, или взаимодействия радикала с примесями, если они не являются источниками свободных радикалов. Поэтому скорость цепной реакции чувствительна к наличию примесей и к форме сосуда. Так, содержание в реакционной смеси хлора с водородом долей процента кислорода во много раз уменьшает длину цепи. Возникающее огромное количество радикалов приводит к лавинообразному течению процесса, которое может вызвать взрыв.
Общая скорость неразветвлённой цепной реакции определяется выражением
V = VOn = VO(Vпрод./Vобр. ),
где n – длина цепи;
VO – скорость зарождения цепи;
Vпрод. – вероятность продолжения цепи;
Vобр. – вероятность обрыва цепи.
Под длиной цепи понимают среднее количество элементарных стадий продолжения цепи после возникновения свободного радикала до его исчезновения (обрыва цепи);
- Какой советский ученый получил Нобелевскую премию за исследования в области цепных реакций?
Академик АН СССР (1932 год; член-корреспондент с 1929 года), единственный советский лауреат Нобелевской премии по химии, награждён в 1956 году. Дважды Герой Социалистического Труда.
Теория цепных реакций разработана академиком H.H. Семёновым (СССР), С.Н. Хиншельвудом (Англия).
- Объясните принцип действия катализатора. Чем отличается ингибитор от катализатора?
Катализатор изменяет механизм реакции на энергетически более выгодный, то есть снижает энергию активации.
При этом изменение скорости реакции происходит за счет изменения энергии активации, причем катализатор с реагентами образует активированный комплекс. Катализатор после разрушения активированного комплекса не входит в состав продуктов реакции, поэтому общее уравнение процесса остается прежним.
Катализатор образует с молекулой одного из реагентов промежуточное соединение, в котором ослаблены химические связи. Поэтому они не смещают химическое равновесие.
Катализатор — химическое вещество, ускоряющее реакцию, но не расходующееся в процессе реакции.
Ингибитор не является противоположным понятием, так как расходуется в ходе реакции.
- Какова причина высокой скорости реакций, протекающих в растворах?
В растворах молекулы занимают определенный объем, Так как имеют ограничение в ввиде сосуда в котором находятся. Молекулы движутся не хаотично, как в газах, а более упорядочено. Поэтому стлокновение молекул растворителя и вещества проиисходит чаще. Следовательно скорость реакции в растворах выще.
- Какова причина высокой эффективности кислотного катализа?
Кислоты относятся к полярным молекулам, поэтому увеличивают скорость перехода реагирующих молекул в более активную ионизированную форму, тем самым повышается реакционная способность.
Активность кислотных катализаторов обусловливается их способностью реагировать с углеводородами с образованием в качестве промежуточного продукта карбений-иона.
Алкилкарбений-ионы содержат положительно заряженный углеродный атом, связанный с тремя алкильными группами и/или атомами водорода. Они играют важную роль как промежуточные продукты, образующиеся во многих реакциях с участием органических соединений.
- Как влияет катализатор на константу равновесия?
Факторы оказывающие влияние на смещение равновесия это температура, давление, концентрация. Катализатор может оказывать влияние только на скорость реакции. Константа равновесия остается неизменной
- На что указывает выражение для константы равновесия?
Значение константы равновесия указывает на направление реакции. Если отрицательное значение, то идет обратная реакция – из продуктов образуются исходные вещества при изменении температуры, давления, концентрации. А значение выше «0» — реакция прямая.
- Как связана константа равновесия с величиной изобарно-изотермического потенциала?
Расчеты изобарных потенциалов и констант равновесия различных реакций легко выполняются путем комбинирования изобарных потенциалов реакций образования соединений из простых веществ.
Стандартный изобарный потенциал любой химической реакции равен алгебраической сумме соответствующих величин для реакций образования всех участников реакции.
Таблицы стандартных изобарных потенциалов образования химических соединений при 1 атм и 25 X являются важнейшей сводкой исходных данных для термодинамических расчетов. Эти табличные данные в большинстве случаен вычислены путем комбинации данных для других реакций. Поэтому они связаны с ошибками опыта, которые суммируются при сочетании величин ЛС и могут составить большую относительную величину, если значение AG° образования невелико и получено путем вычитания больших величин.
Константа равновесия связана с изменением стандартного изобарно—изотермического потенциала химической реакции ∆G o простым уравнением:
∆G o =-RT ln K.
Из этого уравнения видно, что константа равновесия очень чувствительна к изменению температуры.
- Почему многие химические реакции, разрешенные с точки зрения величины изобарно-изотермического потенциала, не протекают самопроизвольно?
- Что означает выражение “селективность катализатора”?
Селективность катализатора – характеристика катализатора, выражающаяся в том, что катализатор ускоряет химические превращения реагента в сторону образования определённого продукта из ряда возможных.
Селективность является одной из основных характеристик катализатора, она определяется как способность катализатора избирательно увеличивать скорость одной из реакций (целевой реакции) при наличии нескольких побочных. Селективность гетерогенных катализаторов обычно ниже, порядка 70%.
- Почему при производстве аммиака вместе с увеличением давления увеличивают и температуру, хотя эта реакция экзотермическая?
- Какова основная причина использования катализаторов при производстве различных химических веществ?
Катализаторы обеспечивают энергетически менее затрудненные пути реакции, что позволяет эффективно использовать сырье. Использование катализатора позволяет проводить процесс при более низких температурах. Эксперименты подтверждают, что с его помощью можно рассчитывать на существенное снижение энергетических затрат. Это особенно важно в современных условиях, когда в мире наблюдается недостаток энергетических ресурсов. Примеры таких производств: изготовление азотной и серной кислот, водорода, аммиака, полимеров, переработка нефти.
Широко применяют катализ в получении органических кислот, одноатомных и многоатомных спиртов, фенола, синтетических смол, красителей, лекарственных средств.
- Как катализатор влияет на энтальпию и энтропию реакции?
- Какие основные факторы влияют на химическое равновесие?
Химическое равновесие всегда отвечает определенным условиям. При изменении внешних параметров (температуры, концентрации, в некоторых случаях – давления) равновесие может нарушиться. Через некоторое время наступает состояние равновесия, отвечающее новым условиям. Возникающее при этом изменение равновесных концентраций реагирующих веществ называется смещением или сдвигом химического равновесия.
В 1884 г. Ле Шателье сформулировал принцип, который помогает качественно предсказать смещение химического равновесия при изменении одного из параметров: Если на систему, находящуюся в состоянии химического равновесия, оказано внешнее воздействие, то равновесие сместится в направлении той реакции, которая ослабляет это воздействие.
Факторы, влияющие на смещение химического равновесия:
- Концентрация веществ: N2 3H2 ⇄ 2NH3, H 0 р-и = 92 кДж
При увеличении концентрации равновесие смещается в направлении расхода этих веществ. При уменьшении концентрации равновесие смещается в направлении образования этих веществ. Если увеличить концентрацию азота, то равновесие сместится в прямом направлении, а если увеличить концентрацию аммиака в обратном.
2) Давление. Влияет только на газообразные вещества. При повышении давления равновесие смещается в направлении реакции, идущей с уменьшением числа частиц газообразных веществ. При уменьшении давления равновесие смещается в направлении реакции, идущей с увеличением числа частиц газообразных веществ. Если увеличить давление, то равновесие сместится в прямом направлении, а если уменьшить в обратном.
3) Температура. При повышении температуры равновесие смещается в направлении эндотермической реакции. При понижении температуры равновесие смещается в направлении экзотермической реакции. Если увеличить температуру, то равновесие сместится в обратном направлении, а если уменьшить в прямом.
4) Катализатор. Введение в равновесную систему катализатора не смещает равновесие, так как катализатор в равной степени увеличивает скорость как прямой, так и обратной реакции. Катализатор только ускоряет момент наступления химического равновесия.
Лекция
по теме «Зависимость
скорости химической реакции
от
температуры»
Учебные
вопросы
-
Уравнение
Аррениуса -
Энергия
активации -
Распределение
молекул по энергиям -
Энтропия
активации. Стерический фактор -
Решение
уравнения Аррениуса
1.
Уравнение Аррениуса
В
большинстве случаев, скорость химической
реакции увеличивается при повышении
температуры.
При этом возрастает константа скорости
реакции.
Зависимость
константы скорости реакции от температуры
выражается уравнением Аррениуса:
|
|
(1) |
где
k
— константа скорости реакции;
A
— константа, называемая предэкспоненциальным
множителем;
— основание натурального логарифма;
Еa
— энергия
активации,
Дж/моль;
Т
— температура, К;
R
— газовая постоянная, 8,31 Дж/мольК.
2. Энергия
активации
Для
того чтобы произошла реакция, необходимо
преодолеть отталкивание электронных
оболочек молекул и разорвать или ослабить
связи между атомами. На это надо затратить
определенную энергию.
Избыточная
энергия (по сравнению со средней энергией
при данной температуре), которой должны
обладать молекулы, для протекания
реакции, называется энергией активации.
Молекулы,
обладающие такой энергией, называются
активными
молекулами.
В
ходе реакции вещества переходят в
неустойчивое промежуточное состояние,
характеризующееся большим запасом
энергии. Именно для его образования
необходима энергия активации (рис. 1,
2).
Переходным
состоянием системы (или активированным
комплексом) называется состояние системы
реагирующих веществ, соответствующее
максимальной энергии на пути реакции.
Энергия
активации – это количество дополнительной
энергии, необходимой для перехода
системы из исходного состояния в
состояние активированного комплекса.
Рис. 1. Энергетическая
диаграмма экзотермической
реакции
Рис. 2. Энергетическая
диаграмма эндотермической реакции
Число
частиц, входящих в активированный
комплекс, определяет молекулярность
данной стадии реакции.
В
переходном состоянии старые химические
связи ослаблены, но окончательно не
разорваны, а новые связи начали
образовываться, но еще не сформировались.
Неустойчивый активированный комплекс
(т.к. обладает избытком энергии) существует
очень короткое время. Он распадается с
образованием исходных веществ или
продуктов реакции.
Переходное
состояние возникает в ходе как прямой,
так и обратной реакции (рис. 3). Энергетически
оно отличается от исходных веществ на
величину энергии активации прямой
реакции, а от конечных – на энергию
активации обратной реакции. Разность
энергий активации прямой и обратной
реакций равна изменению внутренней
энергии (тепловому эффекту) реакции:
Нр
= Еа
— Еа
Рис.3. Соотношение между
энергиями активации прямой
и обратной реакций и
теплового эффекта
-
Распределение
молекул по энергиям
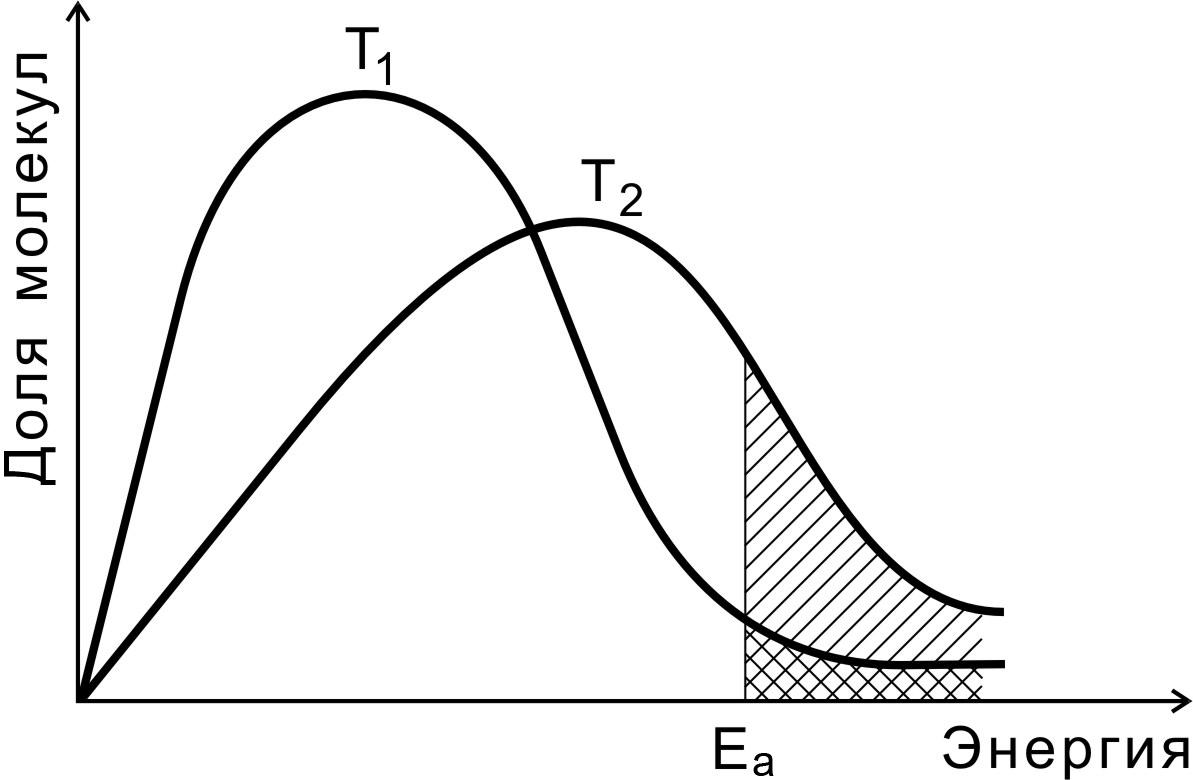
Скорость
реакции зависит от числа молекул,
обладающих энергией, достаточной для
образования активированного комплекса.
На рис. 4 показано распределение молекул
идеального газа по кинетической энергии
согласно статистическому закону
Максвелла-Больцмана при двух разных
температурах. Доля молекул с энергией,
превышающей энергию активации Еа
(доля активных молекул), с повышением
температуры резко возрастает (площадь
заштрихованной области).
Рис. 4. Распределение
молекул по энергиям
при двух разных
температурах
Чем
выше температура, тем больше в системе
активных молекул, тем выше скорость
реакции.
-
Энтропия
активации. Стерический фактор
Кроме
энергии активации важным условием
осуществления химической реакции
является ориентация молекул в момент
столкновения. Большую роль играют
размеры и форма молекул, место расположения
реакционно-способных атомов или групп
атомов в молекуле.
Например,
в реакции
А2
+ B2
2AB
ориентация
(а) реагирующих частиц при столкновении
будет более благоприятна, чем ориентация
(б) (рис. 5).
Рис.5. Благоприятная
(а) и неблагоприятная (б) ориентация
молекул при столкновении
Вероятность
необходимой для взаимодействия ориентации
молекул при столкновении
где,
nвзаим
— число способов ориентации, приводящих
к взаимодействию;
nобщ
—
общее число возможных способов
ориентации.
Энтропия
активации для 1 моля по уравнению
Больцмана
.
Вероятность
необходимой ориентации
.
Чем
больше вероятность необходимой для
реакции ориентации, т.е. чем больше
значение энтропии активации, и чем
меньше значение энергии активации, тем
выше скорость реакции и, соответственно,
константа скорости:

(2)
где
Z
– коэффициент пропорциональности.
Для
бимолекулярных реакций Z
– это число столкновений частиц в
единице объема за единицу времени (1с,
1 см3).
Уравнение
(2) называют основным уравнением химической
кинетики. Энергия активации и энтропия
активации являются теми факторами,
посредством которых сказывается влияние
природы реагирующих веществ на скорость
реакции.
Множитель
называется стерическим фактором (или
стерическим множителем, или фактором
вероятности).
Стерический
фактор (
)
и
частота столкновений (Z)
учитываются в уравнении Аррениуса (1)
через предэкспоненциальный множитель
(А).
5.
Решение уравнения Аррениуса
Энергию
активации можно рассчитать по
экспериментальным данным графическим
или аналитическим способами, используя
уравнение
Аррениуса
,
представив
его в логарифмическом виде
|
|
(3) |
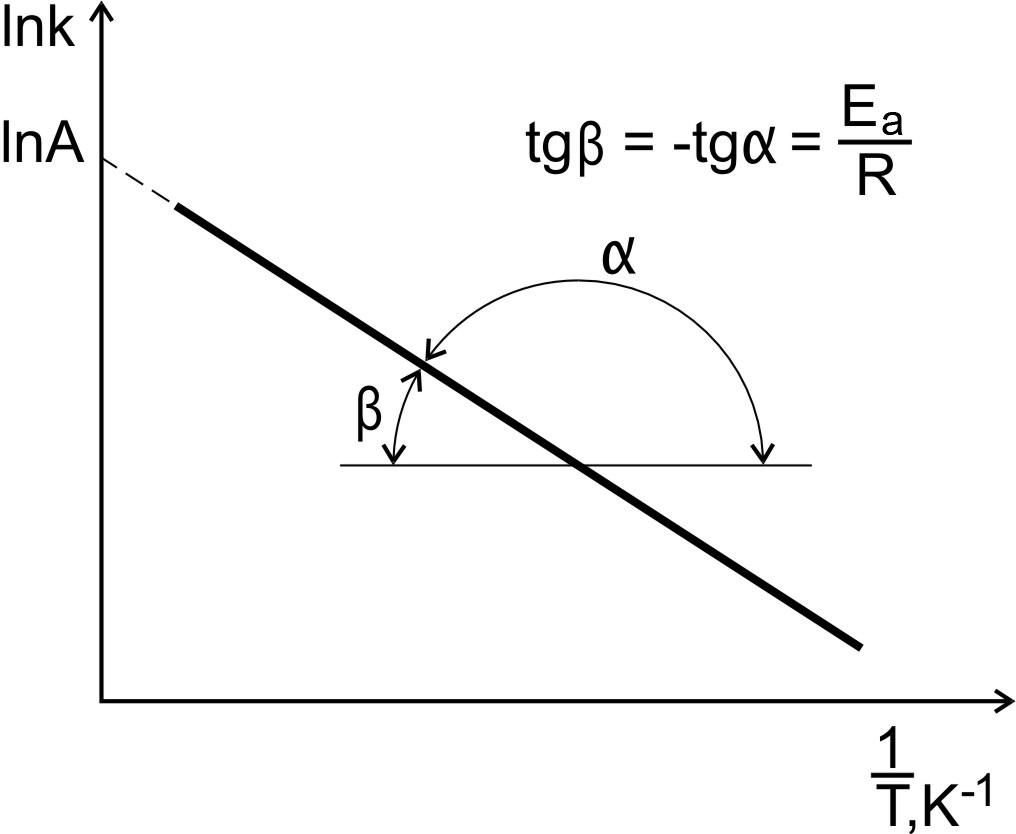
Графический
способ
По
экспериментальным значениям константы
скорости реакции при различных
температурах строят график зависимости
lnk
= f
()
(рис. 6).
Рис. 6. Зависимость
константы скорости реакции
от температуры.
По
тангенсу угла наклона прямой к оси
абсцисс вычисляют энергию активации
,
Отрезок,
отсекаемый прямой на оси ординат при
(),
численно равен ln
А.
Аналитический
способ
Если
предположить, что для выбранной реакции
величины А
и Еа
постоянны в небольших пределах температур
от Т1
до
Т2,
то уравнение Аррениуса (3) можно применить
для двух различных температур (Т2
Т1;
k
(Т2)
= k2;
k
(Т1)
= k1):
В
результате вычитания первого уравнения
из второго получим

следовательно,
|
|
Под
символом логарифма находится отношение
констант скоростей реакции при двух
температурах, поэтому константы можно
заменить любыми пропорциональными им
величинами при тех же температурах.
Например, вместо констант скоростей
можно подставить скорости реакции, если
исходные концентрации реагирующих
веществ при измерении скоростей в обоих
опытах были одинаковы, и скорость
изменилась только под влиянием изменения
температуры. Тогда получим следующие
выражения:
;
|
|
Литература
-
Глинка
Н.Л. Общая химия. – М.: Интеграл-Пресс,
2006. Гл.VI.
§6.2.
-
Коровин
Н.В. Общая химия. – М.: Высш. шк., 2007. Гл.
VII,
§
7.1-7.2. -
Глинка
Н.Л. Задачи и упражнения по общей химии.-
М: Интеграл-Пресс, 2006, гл.V,
§
5.2.
9
Соседние файлы в папке Кинетика_лекции
- #
- #
- #
- #
Изменение — энергия — активация — процесс
Cтраница 1
Изменение энергии активации процесса указывает на изменение типа структуры, контролирующей обмен энергией и веществом с окружающей средой при переходах устойчивость — неустойчивость — устойчивость.
[1]
Можно предположить, что изменение энергии активации процесса связано с особенностями радиационного инициирования полимеризации. По-видимому, в случае радиационной полимеризации при повышении температуры начинают идти вторичные процессы с участием продуктов радиолиза, приводящие к образованию молекул, ингибирующих рост полимерных цепей. Приведенные измерения относительной вязкости растворов политрифторхлор-этилена в мезитилене свидетельствуют о том, что одновременно с уменьшением скорости полимеризации и изменением энергии активации происходит резкое изменение величины молекулярного веса полимера.
[2]
Рассмотрим эту взаимосвязь на примере анализа изменения энергии активации процесса деформации, являющейся важным параметром, определяющим накопление повреждений в материале под нагрузкой с течением времени. Все элементарные акты перемещения дефектов кристаллической решетки требуют атомной перестройки путем обратимого разрыва межатомной связи.
[3]
В чисто химических процессах избыточная энергия придается частицам при повышении температуры, давления и т.п. В изобарно-изотермических электродных процессах изменение энергии активации процесса достигается при изменении строения двойного алектрического слоя электрода под действием внешней поляризации. Это изменяет элергию реагирующих частиц.
[4]
К числу недостатков теории замедленного разряда необходимо отнести некоторую неясность физического смысла коэффициентов о и / 3, формально указывающих на долю общего изменения потенциала, влияющего на изменение энергии активации процесса.
[5]
Зависимость скорости диффузии от состава стали Геллер и Так-Го Сун объясняют тем, что наличие в металле добавок, обладающих большим или меньшим сродством к водороду, чем железо, приводит к соответствующему изменению коэффициента диффузии, а следовательно, к изменению энергии активации процесса диффузии.
[6]
Понятие сродства А характеризует зарождение и движение дислокаций как единый процесс. Знак изменения этой величины, как обычно, противоположен знаку изменения энергии активации процесса. Это означает, что направление процесса соответствует уменьшению напряжения ( релаксации) после продвижения и разрядки дислокаций.
[7]
Понятие сродства А характеризует зарождение и движение дислокаций как единый процесс. Знак изменения этой величины, как обычно, противоположен знаку изменения энергии активации процесса. Это означает, что направление процесса соответствует уменьшению напряжения ( релаксации) после продвижения и разрядки дислокаций.
[8]
Рассмотрим, как связаны дислокации с образующимися при травлении ямками. Нарушения в решетке приводят к появлению на поверхности кристалла областей с различной энергией химических связей. Это вызывает изменения энергии активации процесса химического травления. В тех местах поверхности, где энергия активации минимальна, происходит наиболее интенсивное травление, что и приводит к образованию ямок. При выявлении мест выхода дислокаций на кристаллической плоскости ( 111) ямки травления имеют форму треугольных углублений.
[9]
В процессе течения структура любой системы всегда перестраивается, но в случаях, описываемых механизмом Эйринга, изменения структуры несущественны и она полностью восстанавливается сразу после снятия напряжения. В случае механизма Ребиндера структура изменяется, и для ее восстановления после снятия нагрузки требуется время тиксотропного восстановления. Сразу же после удаления напряжений структура будет иной и лишь постепенно будет приближаться к исходной. Было показано [30, 38], что в дисперсных системах изменение вязкости с увеличением напряжения сдвига происходит за счет изменения энергии активации процесса, а предэкспо-ненциальный член, включающий энтропию активации, не изменяется.
[10]
Таким образом, введение химически индифферентного вещества в систему может заметно изменить энергию активации процесса и его скорость, причем это влияние осуществляется посредством изменения внутренних целей. Способность катализатора изменять энергию активации процесса определяется характером дальних взаимодействий его частиц с молекулами всех реагирующих компонентов. Поскольку добавка не всегда химически индифферентна по отношению к исходным компонентам, ее влияние в общем случае не сводится только к изменению энергии активации процесса.
[11]
В присутствии ингибиторов могут существенно меняться условия протекания коррозионных процессов. Уменьшается доля свободной для реакции поверхности в связи с покрытием части ее адсорбированным ингибитором. Степень ингибирования процесса оказывается при этом пропорциональной Доле закрытой поверхности металла в, которая в свою очередь возрастает с увеличением концентрации добавок. Ингибиторы катионного типа изменяют 1 -потенциал и тем самым тормозят разряд положительно заряженных ионов гидроксония. Константы скоростей частных реакций fej и k % в уравнениях ( 28) и ( 38) могут изменяться за счет изменения энергии активации процесса.
[12]
На рис. 6 приведены экспериментальные данные, полученные на активном и пассивном никеле в 0 1 N растворе КОН. Из рис. 6 видно, что как на активном, так и на пассивном никеле в широком интервале времени наблюдаются зависимости, характерные для диффузионного контроля. Наклон прямых при этом на пассивном никеле оказывается почти на порядок меньше, чем на активном. Влияние перемешивания во всех случаях отсутствует, так же как и в случае окисления серебра, что говорит о диффузионном контроле в окисном слое. Эти результаты указывают на то, что пассивация никеля связана с ухудшением условий переноса в окисном слое, а не с изменением энергии активации процесса. Следовательно, в данном случае следует говорить не об истинной пассивации, а лишь об усугублении концентрационной поляризации в окисном слое как причине уменьшения тока.
[14]
Страницы:
1
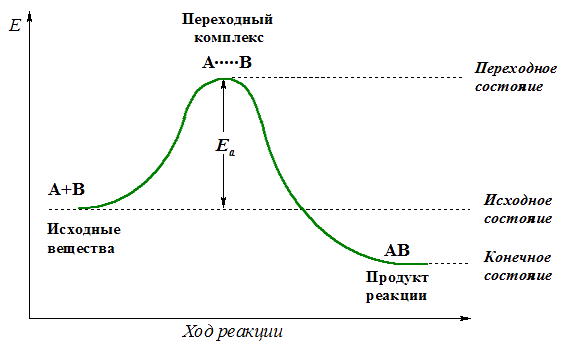
Энергия активации
Для эффективного соударения молекул (частиц), приводящего к химической реакции, требуется определенная энергия.
Минимальное количество энергии, необходимое для прохождения реакции называют энергией активации.
Эта энергия требуется для достижения системой переходного состояния и образования активированного (переходного) комплекса, который превращается в продукты реакции уже самопроизвольно (примечаниеТермины «переходное состояние» и «переходный комплекс» часто используют как взаимозаменяемые, хотя переходное состояние – это уровень энергии на пути реакции, а переходный комплекс — группировка атомов, находящаяся в переходном состоянии.).
Изменение энергии реагирующей системы можно показать на примере элементарной реакции А + В 
Энергия активации Еа равна разности энергий переходного (ЕПС) и исходного (Еисх) состояний:
Еа = ЕПС – Еисх.
Величина Еа служит важной характеристикой любой реакции. Она зависит от природы реагирующих веществ и наличия катализатора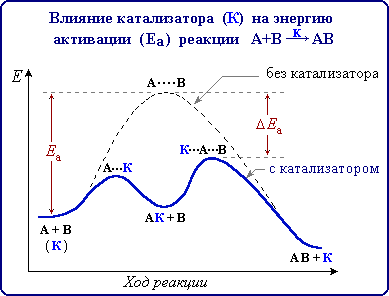
Энергия активации определяет скорость реакции: чем меньше значение Еа, тем выше скорость реакции. Эта зависимость выражается уравнением Аррениуса
Это правило является приближенным и применимо лишь для ориентировочной оценки влияния температуры на скорость реакций, протекающих при температурах, близких к комнатной (энергия активации таких реакций 50-150 кДж/моль). отражает зависимость скорости (константы скорости) реакции от температуры.
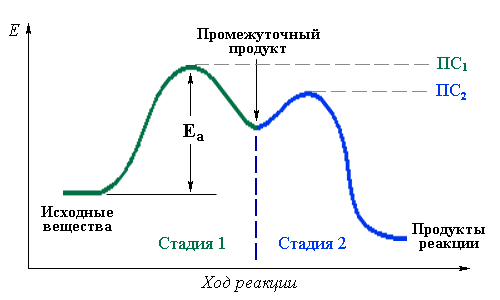
Лимитирующая стадия – элементарная стадия сложной реакции, которая имеет наиболее высокую энергию активации и протекает намного медленнее остальных, ограничивая общую скорость процесса.
Для примера рассмотрим изменение энергии в ходе двухстадийной реакции:
В данном случае стадия 1 является лимитирующей, так как имеет более высокую энергию переходного состояния ПС1. Следовательно, для осуществления двухстадийной реакции в целом требуется энергия Еа, активирующая стадию 1.