Содержание статьи
- 1 Что такое кипение Автоклав
- 1.1 Как изменить температуру кипения
- 1.2 Автоклав
Что такое кипение Автоклав

По мере испарения пузырьки пара растут и затем часть их отрывается, под действием выталкивающей силы жидкости прорывается к ее поверхности и пар выходит наружу. Этот процесс называется кипением жидкости.
Температура, при которой начинается этот процесс, называется температурой кипения жидкости и определяется как температура, при которой давление насыщающего пара делается равным давлению в жидкости (для жидкости в открытом сосуде — это атмосферное давление).
Как изменить температуру кипения
Изменяя давление, под которым находится жидкость, можно изменить температуру ее кипения в широких пределах. При понижении давления вода может кипеть при низкой, например, комнатной температуре. Наоборот, при значительном повышении давления температура кипения воды достигает нескольких сот градусов.
Зависимость температуры кипения воды от давления приведена в таблице.
| Давление в am | 1 | 2 | 3 | 5 | 10 | 20 | 100 |
| Температура кипения в °С | 100 | 120 | 133 | 151 | 180 | 210 | 310 |
Температуры кипения некоторых жидкостей при атмосферном давлении приведены в таблице на стр. 110.
Зависимость температуры кипения от давления используется в приборах, называемых автоклавами, которые широко применяются в химической и пищевой промышленности, а также в медицине. Автоклав служит для обработки (в медицине для дезинфекции) различных материалов паром под давлением и при температурах выше 100° С.
Автоклав
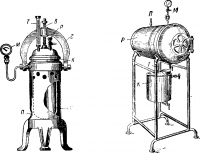
Котел устанавливается на подставке П и подогревается мощной газовой горелкой. В котел наливается некоторое количество воды и над ней на подставке помещается коробка с подвергаемыми действию пара материалами. Давление пара в автоклаве достигает нескольких атмосфер, температура кипения повышается до 120—130° С.
Медицинский автоклав с электрическим подогревом (рис. 2 б) имеет отдельный котел К и рабочую камеру Р, которые соединены патрубками Т. Вся система герметически закрывается крышками. Рабочая камера автоклава оборудована предохранительным клапаном П и манометром М.
Котел имеет электрический подогрев, пар, образовавшийся в котле, по патрубку поступает в камеру и вся система работает как одно целое. Автоклав рассчитан на стерилизацию материала паром при давлении в 2 am, что соответствует температуре в 120° С.
Понравилась статья поделись ей
Температура кипения: особенности
Кипение — казалось бы, простой физический процесс, известный каждому, хоть раз в жизни вскипятившему чайник. Однако у него есть немало особенностей, которые физики изучают в лабораториях, а хозяйки — на кухнях. Даже температура кипения далеко не постоянна, а меняется в зависимости от различных факторов.

При кипении жидкость начинается интенсивно превращаться в пар, в ней образуются паровые пузырьки, поднимающиеся на поверхность. При нагревании сначала пар появляется только на поверхности жидкости, затем этот процесс начинается по всему объему. Появляются мелкие пузырьки на дне и стенках посуды. При повышении температуры давление внутри пузырей возрастает, они увеличиваются и поднимаются вверх.
Когда температура достигает так называемой точки кипения, начинается бурное образование пузырьков, их становится много, жидкость закипает. Образуется пар, температура которого остается постоянной, пока не выкипит вся вода. Если парообразование происходит в обычных условиях, при стандартом давлении 100 мПа, его температура равна 100оС. Если же искусственно увеличить давление, можно получить перегретый пар. Ученым удалось нагреть водяной пар до температуры 1227оС, при дальнейшем нагреве диссоциация ионов превращает пар в плазму.
При заданном составе и постоянном давлении температура кипения любой жидкости постоянна. В учебниках и пособиях по физике можно увидеть таблицы, указывающие температуру кипения различных жидкостей и даже металлов. Например, вода закипает при температуре 100оС, этиловый спирт при 78,3оС, эфир при 34,6оС, золото при 2600оС, а серебро при 1950оС. Это данные для стандартного давления 100 мПа, оно рассчитывается на уровне моря.
Если давление снижается, температура кипения уменьшается, даже если состав остается прежним. Это значит, что если подняться с котелком воды на гору высотой 4000 метров и поставить ее на костер, вода закипит при 85оС, для этого понадобится гораздо меньше дров, чем внизу.
Хозяйкам будет интересно сравнение со скороваркой, в которой давление искусственно увеличивается. Температура кипения воды при этом также увеличивается, за счет чего пища готовится гораздо быстрее. Современные скороварки позволяют плавно изменять температуру кипения от 115 до 130оС и более.
Еще один секрет температуры кипения воды заключается в ее составе. Жесткая вода, в состав которой входят различные соли, закипает дольше и требует для нагрева больше энергии. Если добавить в литр воды две столовые ложки соли, температура кипения ее увеличится на 10оС. То же самое можно сказать о сахаре, 10% сахарный сироп закипает при температуре 100,1оС.
Повышение температуры кипения растворов.
Кипение
представляет собой фазовый переход,
при котором происходит превращение
жидкости в пар. Температурой кипения
жидкости называют ту температуру, при
которой давление насыщенного пара над
данной жидкостью равна внешнему. При
этой температуре и соответствующем ей
давлении насыщенного пара устанавливается
равновесие между жидкой и газообразной
фазами: скорость испарения равна скорости
обратного процесса – конденсации и обе
эти фазы могут сосуществовать в течение
длительного времени.

где
Е
– коэффициент пропорциональности,
численно равный повышению температуры
кипения раствора, содержащего 1 моль
растворенного вещества в 1000г растворителя,
при условии, что раствор этой концентрации
обладает свойствами идеального. Такое
повышение температуры кипения называется
молярным или эбуллиоскопической
постоянной.
Величина
Е зависит только от свойств растворителя
и может быть найдена либо опытным путем,
либо рассчитана по термодинамическому
соотношению

где
Т
– температура кипения чистого растворителя
по аб. шкале
l
– удельная теплота испарения растворителя
R
– универсальная газовая постоянная
Св
– концентрация раствора, выражаемая
обычно в молях растворенного вещества
на 1000 г растворителя.
Если
Мв
– молярная масса растворенного вещества,
mв
– его масса (в г), а mА
– масса растворителя в граммах, то Св
будет определяться следующим соотношением
Рассмотрим
зависимость давления пара растворителя
над чистым растворителем (0А) и над
разбавленными растворами разной
концентрации нелетучего вещества (ВС
и ДЕ) от температуры (рис.1)
P
101,3 кПа А
С Е
0 С’
B
Е»
D
Ткип0
Т’кип
T”кип
Температуры,
при которых изобара, равная атмосферному
давлению (101,3 кПа), пересечет кривые 0А,
ВС и ДЕ, будут температурами кипения
соответствующих жидкостей при этом
давлении. Для растворов эти температуры
(Т’кип
и T”кип)
являются более высокими, чем для чистого
растворителя (Ткип0)
и разность между ними
будет
тем большей, чем выше концентрация
раствора. Для бесконечно разбавленных
растворов бесконечно малые участки
кривых CC’,
ЕЕ’ можно считать прямолинейным. Тогда
из подобия треугольников АСС’, АЕЕ’
вытекает, что повышение температуры
кипения пропорционально понижению
давления насыщенного пара и, следовательно,
повышение температуры кипения
пропорционально концентрации.
Определив
опытным путем повышение температуры
кипения раствора, можно вычислить
молярную массу вещества
Этот
метод определения молекулярных масс
носит название эбуллиоскопического.
Понижение температуру замерзания растворов.
Замерзание
представляет собой фазовый переход,
при котором происходит превращение
жидкости в твердое вещество. Температурой
замерзания 9кристаллизации) жидкости
называют ту температуру, при которой
давление насыщенного пара над жидкостью
равно давлению насыщенного пара над
выпадающими из нее кристаллами твердой
фазы.
При
этой температуре и соответствующем ей
давлении насыщенного пара скорость
кристаллизации равна скорости плавления
и обе эти фазы могут сосуществовать в
течение длительного времени.
Еще
М.В. Ломоносов заметил, что разбавленный
раствор замерзает при температуре более
низкой, чем чистый растворитель. Так,
морская вода замерзает не при 273 К, а при
несколько более низкой температуре.
Многочисленные эксперименты показали,
что такое изменение температуры
замерзания раствора можно рассматривать
как общее правило.
Процессы
замерзания и кипения были детально
изучены Раулем и представлены в виде
закона, который в последствии был назван
вторым законом Рауля.
рассмотрим
простейший вывод этого закона. На рис.2
показана диаграмма, выражающая зависимость
давления насыщенног пара от температуры
над чистым растворителем и над раствором.
Р
А С Е
0 рис.
2
B
K
D
273 Т
T”з
T’з
Кривая
0А – зависимость давления насыщенного
пара чистой воды от температуры.
Кривая
ВС, ДЕ – зависимость давления насыщенного
пара воды над растворами с различными
концентрациями растворенного вещества
0Д
– выражает температурную зависимость
давления насыщенного пара воды над
льдом.
Из
рис.2 видно, что давление пара над
раствором при 273 К ниже, чем над водой,
но оно не равно давлению пара над льдом
при той же температуре. Лишь при
температуре ниже 273 К (Т’з) давление
пара над раствором уменьшается настолько,
что становится равным давлению пара
над льдом. Этому соответствует точка
В. При более высоких концентрациях
раствора кривые, выражающие зависимость
давления пара воды над раствором от
температуры, располагаются ниже кривой
ВС, но параллельно ей.
Введем
следующий обозначения:
Р0А
– давление пара над чистым растворителем
при 273 К
РА
– давление пара над раствором при
температуре его замерзания Т’з
Далее
из точки В параллельно оси абсцисс
проведем линию до пересечения с
перпендикуляром опущенным из точки 0.
Пересечение этих прямых обозначим
точкой К.
Из
прямоугольного треугольника ВОК
определяем
Из
рисунка 2 видно, что

где
раствора.
Подставляя
эти значения в выше записанное уравнение,
получим
откуда

Из
первого закона Рауля для сильно
разбавленных растворов имеем
откуда

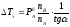
где
nА,
nВ,
mА
сохраняют ранее присвоенные обозначения
(см. выше). Если через М0А
обозначить молярную массу растворителя,
то
При
подстановке этого выражения в уравнение
(4) получим
Умножим
и разделим правую часть этого выражения
на 1000, тогда

Объединим
все постоянные величины в уравнении
(5) в одну постоянную К (
получим следующее выражение
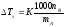
Выражение

Св.
Подставив
это выражение в уравнение (6), получим
окончательное уравнение.

Это
и есть математическое выражение второго
закона Рауля: понижение температуры
замерзания или повышение температуры
кипения растворов прямо пропорционально
его моляльной концентрации.
Коэффициент
К в уравнении (7) носит название
криоскопической постоянной, показывает
молярное понижение температуры замерзания
раствора, является индивидуальной
характеристикой растворителя (КН2О=1,86º)
и имеет ту же размерность, что и Е
(Кº·кг·моль-1)
Метод
исследования, основанный на измерении
понижения температуры замерзания
растворов, называется криоскопическим.
Он также, как и эбуллиоскопический
позволяет вычислить молярную массу
растворенного вещества
На
рис.3 изображен прибор, предназначенный
для измерения температуры замерзания
растворов.
ОСМОС
И ОСМОТИЧЕСКОЕ ДАВЛЕНИЕ.
Весьма
важным в биологическом отношении
свойством растворов является осмос.
В
природе часто растворы отделяются от
растворителя мембранами, проницаемыми
лишь дл я частиц растворителя. В этом
случае растворенное вещество диффундировать
в растворитель не может, и будет
наблюдаться только переход растворителя
в в раствор, т.е. растворитель будет
перемещаться в обоих направлениях, но
все же в раствор его будет переходить
немного больше, чем в обратном направлении.
Механизм
осмоса легко представить на основе
изотермической перегонки. Пусть
полупроницаемая мембрана, имеющая
микропоры, разделяет растворитель и
раствор с концентрацией Св
(рис.4)
рис.4
В
пору, ограниченную с одной стороны
растворителем, а с другой раствором,
идет испарение. Вследствие повышения
по закону Рауля упругости насыщенного
пара со стороны растворителя из
парообразной фазы концентрируется,
переходя в раствор.
В
результате осмоса увеличивается объем
раствора, и его концентрация постепенно
снижается; проникающий через мембрану
в раствор растворитель увеличивает
столб жидкости h
и, следовательно, повышает гидростатическое
давление (см. рис.5). Одновременно будет
возрастать число молекул растворителя,
перемещающихся через мембрану в обратном
направлении, т.е. из раствора в растворитель.
постепенно гидростатическое давление
и разбавление раствора достигнут
величин, при которых количество молекул
растворителя, перемещающихся в обоих
направлениях, уравняется и наступит
осмотическое равновесие. Развившееся
в результате осмоса избыточное
гидростатичекое давление, измеряемое
столбом раствора высотой h,
при котором устанавливается осмотическое
равновесие, называют осмотическим
давлением.

5
Полупроницаемыми
для многих растворов являются мембраны
из коллодия, целлофана, железистосинеродистой
меди и др.
ЗАКОНЫ
ОСМОТИЧЕСКОГО ДАВЛЕНИЯ.
Изучение
законов осмотического давления выявило
их полную аналогию с газовыми законами.
Для разбавленных растворов неэлектролитов
их можно сформулировать так:
при
постоянной температуре осмотическое
давление прямо пропорционально молярной
концентрации растворенного вещества
(аналогия с законом Бойля-Мариотта):
при
постоянной молярной концентрации
осмотическое давление прямо пропорционально
абсолютной температуре (аналогия с
законом Гей-Люссака):
Из
двух этих законов следует, что при
одинаковых молярных концентрациях и
температуре растворы разных неэлектролитов
создают одинаковое осмотическое
давление, т.е. эквимолярные растворы
неэлектролитов изотоничны (аналогия
с законом Авогадро).
Вант-Гоффом
был предложен объединенный закон для
осмотического давления в растворах
(аналогично объединенного газовому
закону Менделеева-Клайперона): Осмотическое
давление разбавленных растворов
неэлектролитов прямо пропорционально
молярной концентрации, коэффициенту
пропорциональности и абсолютной
температуре:
так
как с=n/V,
где n
– число молей неэлектролита, а V
– объем раствора, то

Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Температура кипения жидкости — это температура, при которой она превращается в пар. Жидкости превращаются в пар, когда их давление пара равно давлению окружающего воздуха. Давление паров жидкости — это давление, оказываемое жидкостью, когда ее жидкое и газообразное состояния достигли равновесия.
давление
Самым большим фактором, определяющим температуру кипения жидкости, является давление окружающей среды. В открытой системе внешнее давление — это, скорее всего, атмосфера Земли. Вода, например, достигает стандартного атмосферного давления при 100 градусах Цельсия. Эта мера принимается на уровне моря, где весь вес земной атмосферы давит на воду. По мере увеличения высоты вода может кипеть при более низкой температуре. На вершине горы Эверест вода кипит при температуре около 72 градусов по Цельсию.
Межмолекулярные связи
Когда мы рассматриваем другие жидкости, больше факторов помогает определить температуру кипения. Главным среди них является сила связей между молекулами. Этиловый спирт, например, имеет температуру кипения 78, 5 градусов по Цельсию на уровне моря. Это жидкость при комнатной температуре, и связи между ее молекулами сравнительно прочны. Метиловый эфир, напротив, имеет температуру кипения -25 градусов по Цельсию. При комнатной температуре и уровне моря метиловый эфир является газом.
Растворенные вещества, растворители и растворы
Эффективный способ повысить температуру кипения жидкости — добавить еще один ингредиент. В то время как вода на уровне моря имеет температуру кипения 100 градусов Цельсия, ее температуру кипения можно повысить, добавив растворенное вещество, такое как соль. Растворитель — это любое вещество, в котором растворяется другое. Вещество, которое растворяется, называется растворенным веществом. Когда растворенное вещество растворяется в растворителе, создается раствор. Раствор обычно кипит в более высокой точке, чем чистый растворитель.
Выводы
Самый простой способ изменить температуру кипения жидкости — это изменить окружающее давление. Использование замкнутой системы для искусственного повышения этого давления повысит температуру кипения жидкости. Понижение окружающего давления путем увеличения высоты или искусственного создания вакуума снизит температуру кипения той же жидкости. Температура кипения зависит от силы связей между его молекулами. По этой причине добавление растворенного вещества в жидкость создаст более прочные связи между молекулами, повышая температуру кипения раствора без увеличения давления.
Фазовые переходы
-
Темы кодификатора ЕГЭ: изменение агрегатных состояний вещества, плавление и кристаллизация, испарение и конденсация, кипение жидкости, изменение энергии в фазовых переходах.
-
Плавление и кристаллизация
-
График плавления
-
Удельная теплота плавления
-
График кристаллизации
-
Парообразование и конденсация
-
Кипение
-
График кипения
-
График конденсации
Автор статьи — профессиональный репетитор, автор учебных пособий для подготовки к ЕГЭ Игорь Вячеславович Яковлев
Темы кодификатора ЕГЭ: изменение агрегатных состояний вещества, плавление и кристаллизация, испарение и конденсация, кипение жидкости, изменение энергии в фазовых переходах.
Лёд, вода и водяной пар — примеры трёх агрегатных состояний вещества: твёрдого, жидкого и газообразного. В каком именно агрегатном состоянии находится данное вещество — зависит от его температуры и других внешних условий, в которых оно находится.
При изменении внешних условий (например, если внутренняя энергия тела увеличивается или уменьшается в результате нагревания или охлаждения) могут происходить фазовые переходы — изменения агрегатных состояний вещества тела. Нас будут интересовать следующие фазовые переходы.
• Плавление (твёрдое тело жидкость) и кристаллизация (жидкость
твёрдое тело).
• Парообразование (жидкость пар) и конденсация (пар
жидкость).
к оглавлению ▴
Плавление и кристаллизация
Большинство твёрдых тел являются кристаллическими, т.е. имеют кристаллическую решётку — строго определённое, периодически повторяющееся в пространстве расположение своих частиц.
Частицы (атомы или молекулы) кристаллического твёрдого тела совершают тепловые колебания вблизи фиксированных положений равновесия — узлов кристаллической решётки.
Например, узлы кристаллической решётки поваренной соли — это вершины кубических клеток «трёхмерной клетчатой бумаги» (см. рис. 1, на котором шарики большего размера обозначают атомы хлора (изображение с сайта en.wikipedia.org.)); если дать испариться воде из раствора соли, то оставшаяся соль будет нагромождением маленьких кубиков.
Рис. 1. Кристаллическая решётка
Плавлением называется превращение кристаллического твёрдого тела в жидкость. Расплавить можно любое тело — для этого нужно нагреть его до температуры плавления, которая зависит лишь от вещества тела, но не от его формы или размеров. Температуру плавления данного вещества можно определить из таблиц.
Наоборот, если охлаждать жидкость, то рано или поздно она перейдёт в твёрдое состояние. Превращение жидкости в кристаллическое твёрдое тело называется кристаллизацией или отвердеванием. Таким образом, плавление и кристаллизация являются взаимно обратными процессами.
Температура, при которой жикость кристаллизуется, называется температурой кристаллизации. Оказывается, что температура кристаллизации равна температуре плавления: при данной температуре могут протекать оба процесса. Так, при лёд плавится, а вода кристаллизуется; что именно происходит в каждом конкретном случае — зависит от внешних условий (например, подводится ли тепло к веществу или отводится от него).
Как происходят плавление и кристаллизация? Каков их механизм? Для уяснения сути этих процессов рассмотрим графики зависимости температуры тела от времени при его нагревании и охлаждении — так называемые графики плавления и кристаллизации.
к оглавлению ▴
График плавления
Начнём с графика плавления (рис. 2). Пусть в начальный момент времени (точка на графике) тело является кристаллическим и имеет некоторую температуру
.
Рис. 2. График плавления
Затем к телу начинает подводиться тепло (скажем, тело поместили в плавильную печь), и температура тела повышается до величины — температуры плавления данного вещества. Это участок
графика.
На участке тело получает количество теплоты
где — удельная теплоёмкость вещества твёрдого тела,
— масса тела.
При достижении температуры плавления (в точке ) ситуация качественно меняется. Несмотря на то, что тепло продолжает подводиться, температура тела остаётся неизменной. На участке
происходит плавление тела — его постепенный переход из твёрдого состояния в жидкое. Внутри участка
мы имеем смесь твёрдого вещества и жидкости, и чем ближе к точке
, тем меньше остаётся твёрдого вещества и тем больше появляется жидкости. Наконец, в точке
от исходного твёрдого тела не осталось ничего: оно полностью превратилось в жидкость.
Участок соответствует дальнейшему нагреванию жидкости (или, как говорят, расплава). На этом участке жидкость поглощает количество теплоты
где — удельная теплоёмкость жидкости.
Но нас сейчас больше всего интересует — участок фазового перехода. Почему не меняется температура смеси на этом участке? Тепло-то подводится!
Вернёмся назад, к началу процесса нагревания. Повышение температуры твёрдого тела на участке есть результат возрастания интенсивности колебаний его частиц в узлах кристаллической решётки: подводимое тепло идёт на увеличение кинетической энергии частиц тела (на самом деле некоторая часть подводимого тепла расходуется на совершение работы по увеличению средних расстояний между частицами — как мы знаем, тела при нагревании расширяются. Однако эта часть столь мала, что её можно не принимать во внимание.).
Кристаллическая решётка расшатывается всё сильнее и сильнее, и при температуре плавления размах колебаний достигает той предельной величины, при которой силы притяжения между частицами ещё способны обеспечивать их упорядоченное расположение друг относительно друга. Твёрдое тело начинает «трещать по швам», и дальнейшее нагревание разрушает кристаллическую решётку — так начинается плавление на участке .
С этого момента всё подводимое тепло идёт на совершение работы по разрыву связей, удерживающих частицы в узлах кристаллической решётки, т.е. на увеличение потенциальной энергии частиц. Кинетическая энергия частиц при этом остаётся прежней, так что температура тела не меняется. В точке кристаллическая структура исчезает полностью, разрушать больше нечего, и подводимое тепло снова идёт на увеличение кинетической энергии частиц — на нагревание расплава.
к оглавлению ▴
Удельная теплота плавления
Итак, для превращения твёрдого тела в жидкость мало довести его до температуры плавления. Необходимо дополнительно (уже при температуре плавления) сообщить телу некоторое количество теплоты для полного разрушения кристаллической решётки (т.е. для прохождения участка
).
Это количество теплоты идёт на увеличение потенциальной энергии взаимодействия частиц. Следовательно, внутренняя энергия расплава в точке больше внутренней энергии твёрдого тела в точке
на величину
.
Опыт показывает, что величина прямо пропорциональна массе тела:
Коэффициент пропорциональности не зависит от формы и размеров тела и является характеристикой вещества. Он называется удельной теплотой плавления вещества. Удельную теплоту плавления данного вещества можно найти в таблицах.
Удельная теплота плавления численно равна количеству теплоты, необходимому для превращения в жидкость одного килограмма данного кристаллического вещества, доведённого до температуры плавления.
Так, удельная теплота плавления льда равна кДж/кг, свинца —
кДж/кг. Мы видим, что для разрушения кристаллической решётки льда требуется почти в
раз больше энергии! Лёд относится к веществам с большой удельной теплотой плавления и поэтому весной тает не сразу (природа приняла свои меры: обладай лёд такой же удельной теплотой плавления, как и свинец, вся масса льда и снега таяла бы с первыми оттепелями, затопляя всё вокруг).
к оглавлению ▴
График кристаллизации
Теперь перейдём к рассмотрению кристаллизации — процесса, обратного плавлению. Начинаем с точки предыдущего рисунка. Предположим, что в точке
нагревание расплава прекратилось (печку выключили и расплав выставили на воздух). Дальнейшее изменение температуры расплава представлено на рис. (3).
Рис. 3. График кристаллизации
Жидкость остывает (участок ), пока её температура не достигнет температуры кристаллизации, которая совпадает с температурой плавления
.
С этого момента температура расплава меняться перестаёт, хотя тепло по-прежнему уходит от него в окружающую среду. На участке происходит кристаллизация расплава — его постепенный переход в твёрдое состояние. Внутри участка
мы снова имеем смесь твёрдой и жидкой фаз, и чем ближе к точке
, тем больше становится твёрдого вещества и тем меньше — жидкости.Наконец,вточке
жидкостинеостаётсявовсе—онаполностьюкристаллизовалась.
Следующий участок соответствует дальнейшему остыванию твёрдого тела, возникшего в результате кристаллизации.
Нас опять-таки интересует участок фазового перехода : почему температура остаётся неизменной, несмотря на уход тепла?
Снова вернёмся в точку . После прекращения подачи тепла температура расплава понижается, так как его частицы постепенно теряют кинетическую энергию в результате соударений с молекулами окружающей среды и излучения электромагнитных волн.
Когда температура расплава понизится до температуры кристаллизации (точка ), его частицы замедлятся настолько, что силы притяжения окажутся в состоянии «развернуть» их должным образом и придать им строго определённую взаимную ориентацию в пространстве. Так возникнут условия для зарождения кристаллической решётки, и она действительно начнёт формироваться благодаря дальнейшему уходу энергии из расплава в окружающее пространство.
Одновременно начнётся встречный процесс выделения энергии: когда частицы занимают свои места в узлах кристаллической решётки, их потенциальная энергия резко уменьшается, за счёт чего увеличивается их кинетическая энергия — кристаллизующаяся жидкость является источником тепла (часто у проруби можно увидеть сидящих птиц. Они там греются!). Выделяющееся в ходе кристаллизации тепло в точности компенсирует потерю тепла в окружающую среду, и потому температура на участке не меняется.
В точке расплав исчезает, а вместе с завершением кристаллизации исчезает и этот внутренний «генератор» тепла. Вследствие продолжающегося рассеяния энергии во внешнюю среду понижение температуры возобновится, но только остывать уже будет образовавшееся твёрдое тело (участок
).
Как показывает опыт, при кристаллизации на участке выделяется ровно то же самое количество теплоты
, которое было поглощено при плавлении на участке
.
к оглавлению ▴
Парообразование и конденсация
Парообразование — это переход жидкости в газообразное состояние (в пар). Существует два способа парообразования: испарение и кипение.
Испарением называется парообразование, которое происходит при любой температуре со свободной поверхности жидкости. Как вы помните из листка «Насыщенный пар», причиной испарения является вылет из жидкости наиболее быстрых молекул, которые способны преодолеть силы межмолекулярного притяжения. Эти молекулы и образуют пар над поверхностью жидкости.
Разные жидкости испаряются с разными скоростями: чем больше силы притяжения молекул друг к другу — тем меньшее число молекул в единицу времени окажутся в состоянии их преодолеть и вылететь наружу, и тем меньше скорость испарения. Быстро испаряются эфир, ацетон, спирт (их иногда называют летучими жидкостями), медленнее — вода, намного медленнее воды испаряются масло и ртуть.
Скорость испарения растёт с повышением температуры (в жару бельё высохнет скорее), поскольку увеличивается средняя кинетическая энергия молекул жидкости, и тем самым возрастает число быстрых молекул, способных покинуть её пределы.
Скорость испарения зависит от площади поверхности жидкости: чем больше площадь, тем большее число молекул получают доступ к поверхности, и испарение идёт быстрее (вот почему при развешивании белья его тщательно расправляют).
Одновременно с испарением наблюдается и обратный процесс: молекулы пара, совершая беспорядочное движение над поверхностью жидкости, частично возвращаются обратно в жидкость. Превращение пара в жидкость называется конденсацией.
Конденсация замедляет испарение жидкости. Так, в сухом воздухе бельё высохнет быстрее, чем во влажном. Быстрее оно высохнет и на ветру: пар сносится ветром, и испарение идёт более интенсивно
В некоторых ситуациях скорость конденсации может оказаться равной скорости испарения. Тогда оба процесса компенсируют друг друга и наступает динамическое равновесие: из плотно закупоренной бутылки жидкость не улетучивается годами, а над поверхностью жидкости в этом случае находится насыщенный пар.
Конденсацию водяного пара в атмосфере мы постоянно наблюдаем в виде облаков, дождей и выпадающей по утрам росы; именно испарение и конденсация обеспечивают круговорот воды в природе, поддерживая жизнь на Земле.
Поскольку испарение — это уход из жидкости самых быстрых молекул, в процессе испарения средняя кинетическая энергия молекул жидкости уменьшается, т.е. жидкость остывает. Вам хорошо знакомо ощущение прохлады и порой даже зябкости (особенно при ветре), когда выходишь из воды: вода, испаряясь по всей поверхности тела, уносит тепло, ветер же ускоряет процесс испарения (nеперь понятно, зачем мы дуем на горячий чай. Кстати сказать, ещё лучше при этом втягивать воздух в себя, поскольку на поверхность чая тогда приходит сухой окружающий воздух, а не влажный воздух из наших лёгких ;-)).
Ту же прохладу можно почувствовать, если провести по руке кусочком ваты, смоченным в летучем растворителе (скажем, в ацетоне или жидкости для снятия лака). В сорокаградусную жару благодаря усиленному испарению влаги через поры нашего тела мы сохраняем свою температуру на уровне нормальной; не будь этого терморегулирующего механизма, в такую жару мы бы попросту погибли.
Наоборот, в процессе конденсации жидкость нагревается: молекулы пара при возвращении в жидкость разгоняются силами притяжения со стороны находящихся поблизости молекул жидкости, в результате чего средняя кинетическая энергия молекул жидкости увеличивается (сравните это явление с выделением энергии при кристаллизации расплава!).
к оглавлению ▴
Кипение
Кипение — это парообразование, происходящее по всему объёму жидкости.
Кипение оказывается возможным потому, что в жидкости всегда растворено какое-то количество воздуха, попавшего туда в результате диффузии. При нагревании жидкости этот воздух расширяется, пузырьки воздуха постепенно увеличиваются в размерах и становятся видимы невооружённым глазом (в кастрюле с водой они осаждают дно и стенки). Внутри воздушных пузырьков находится насыщенный пар, давление которого, как вы помните, быстро растёт с повышением температуры.
Чем крупнее становятся пузырьки, тем большая действует на них архимедова сила, и определённого момента начинается отрыв и всплытие пузырьков. Поднимаясь вверх, пузырьки попадают в менее нагретые слои жидкости; пар в них конденсируется, и пузырьки сжимаются опять. Схлопывание пузырьков вызывает знакомый нам шум, предшествующий закипанию чайника. Наконец, с течением времени вся жидкость равномерно прогревается, пузырьки достигают поверхности и лопаются, выбрасывая наружу воздух и пар — шум сменяется бульканьем, жидкость кипит.
Пузырьки, таким образом, служат «проводниками» пара изнутри жидкости на её поверхность. При кипении наряду с обычным испарением идёт превращение жидкости в пар по всему объёму — испарение внутрь воздушных пузырьков с последующим выводом пара наружу. Вот почему кипящая жидкость улетучивается очень быстро: чайник, из которого вода испарялась бы много дней, выкипит за полчаса.
В отличие от испарения, происходящего при любой температуре, жидкость начинает кипеть только при достижении температуры кипения — именно той температуры, при которой пузырьки воздуха оказываются в состоянии всплыть и добраться до поверхности. При температуре кипения давление насыщенного пара становится равно внешнему давлению на жидкость (в частности, атмосферному давлению). Соответственно, чем больше внешнее давление, тем при более высокой температуре начнётся кипение.
При нормальном атмосферном давлении ( атм или
Па) температура кипения воды равна
. Поэтому давление насыщенного водяного пара при температуре
равно
Па. Этот факт необходимо знать для решения задач — часто он считается известным по умолчанию.
На вершине Эльбруса атмосферное давление равно атм, и вода там закипит при температуре
. А под давлением
атм вода начнёт кипеть только при
.
Температура кипения (при нормальном атмосферном давлении) является строго определённой для данной жидкости величиной (температуры кипения, приводимые в таблицах учебников и справочников — это температуры кипения химически чистых жидкостей. Наличие в жидкости примесей может изменять температуру кипения. Скажем, водопроводная вода содержит растворённый хлор и некоторые соли, поэтому её температура кипения при нормальном атмосферном давлении может несколько отличаться от ). Так, спирт кипит при
, эфир — при
, ртуть — при
. Обратите внимание: чем более летучей является жидкость, тем ниже её температура кипения. В таблице температур кипения мы видим также, что кислород кипит при
. Значит, при обычных температурах кислород — это газ!
Мы знаем, что если чайник снять с огня, то кипение тут же прекратится — процесс кипения требует непрерывного подвода тепла. Вместе с тем, температура воды в чайнике после закипания перестаёт меняться, всё время оставаясь равной . Куда же при этом девается подводимое тепло?
Ситуация аналогична процессу плавления: тепло идёт на увеличение потенциальной энергии молекул. В данном случае — на совершение работы по удалению молекул на такие расстояния, что силы притяжения окажутся неспособными удерживать молекулы неподалёку друг от друга, и жидкость будет переходить в газообразное состояние.
к оглавлению ▴
График кипения
Рассмотрим графическое представление процесса нагревания жидкости — так называемый график кипения (рис. 4).
Рис. 4. График кипения
Участок предшествует началу кипения. На участке
жидкость кипит, её масса уменьшается. В точке
жидкость выкипает полностью.
Чтобы пройти участок , т.е. чтобы жидкость, доведённую до температуры кипения, полностью превратить в пар, к ней нужно подвести некоторое количество теплоты
. Опыт показывает, что данное количество теплоты прямо пропорционально массе жидкости:
Коэффициент пропорциональности называется удельной теплотой парообразования жидкости (при температуре кипения). Удельная теплота парообразования численно равна количеству теплоты, которое нужно подвести к 1 кг жидкости, взятой при температуре кипения, чтобы полностью превратить её в пар.
Так, при удельная теплота парообразования воды равна
кДж/кг. Интересно сравнить её с удельной теплотой плавления льда (
кДж/кг) — удельная теплота парообразования почти в семь раз больше! Это и не удивительно: ведь для плавления льда нужно лишь разрушить упорядоченное расположение молекул воды в узлах кристаллической решётки; при этом расстояния между молекулами остаются примерно теми же. А вот для превращения воды в пар нужно совершить куда большую работу по разрыву всех связей между молекулами и удалению молекул на значительные расстояния друг от друга.
к оглавлению ▴
График конденсации
Процесс конденсации пара и последующего остывания жидкости выглядит на графике симметрично процессу нагревания и кипения. Вот соответствующий график конденсации для случая стоградусного водяного пара, наиболее часто встречающегося в задачах (рис. 5).
Рис. 5. График конденсации
В точке имеем водяной пар при
. На участке
идёт конденсация; внутри этого участка — смесь пара и воды при
. В точке
пара больше нет, имеется лишь вода при
. Участок
— остывание этой воды.
Опыт показывает, что при конденсации пара массы (т. е. при прохождении участка
) выделяется ровно то же самое количество теплоты
, которое было потрачено на превращение в пар жидкости массы
при данной температуре.
Давайте ради интереса сравним следующие количества теплоты:
• , которое выделяется при конденсации
г водяного пара;
• , которое выделяется при остывании получившейся стоградусной воды до температуры, скажем,
.
Имеем:
Дж;
Дж.
Эти числа наглядно показывают, что ожог паром гораздо страшнее ожога кипятком. При попадании на кожу кипятка выделяется «всего лишь» (кипяток остывает). А вот при ожоге паром сначала выделится на порядок большее количество теплоты
(пар конденсируется), образуется стоградусная вода, после чего добавится та же величина
при остывании этой воды.
Спасибо за то, что пользуйтесь нашими статьями.
Информация на странице «Фазовые переходы» подготовлена нашими редакторами специально, чтобы помочь вам в освоении предмета и подготовке к экзаменам.
Чтобы успешно сдать необходимые и поступить в ВУЗ или техникум нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими статьями из разделов нашего сайта.
Публикация обновлена:
07.02.2023




























