Температура кипения: особенности
Кипение — казалось бы, простой физический процесс, известный каждому, хоть раз в жизни вскипятившему чайник. Однако у него есть немало особенностей, которые физики изучают в лабораториях, а хозяйки — на кухнях. Даже температура кипения далеко не постоянна, а меняется в зависимости от различных факторов.

При кипении жидкость начинается интенсивно превращаться в пар, в ней образуются паровые пузырьки, поднимающиеся на поверхность. При нагревании сначала пар появляется только на поверхности жидкости, затем этот процесс начинается по всему объему. Появляются мелкие пузырьки на дне и стенках посуды. При повышении температуры давление внутри пузырей возрастает, они увеличиваются и поднимаются вверх.
Когда температура достигает так называемой точки кипения, начинается бурное образование пузырьков, их становится много, жидкость закипает. Образуется пар, температура которого остается постоянной, пока не выкипит вся вода. Если парообразование происходит в обычных условиях, при стандартом давлении 100 мПа, его температура равна 100оС. Если же искусственно увеличить давление, можно получить перегретый пар. Ученым удалось нагреть водяной пар до температуры 1227оС, при дальнейшем нагреве диссоциация ионов превращает пар в плазму.
При заданном составе и постоянном давлении температура кипения любой жидкости постоянна. В учебниках и пособиях по физике можно увидеть таблицы, указывающие температуру кипения различных жидкостей и даже металлов. Например, вода закипает при температуре 100оС, этиловый спирт при 78,3оС, эфир при 34,6оС, золото при 2600оС, а серебро при 1950оС. Это данные для стандартного давления 100 мПа, оно рассчитывается на уровне моря.
Если давление снижается, температура кипения уменьшается, даже если состав остается прежним. Это значит, что если подняться с котелком воды на гору высотой 4000 метров и поставить ее на костер, вода закипит при 85оС, для этого понадобится гораздо меньше дров, чем внизу.
Хозяйкам будет интересно сравнение со скороваркой, в которой давление искусственно увеличивается. Температура кипения воды при этом также увеличивается, за счет чего пища готовится гораздо быстрее. Современные скороварки позволяют плавно изменять температуру кипения от 115 до 130оС и более.
Еще один секрет температуры кипения воды заключается в ее составе. Жесткая вода, в состав которой входят различные соли, закипает дольше и требует для нагрева больше энергии. Если добавить в литр воды две столовые ложки соли, температура кипения ее увеличится на 10оС. То же самое можно сказать о сахаре, 10% сахарный сироп закипает при температуре 100,1оС.
Содержание статьи
- 1 Что такое кипение Автоклав
- 1.1 Как изменить температуру кипения
- 1.2 Автоклав
Что такое кипение Автоклав

По мере испарения пузырьки пара растут и затем часть их отрывается, под действием выталкивающей силы жидкости прорывается к ее поверхности и пар выходит наружу. Этот процесс называется кипением жидкости.
Температура, при которой начинается этот процесс, называется температурой кипения жидкости и определяется как температура, при которой давление насыщающего пара делается равным давлению в жидкости (для жидкости в открытом сосуде — это атмосферное давление).
Как изменить температуру кипения
Изменяя давление, под которым находится жидкость, можно изменить температуру ее кипения в широких пределах. При понижении давления вода может кипеть при низкой, например, комнатной температуре. Наоборот, при значительном повышении давления температура кипения воды достигает нескольких сот градусов.
Зависимость температуры кипения воды от давления приведена в таблице.
| Давление в am | 1 | 2 | 3 | 5 | 10 | 20 | 100 |
| Температура кипения в °С | 100 | 120 | 133 | 151 | 180 | 210 | 310 |
Температуры кипения некоторых жидкостей при атмосферном давлении приведены в таблице на стр. 110.
Зависимость температуры кипения от давления используется в приборах, называемых автоклавами, которые широко применяются в химической и пищевой промышленности, а также в медицине. Автоклав служит для обработки (в медицине для дезинфекции) различных материалов паром под давлением и при температурах выше 100° С.
Автоклав
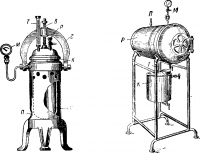
Котел устанавливается на подставке П и подогревается мощной газовой горелкой. В котел наливается некоторое количество воды и над ней на подставке помещается коробка с подвергаемыми действию пара материалами. Давление пара в автоклаве достигает нескольких атмосфер, температура кипения повышается до 120—130° С.
Медицинский автоклав с электрическим подогревом (рис. 2 б) имеет отдельный котел К и рабочую камеру Р, которые соединены патрубками Т. Вся система герметически закрывается крышками. Рабочая камера автоклава оборудована предохранительным клапаном П и манометром М.
Котел имеет электрический подогрев, пар, образовавшийся в котле, по патрубку поступает в камеру и вся система работает как одно целое. Автоклав рассчитан на стерилизацию материала паром при давлении в 2 am, что соответствует температуре в 120° С.
Понравилась статья поделись ей
Кипение воды
Внеурочная деятельность (конкурсные работы)
Линия УМК А.В. Перышкина. Физика (7-9)
Физика
Внеурочная деятельность
Внимание! Администрация сайта rosuchebnik.ru не несет ответственности за содержание методических разработок, а также за соответствие разработки ФГОС.
- Участник: Ярославцев Максим Александрович
- Руководитель: Трубенко Фаина Ивановна
Опыт 1. А.В. Перышкин. Физика 8, § 18.
|
Техника безопасности |
Правила безопасности при работе со спиртовкой и стеклянной посудой. |
|
|
Цель эксперимента |
Наблюдать процесс кипения воды и описать основные явления, которые сопровождают процесс кипения воды. |
|
|
Гипотеза: |
Процесс кипения сопровождается рядом удивительных явлений |
|
|
Оборудование: |
Фото |
|
|
|
|
|
Описание опыта |
Результаты опыта |
Объяснение |
|
В лапке штатива закрепляем колбу с водой, снизу поместим спиртовку. Зажигаем спиртовку и наблюдаем за процессами, происходящими в колбе. |
1. Идет обильное испарение с поверхности жидкости, над горлышком колбы образуется туман. |
1. Пар невидимый, но при попадании в холодную среду (наружный воздух) происходит конденсация пара и образуется туман. |
|
2. На внутренней поверхности стенок образуются и начинают расти пузырьки. |
2. Пузырьки содержат воздух, растворенный в воде и водяной пар, который образуется за счет испарения воды внутрь пузырьков. |
|
|
3. Пузырьки увеличиваются в размерах, отрываются от стенок колбы, поднимаются вверх и исчезают. |
3.В холодных непрогретых слоях воды происходит конденсация пара. |
|
|
4. Возникает шум предшествующий закипанию воды. |
4. Шум вызван попеременным уменьшением и увеличением пузырьков в размерах, вода постепенно полностью прогревается. |
|
|
5. Пузырьки всплывают на поверхность, лопаются, слышно как булькает вода, кипит. |
5.Пузырьки всплывают на поверхность под действием архимедовой силы, насыщенный пар из пузырьков выбрасывается в атмосферу. |
Опыт 2. Кипение воды при пониженном давлении
Жидкость закипит, если давление насыщенного пара в пузырьках будет больше суммы гидростатического давления жидкости и атмосферного давлении:
рнас. п. > ρgh + ратм.
Из этого выражения вытекает, что изменив внешнее давление над водой можно изменить температуру кипения воды: при уменьшении внешнего давления температура кипения понижается, а при увеличении давления — повышается. Докажем этот вывод на опыте.
| Техника безопасности |
Правила безопасности при работе со стеклянной посудой |
|
|
Цель эксперимента |
Наблюдать процесс кипения воды в условиях пониженного давления |
|
|
Гипотеза: |
При уменьшении внешнего давления температура кипения понижается |
|
|
Опыт 2 |
||
|
Оборудование: |
Фото |
|
|
|
|
|
Описание опыта |
Результаты опыта |
Объяснение |
|
А) Измеряем начальную температуру в колбе. |
Начальная температура воды 30 °С. |
Когда из колбы выкачиваем воздух, то давление над жидкостью уменьшается, процесс роста пузырьков начинается при меньшем давлении, что сказывается на понижение температуры кипения. |
|
б) В лапке штатива закрепляем колбу с водой, закрываем резиновой пробкой со стеклянной трубкой. Соединим с помощью резинового шланга колбу с насосом. Из колбы выкачиваем воздух. |
В воде образуются пузырьки, они поднимаются на поверхность воды, лопаются, вода закипает |
|
|
в) Измеряем температуру воды после кипения. |
Конечная температура воды 29 °С (понижение температуры вызвано теплоотдачей воды окружающей среде). |
Опыт 3. Задача № 862 (снег заменен холодной водой)
(А.Е. Марон, Е.А. Марон, С. В. Позойский. Сборник вопросов и задач Физика 7-9 к учебнику А.В. Перышкина)
|
Оборудование: |
Фото |
|
|
|
|
|
Описание опыта |
Результаты опыта |
Объяснение |
|
В колбе доведем воду до кипения. Убираем спиртовку, закрываем колбу плотно резиновой пробкой. Переворачиваем колбу с водой, надежно ее закрепляем в лапке штатива. Сверху колбу обливаем холодной водой |
В воде образуются пузырьки воздуха, вода закипает. |
Холодная вода охлаждает горячий воздух над водой в колбе, его давление над жидкостью уменьшается. Вода кипит при температуре ниже 100°С. |
|
Применение рассматриваемого явления на практике. |
|
|
Природные явления |
Гейзеры – одно из самых удивительных явлений природы, это периодически фонтанирующие источники горячей воды с паром. |
|
Интересные факты в рассматриваемом явлении |
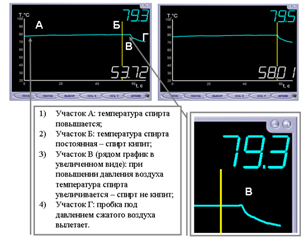
Интересная задача из задачника 861(опыт со шприцем). Ее можно продемонстрировать на оборудовании L-микро. Наблюдение кипения спирта: пробирку со спиртом помещают в сосуд с кипящей водой, фиксируют температуру кипения воды, с помощью шприца повышают давление над спиртом, на графике при этом видно увеличение температуры кипения спирта (в углу графика t кип. при обычном и повышенном давлениях).
|
|
Кипение дистиллированной воды. Дистиллированная вода – это очищенная вода H2O, в которой практически не содержится каких-либо примесей. В чистую колбу наливаем дистиллированную воду и начинаем нагревать на медленном огне. С помощью электронного термометра измеряем температуру пара над водой (рис.1). Видим, что при температуре 100 °С вода не кипит. Убираем спиртовку, и в перегретую воду бросим кусочки мела (рис.2), на ее поверхности сразу образуются пузырьки. Видим бурное закипание воды (рис.3).
рис. 1
рис.2
рис.3 |
|
|
Ссылка на видео https://cloud.mail.ru/public/4k82/e7MeqkpeB (Облако Mail.Ru)
Видео содержит все фрагменты:
- Кипение воды;
- Кипение при пониженном давлении (с помощью насоса и холодной воды);
- Кипение дистиллированной воды.
Тема: Тепловые явления
Хотите сохранить материал на будущее? Отправьте себе на почту
Температура кипения жидкости — это температура, при которой она превращается в пар. Жидкости превращаются в пар, когда их давление пара равно давлению окружающего воздуха. Давление паров жидкости — это давление, оказываемое жидкостью, когда ее жидкое и газообразное состояния достигли равновесия.
давление
Самым большим фактором, определяющим температуру кипения жидкости, является давление окружающей среды. В открытой системе внешнее давление — это, скорее всего, атмосфера Земли. Вода, например, достигает стандартного атмосферного давления при 100 градусах Цельсия. Эта мера принимается на уровне моря, где весь вес земной атмосферы давит на воду. По мере увеличения высоты вода может кипеть при более низкой температуре. На вершине горы Эверест вода кипит при температуре около 72 градусов по Цельсию.
Межмолекулярные связи
Когда мы рассматриваем другие жидкости, больше факторов помогает определить температуру кипения. Главным среди них является сила связей между молекулами. Этиловый спирт, например, имеет температуру кипения 78, 5 градусов по Цельсию на уровне моря. Это жидкость при комнатной температуре, и связи между ее молекулами сравнительно прочны. Метиловый эфир, напротив, имеет температуру кипения -25 градусов по Цельсию. При комнатной температуре и уровне моря метиловый эфир является газом.
Растворенные вещества, растворители и растворы
Эффективный способ повысить температуру кипения жидкости — добавить еще один ингредиент. В то время как вода на уровне моря имеет температуру кипения 100 градусов Цельсия, ее температуру кипения можно повысить, добавив растворенное вещество, такое как соль. Растворитель — это любое вещество, в котором растворяется другое. Вещество, которое растворяется, называется растворенным веществом. Когда растворенное вещество растворяется в растворителе, создается раствор. Раствор обычно кипит в более высокой точке, чем чистый растворитель.
Выводы
Самый простой способ изменить температуру кипения жидкости — это изменить окружающее давление. Использование замкнутой системы для искусственного повышения этого давления повысит температуру кипения жидкости. Понижение окружающего давления путем увеличения высоты или искусственного создания вакуума снизит температуру кипения той же жидкости. Температура кипения зависит от силы связей между его молекулами. По этой причине добавление растворенного вещества в жидкость создаст более прочные связи между молекулами, повышая температуру кипения раствора без увеличения давления.
Муниципальное
бюджетное общеобразовательное учреждение
«Средняя общеобразовательная школа № 24» г.
Абакана
Кипение воды
Выполнил: ученик 8 «Г»
класса
Гончаров Игорь
Проверил:
Камских
Андрей Васильевич
Абакан
2020 г.
Оглавление
Введение
1. Кипение: понятие,
особенности
1.1 Определение
понятия «Кипение»
1.2 Термодинамические
особенности
1.3 Режимы кипения
2. Практическая часть
2.1 Проведение опыта
«Кипение воды в различных емкостях»
Заключение
Литература
Приложения
ВВЕДЕНИЕ
Тема кипения является актуальной,
потому что с этим физическим процессом мы сталкиваемся каждый день.
Кипение —
процесс интенсивного парообразования, который происходит в жидкости, как
на свободной её поверхности, так и внутри её структуры.
Цель –
изучить процесс кипения с проведением практических опытов.
Задачи:
— описать кипение как физический
процесс;
— проанализировать термодинамические
особенности данного процесса;
— провести опыты «Кипение жидкости в
разных ёмкостях».
Объект:
кипение воды.
Предмет:
процесс кипения жидкостей.
Гипотеза: вода
в сосуде должна закипеть, если она будет находиться при температуре кипения.
Методы исследования:
изучение учебной и научно-популярной литературы; физический эксперимент.
1.
Кипение: понятие,
особенности
1.1 Определение понятия
«Кипение»
Кипение —
процесс интенсивного парообразования, который происходит в жидкости, как
на свободной её поверхности, так и внутри её структуры. При этом в объёме
жидкости возникают границы разделения фаз, то есть на стенках сосуда
образуются пузырьки, которые содержат в воздухе насыщенный пар.
Кипение, как и испарение, является одним из способов парообразования. В
отличие от испарения, кипение может происходить лишь при
определённой температуре и давлении. Температура, при которой
происходит кипение жидкости, находящейся под постоянным давлением,
называется температурой кипения. Как правило, температура кипения при
нормальном атмосферном давлении приводится как одна из основных характеристик
химически чистых веществ. Процессы кипения широко применяются в различных
областях человеческой деятельности. Например, кипячение является
одним из распространённых способов физической дезинфекции питьевой
воды. Кипячение воды представляет собой процесс нагревания её до температуры
кипения с целью получения кипятка.
Кипение является фазовым переходом первого
рода. Кипение происходит гораздо более интенсивно, чем испарение с
поверхности, из-за присутствия очагов парообразования, обусловленных как более
высокой температурой достигаемой в процессе кипения, так и наличием примесей.
1.2
Термодинамические особенности
По мере нагрева жидкости
на греющей поверхности образуются пузырьки пара, внутрь которых испаряется
жидкость. В обычной жидкости(не очищенной от мельчайших пузырьков газов) при
термодинамическом равновесии парциальное давление паров в пузырьке равно
давлению насыщенных паров при этой температуре.
При
увеличении температуры увеличивается давление насыщенных паров. Из постоянства
атмосферного и «внутрипузырькового» давлений следует, что должно
уменьшиться парциальное давление сухих газов в пузырьке, что говорит о
увеличении объёма пузыря. Когда давление насыщенных паров доходит до
атмосферного, давление сухих газов должно стать равным нулю. Из уравнения
Менделеева-Клапейрона видно, что для этого объём пузырька должен стать бесконечным
(пузырёк начинает непрерывно расширяться). При достижении температуры кипения в
жидкостях из-за описанного процесса начинается непрерывное бульканье,
увеличивающее во много раз скорость испарения (так как сильно увеличивается
площадь жидкости, с которой происходит испарение). Когда процесс кипения
начался, то несмотря на продолжающийся подвод тепла, температура жидкости
изменяется незначительно, пока вся жидкость не превратится в пар. Температура,
при которой происходит кипение жидкости, находящейся под постоянным давлением,
называется температурой кипения или температурой насыщения.
Начало
кипения жидкости связано с прогревом пристенных слоев жидкости до
температуры, превышающей температуру насыщения на определенную величину . Величина
перегрева зависит от многих факторов (давления, скорости течения жидкости,
краевого угла смачивания, концентрации растворенных в жидкости веществ и т.д.)
и в общем виде не определяется. В зависимости от плотности теплового потока, а
также других факторов, на поверхности обогрева образуются отдельные паровые
пузыри, или сплошная плёнка пара, и кипение называется либо пузырьковым либо
пленочным. Кроме того, кипение различают по типу:
·
кипение при свободной конвекции в большом
объёме;
·
кипение при вынужденной конвекции.
А
также по отношению средней температуры жидкости к температуре насыщения:
·
кипение жидкости, недогретой до
температуры насыщения (поверхностное кипение);
·
кипение жидкости, догретой до температуры
насыщения.
1.3
Режимы
кипения
Пузырьковое кипение
При пузырьковом
кипении жидкость непосредственно омывает поверхность нагрева, причем ее
пограничный слой интенсивно разрушается (турбулизуется) возникающими паровыми
пузырями. Кроме того, всплывающие пузыри увлекают из пристенного слоя в ядро
потока присоединенную массу перегретой жидкости, что создает интенсивный
перенос теплоты от поверхности нагрева к общей массе кипящей жидкости.
Следствием этого является высокая интенсивность теплоотдачи при пузырьковом
кипении, возрастающая с увеличением числа действующих центров парообразования и
количества образующегося пара.
Пленочное кипение
При пленочном
кипении жидкость отделена от поверхности нагрева слоем пара, с внешней
стороны которого время от времени отрываются и всплывают крупные пузыри. Вследствие
относительно малой теплопроводности парового слоя интенсивность теплоотдачи
при пленочном кипении существенно меньше, чем при пузырьковом.
Условия возникновения и перехода от
одного режима к другому
Возникновение того или иного вида
кипения определяется плотностью теплового потока у поверхности нагрева, ее
физическими свойствами (в частности смачиваемостью), физическими свойствами
жидкости и гидродинамическим режимом потока в целом. Таким образом приходится говорить
о существовании двух критических плотностях теплового потока. Первая
критическая плотность теплового потока – при которой происходит переход
от пузырькового кипения к пленочному, вторая – при которой происходит
разрушение сплошного парового слоя и восстановление пузырькового режима
кипения. В области значений плотности теплового потока, лежащих между двумя
этими критическими значениями возможно устойчивое существование обоих режимов
кипения или даже их длительное совместное сосуществование на разных частях
одной и той же поверхности нагрева.
Паровая пленка обычно возникает в
отдельных местах поверхности нагрева при достижении значений теплового потока
выше критического и далее с конечной скоростью распространяется по всей
поверхности нагрева. Аналогично при снижении теплового потока до значений
меньше критического, происходят локальные разрушения пленки с последующим
распространением пузырькового кипения на всю поверхность нагрева. На
поверхностях нагрева, объединённых центрами парообразования, процесс кипения
имеет нестабильный характер, а интенсивность теплообмена колеблется между
условиями конвекции однофазного потока и развитого пузырькового кипения. При
этом возможен непосредственный переход от однофазной конвекции жидкости к
режиму пленочного кипения.
Применение в теплообменной технике
Изучение условий, при которых
возникают различные режимы кипения необходимо для расчета теплообменников,
используемых в качестве испарителей. При появлении пленочного режима
кипения, эффективность работы испарителя падает и температура охлаждаемой среды
на выходе из теплообменника оказывается выше заданной. Поэтому при расчете и
подборе таких аппаратов очень важным является определение плотности тепловых
потоков между двумя средами.
Механизм кипения
Кипение — процесс парообразования, то
есть перехода вещества из жидкой фазы в газообразную. От испарения кипение
отличается тем, что процесс парообразования происходит не только на
поверхности, но и по всему объёму жидкости. И если испарение происходит при
любой температуре, то кипение — при строго определенной температуре (которая
называется температурой кипения) и давлении. Для того чтобы жидкость закипела,
нужно чтобы ей было куда испаряться (так называемые центры кипения). Конечно,
жидкость может испаряться с поверхности, но этот процесс не является кипением.
Для кипения необходимо что-то, куда жидкость могла бы испаряться внутри своего
объёма — пустое пространство. Как правило, это растворённый в жидкости воздух,
который располагается, например, в мельчайших неровностях тары. Также часто
пузыри воздуха находятся в порах накипи в чайнике. При увеличении
температуры увеличивается объём пузырьков. Под действием силы Архимеда (которая
гласит, что на тело, погружённое в жидкость, действует выталкивающая сила
равная весу объёма жидкости, вытесненного телом) они отрываются от внутренней
поверхности сосуда и начинают всплывать.
Всплывая, пузырек попадает в верхние
слои жидкости, которые ещё недостаточно прогрелись. В результате этого давление
в пузырьке падает, и он схлопывается. В этом случае слышатся характерные
щелчки, называемые кавитационными. Их слышно, когда вода только начинает
закипать, но ещё не вскипела.
Когда все слои жидкости достаточно
прогреются, пузырьки перестают схлопываться и всплывать на поверхность. Вода
начинает булькать.
Существует такое понятие, как
перегретая вода. Это такое ее состояние, когда она достигла температуры
кипения, но не может закипеть в связи с отсутствием центров кипения (такое
бывает с очень чистой водой). Вызвать кипение этой воды можно поместив в неё
какое-либо тело, например, ложку в кастрюлю, или насыпав туда сахар.
Температура закипания воды
Температура кипения характерна для
каждого вещества и зависит не только от вида жидкости, но и от атмосферного
давления воздуха. В процессе кипения температура воды остаётся постоянной и
равняется температуре кипения, поскольку вся энергия затрачивается на
парообразование.
В нормальных условиях точка кипения
воды составляет 100ᵒC или 212ᵒF
по Фаренгейту.
Влияние давления
При температуре кипения давление
насыщенного пара равняется внешнему (то есть атмосферному давлению).
Следовательно, изменяя внешнее давления, можно влиять на температуру кипения.
Изменить давление можно, например, поднявшись высоко в горы. Атмосферное
давление станет ниже, чем в обычной ситуации. И температура кипения воды станет
ниже.
На вершине Эвереста давление
настолько низкое, что вода закипает при 60ᵒC.
При такой температуре уже невозможно готовить, поэтому для питания в горах
берут с собой готовую пищу.
Можно не только понижать, но и
повышать температуры кипения воды. Для этого используют специальные
приспособления. Например, для этой цели предназначена посуда, которая в быту
называется скороваркой. Представляет она из себя кастрюлю с толстыми стенками и
плотно прилегающей крышкой. В крышке имеется клапан с грузиком, выпускающий
лишний пар.
В закрытом сосуде давление будет
складываться из атмосферного давления и давления пара, который находится над
жидкостью. Таким образом, общее внешнее давление станет больше и это позволит
поднять температуру кипения. Однако слишком высоко поднимать давление опасно,
поскольку это может вызвать разрыв тары. Чтобы это предотвратить и существует
клапан, который выпускает лишний пар, когда давление становится слишком
высоким.
Кипение соленой воды
Согласно второму закону Рауля соленая
вода (в том числе морская, а также минеральная вода) должна кипеть при более
высокой температуре чем пресная. Происходит это по ряду причин. Упрощенно эту
теорию можно объяснить так: в соленой жидкости молекулы Н2O
связываются с ионами соли. Этот процесс называется гидратацией. В результате
этого процесса образуются крепкие связи, которые сильнее, чем связи между
молекулами воды в несоленой жидкости. Поэтому молекулам солёной воды нужна большая
температура (и соответственно больше времени) на закипание, чем молекулам
пресной воды.
Температура пара
В обычных условиях температура пара
равняется температуре воды. Как мы уже выяснили, температура кипящей воды — это
постоянная величина, поскольку вся энергия расходуется на парообразование и
более сильного нагрева, чем температура кипения, не происходит. Температура
пара равняется температуре воды, поскольку ничего его более не нагревает. А вот
если нагреть пар отдельно от воды, то температура его повысится, и мы получим
так называемый перегретый пар. Перегретый пар становится невидим и может быть
очень опасен для человеческого здоровья.
Уменьшение времени приготовления пищи
Для того чтобы уменьшить время
приготовления пищи, достаточно увеличить температуры кипения жидкости. А как
это можно сделать, выше уже было сказано. Отлично для этого подойдут такие популярные
кухонные принадлежности как скороварка и мультиварка. Каждое из этих устройств плотно
закрывается крышкой, что позволяет увеличить давление и температуру кипения. А
специальный клапан удалит излишки пара. Необходимо понимать, что клапан ни в
коем случае нельзя закрывать, поскольку это может вызвать разрыв посуды.
Использование кипячения как метода
очистки
Кипячение является популярным методом
очистки воды. Однако нужно понимать, что далеко не все бактерии и примеси
уничтожаются при обычных 100ᵒC.
Поэтому в очистке воды не стоит полагаться на одно только кипячение.
Кроме того, кипячение длительное
время являлось основным методом стерилизации медицинских инструментов. И для
этой цели кипячение при нормальных условиях не является эффективным.
Кипячение можно использовать для
очистки предметов (в том числе посуды, кухонных поверхностей) от загрязнений.
Кипяток хорошо расплавляет многие вещества. Какие же вещества можно расплавить
в кипящей воде? Все вещества, имеющие температуру плавления ниже 100 градусов
Цельсия. А это, в частности, многие жиры.
Вред и польза кипяченой воды до сих
пор не определены. Мнения специалистов в этом вопросе расходятся. Так же
обстоит дело и с потребителями. Одни люди абсолютно убеждены в том, что только
такую жидкость можно употреблять. Другие же личности утверждают, что сырая вода
значительно полезнее.
Во время термического воздействия
жидкость подвергается обработке высокими температурами. Вследствие этого
погибают все вредные бактерии и микроорганизмы, которые совершенно не нужны
человеческому организму. Также при кипячении разрушаются сложные химические
соединения, например, хлор и его производные. При этом образуются соли и
разнообразные примеси, которые человек отделяет от питьевой жидкости. Именно
это помогает обезопасить организм от вредного воздействия.
После кипячения продукт приобретает
более мягкий вкус. Этот факт улучшает настроение после принятия очередной
порции жидкости. Такое состояние полезно для человека и его организма. Все люди
употребляют чай и кофе только после предварительного кипячения. Это является
общепринятым правилом и не подвергается никакому обсуждению.
Потеря молекулярной структуры во
время воздействия высоких температур происходит разрушение основных молекул
воды. Многие люди говорят о том, что кипяченая вода – это мертвая жидкость.
Такое питье не несет абсолютно никакой пользы. Наверняка все знают о том, что
человеческий организм более чем на 50% состоит из воды. При регулярном
употреблении мертвой жидкости тело теряет полезные соединения и быстрее
стареет.
2.
Практическая часть
2.1
Проведение опыта «Кипение воды
в различных емкостях»
Проведём опыт, посвящённый теме моего
проекта.
1.
Возьмем первую емкость (эмалированная
чашка). Нальем 500 мл холодной воды из-под крана, начальная температура воды
составляла +26ᵒC (приложение
1).
Разогреем на большом огне
холодную воду в эмалированной чашке. Конечная температура воды была +90ᵒC.
По ходу кипения можно заметить, как происходит процесс пузырькового кипения.
После пузырькового кипения начинается процесс пленочного кипения (приложение
2), что полностью соответствует теоретической части, описанной в главе 1.
Весь процесс закипания
холодной воды из-под крана в эмалированной чашке занял 5 минут 15 секунд
(приложение 3).
2.
Возьмем другую емкость (железная
кастрюля). Нальем 500 мл холодной воды из-под крана, начальная температура воды
составляла +22ᵒC (приложение
4).
Разогреем на большом огне
холодную воду в железной кастрюле. Конечная температура воды составляла +83ᵒC.
Кипение можно увидеть в
приложении 5.
Весь процесс закипания
холодной воды из-под крана в железной кастрюле занял 6 минут 24 секунды
(приложение 6).
3.
Затем в железную кастрюлю нальем 500 мл
холодной воды и добавим 2 чайные ложки соли, начальная температура воды была
+25ᵒC,
а после кипения стала +92 ᵒC (приложение
7).
Кипение
можно наблюдать в приложении 8.
Весь процесс закипания соленой воды в
железной кастрюле занял 6 минут 19 секунд (приложение 9).
4.
Далее в эмалированную чашку нальем 500 мл
холодной воды и добавим 2 чайные ложки соли, начальная температура воды была
+24ᵒC,
а после кипения стала +91ᵒC (приложение
10).
Кипение можно увидеть в приложении
11.
Весь процесс закипания соленой воды в
эмалированной чашке занял 5 минут 6 секунд (приложение 12).
ЗАКЛЮЧЕНИЕ
Рассмотрев данную тему, необходимо
сделать вывод:
Исследовав кипение воды в различных
емкостях – железной и эмалированной кастрюлях, я пришел к выводу, что
температура и время закипания воды различны. В эмалированной кастрюле
температура закипания составила +900, а в железной — +830.
Добавление соли в воду также повлияло
на температуру и время закипания. Температура закипания увеличилась, а время
закипания на несколько секунд в обоих случаях уменьшилось.
Таким образом, я на практике проверил
теорию кипения воды. Моя гипотеза полностью подтвердилась – вода закипает при
температуре кипения, пусть и не при 1000 С. И это вполне объясняется
с точки зрения физики.
И теперь я практически все знаю о кипении.
Работая над данным проектом я многое узнал о кипении.
ЛИТЕРАТУРА
1.
https://ru.wikipedia.org;
2.
https://licht.ovh/tonen/tab/ru;
3.
http://www.teploobmenka.ru;
4.
https://vodavomne.ru;
5.
https://blog.tutoronline.ru/kipenie;
6.
https://ru.basicdefinitions.org/1030-boiling.
Приложение
1
Приложение 2
Приложение 3
Приложение 4
Приложение 5
Приложение 6
Приложение 7
Приложение 8
Приложение 9
Приложение 10
Приложение 11
Приложение 12
Повышение температуры кипения растворов.
Кипение
представляет собой фазовый переход,
при котором происходит превращение
жидкости в пар. Температурой кипения
жидкости называют ту температуру, при
которой давление насыщенного пара над
данной жидкостью равна внешнему. При
этой температуре и соответствующем ей
давлении насыщенного пара устанавливается
равновесие между жидкой и газообразной
фазами: скорость испарения равна скорости
обратного процесса – конденсации и обе
эти фазы могут сосуществовать в течение
длительного времени.

где
Е
– коэффициент пропорциональности,
численно равный повышению температуры
кипения раствора, содержащего 1 моль
растворенного вещества в 1000г растворителя,
при условии, что раствор этой концентрации
обладает свойствами идеального. Такое
повышение температуры кипения называется
молярным или эбуллиоскопической
постоянной.
Величина
Е зависит только от свойств растворителя
и может быть найдена либо опытным путем,
либо рассчитана по термодинамическому
соотношению

где
Т
– температура кипения чистого растворителя
по аб. шкале
l
– удельная теплота испарения растворителя
R
– универсальная газовая постоянная
Св
– концентрация раствора, выражаемая
обычно в молях растворенного вещества
на 1000 г растворителя.
Если
Мв
– молярная масса растворенного вещества,
mв
– его масса (в г), а mА
– масса растворителя в граммах, то Св
будет определяться следующим соотношением
Рассмотрим
зависимость давления пара растворителя
над чистым растворителем (0А) и над
разбавленными растворами разной
концентрации нелетучего вещества (ВС
и ДЕ) от температуры (рис.1)
P
101,3 кПа А
С Е
0 С’
B
Е»
D
Ткип0
Т’кип
T”кип
Температуры,
при которых изобара, равная атмосферному
давлению (101,3 кПа), пересечет кривые 0А,
ВС и ДЕ, будут температурами кипения
соответствующих жидкостей при этом
давлении. Для растворов эти температуры
(Т’кип
и T”кип)
являются более высокими, чем для чистого
растворителя (Ткип0)
и разность между ними
будет
тем большей, чем выше концентрация
раствора. Для бесконечно разбавленных
растворов бесконечно малые участки
кривых CC’,
ЕЕ’ можно считать прямолинейным. Тогда
из подобия треугольников АСС’, АЕЕ’
вытекает, что повышение температуры
кипения пропорционально понижению
давления насыщенного пара и, следовательно,
повышение температуры кипения
пропорционально концентрации.
Определив
опытным путем повышение температуры
кипения раствора, можно вычислить
молярную массу вещества
Этот
метод определения молекулярных масс
носит название эбуллиоскопического.
Понижение температуру замерзания растворов.
Замерзание
представляет собой фазовый переход,
при котором происходит превращение
жидкости в твердое вещество. Температурой
замерзания 9кристаллизации) жидкости
называют ту температуру, при которой
давление насыщенного пара над жидкостью
равно давлению насыщенного пара над
выпадающими из нее кристаллами твердой
фазы.
При
этой температуре и соответствующем ей
давлении насыщенного пара скорость
кристаллизации равна скорости плавления
и обе эти фазы могут сосуществовать в
течение длительного времени.
Еще
М.В. Ломоносов заметил, что разбавленный
раствор замерзает при температуре более
низкой, чем чистый растворитель. Так,
морская вода замерзает не при 273 К, а при
несколько более низкой температуре.
Многочисленные эксперименты показали,
что такое изменение температуры
замерзания раствора можно рассматривать
как общее правило.
Процессы
замерзания и кипения были детально
изучены Раулем и представлены в виде
закона, который в последствии был назван
вторым законом Рауля.
рассмотрим
простейший вывод этого закона. На рис.2
показана диаграмма, выражающая зависимость
давления насыщенног пара от температуры
над чистым растворителем и над раствором.
Р
А С Е
0 рис.
2
B
K
D
273 Т
T”з
T’з
Кривая
0А – зависимость давления насыщенного
пара чистой воды от температуры.
Кривая
ВС, ДЕ – зависимость давления насыщенного
пара воды над растворами с различными
концентрациями растворенного вещества
0Д
– выражает температурную зависимость
давления насыщенного пара воды над
льдом.
Из
рис.2 видно, что давление пара над
раствором при 273 К ниже, чем над водой,
но оно не равно давлению пара над льдом
при той же температуре. Лишь при
температуре ниже 273 К (Т’з) давление
пара над раствором уменьшается настолько,
что становится равным давлению пара
над льдом. Этому соответствует точка
В. При более высоких концентрациях
раствора кривые, выражающие зависимость
давления пара воды над раствором от
температуры, располагаются ниже кривой
ВС, но параллельно ей.
Введем
следующий обозначения:
Р0А
– давление пара над чистым растворителем
при 273 К
РА
– давление пара над раствором при
температуре его замерзания Т’з
Далее
из точки В параллельно оси абсцисс
проведем линию до пересечения с
перпендикуляром опущенным из точки 0.
Пересечение этих прямых обозначим
точкой К.
Из
прямоугольного треугольника ВОК
определяем
Из
рисунка 2 видно, что

где
раствора.
Подставляя
эти значения в выше записанное уравнение,
получим
откуда

Из
первого закона Рауля для сильно
разбавленных растворов имеем
откуда

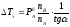
где
nА,
nВ,
mА
сохраняют ранее присвоенные обозначения
(см. выше). Если через М0А
обозначить молярную массу растворителя,
то
При
подстановке этого выражения в уравнение
(4) получим
Умножим
и разделим правую часть этого выражения
на 1000, тогда

Объединим
все постоянные величины в уравнении
(5) в одну постоянную К (
получим следующее выражение
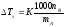
Выражение

Св.
Подставив
это выражение в уравнение (6), получим
окончательное уравнение.

Это
и есть математическое выражение второго
закона Рауля: понижение температуры
замерзания или повышение температуры
кипения растворов прямо пропорционально
его моляльной концентрации.
Коэффициент
К в уравнении (7) носит название
криоскопической постоянной, показывает
молярное понижение температуры замерзания
раствора, является индивидуальной
характеристикой растворителя (КН2О=1,86º)
и имеет ту же размерность, что и Е
(Кº·кг·моль-1)
Метод
исследования, основанный на измерении
понижения температуры замерзания
растворов, называется криоскопическим.
Он также, как и эбуллиоскопический
позволяет вычислить молярную массу
растворенного вещества
На
рис.3 изображен прибор, предназначенный
для измерения температуры замерзания
растворов.
ОСМОС
И ОСМОТИЧЕСКОЕ ДАВЛЕНИЕ.
Весьма
важным в биологическом отношении
свойством растворов является осмос.
В
природе часто растворы отделяются от
растворителя мембранами, проницаемыми
лишь дл я частиц растворителя. В этом
случае растворенное вещество диффундировать
в растворитель не может, и будет
наблюдаться только переход растворителя
в в раствор, т.е. растворитель будет
перемещаться в обоих направлениях, но
все же в раствор его будет переходить
немного больше, чем в обратном направлении.
Механизм
осмоса легко представить на основе
изотермической перегонки. Пусть
полупроницаемая мембрана, имеющая
микропоры, разделяет растворитель и
раствор с концентрацией Св
(рис.4)
рис.4
В
пору, ограниченную с одной стороны
растворителем, а с другой раствором,
идет испарение. Вследствие повышения
по закону Рауля упругости насыщенного
пара со стороны растворителя из
парообразной фазы концентрируется,
переходя в раствор.
В
результате осмоса увеличивается объем
раствора, и его концентрация постепенно
снижается; проникающий через мембрану
в раствор растворитель увеличивает
столб жидкости h
и, следовательно, повышает гидростатическое
давление (см. рис.5). Одновременно будет
возрастать число молекул растворителя,
перемещающихся через мембрану в обратном
направлении, т.е. из раствора в растворитель.
постепенно гидростатическое давление
и разбавление раствора достигнут
величин, при которых количество молекул
растворителя, перемещающихся в обоих
направлениях, уравняется и наступит
осмотическое равновесие. Развившееся
в результате осмоса избыточное
гидростатичекое давление, измеряемое
столбом раствора высотой h,
при котором устанавливается осмотическое
равновесие, называют осмотическим
давлением.

5
Полупроницаемыми
для многих растворов являются мембраны
из коллодия, целлофана, железистосинеродистой
меди и др.
ЗАКОНЫ
ОСМОТИЧЕСКОГО ДАВЛЕНИЯ.
Изучение
законов осмотического давления выявило
их полную аналогию с газовыми законами.
Для разбавленных растворов неэлектролитов
их можно сформулировать так:
при
постоянной температуре осмотическое
давление прямо пропорционально молярной
концентрации растворенного вещества
(аналогия с законом Бойля-Мариотта):
при
постоянной молярной концентрации
осмотическое давление прямо пропорционально
абсолютной температуре (аналогия с
законом Гей-Люссака):
Из
двух этих законов следует, что при
одинаковых молярных концентрациях и
температуре растворы разных неэлектролитов
создают одинаковое осмотическое
давление, т.е. эквимолярные растворы
неэлектролитов изотоничны (аналогия
с законом Авогадро).
Вант-Гоффом
был предложен объединенный закон для
осмотического давления в растворах
(аналогично объединенного газовому
закону Менделеева-Клайперона): Осмотическое
давление разбавленных растворов
неэлектролитов прямо пропорционально
молярной концентрации, коэффициенту
пропорциональности и абсолютной
температуре:
так
как с=n/V,
где n
– число молей неэлектролита, а V
– объем раствора, то

Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #