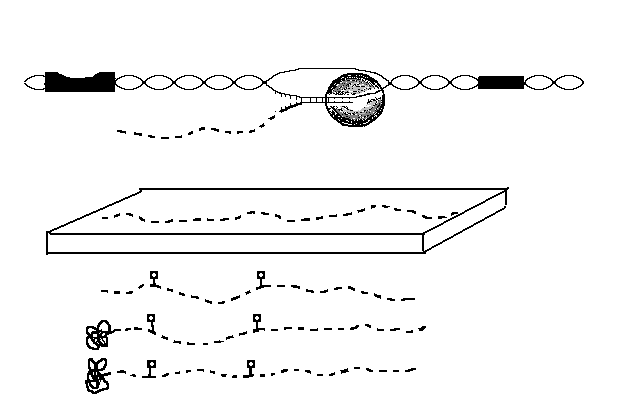
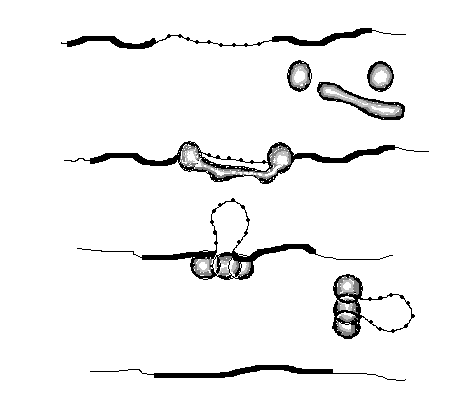
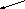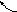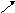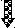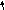Механизмы исправления ошибок во время репликации ДНК и ее репарация вследствие повреждений на протяжении всего жизненного цикла клетки.
Основные моменты:
-
Клетки имеют различные механизмы предотвращения возникновения мутаций – необратимых изменений в ДНК
-
В процессе синтеза ДНК, большинство ДНК-полимераз «проверяют свою работу» и проводят замену бо́льшей части ошибочно вставленных нуклеотидов. Этот процесс можно назвать исправлением ошибок.
-
Сразу после синтеза ДНК любые оставшиеся ошибочные нуклеотиды обнаруживаются и заменяются в так называемом процессе репарации ошибочно спаренных нуклеотидов.
-
Если ДНК повреждена, она может быть восстановлена с помощью различных механизмов, например, путём прямой репарации, эксцизионной репарации или путём восстановления двухцепочечных разрывов
- пострепликативной репарации.
Введение
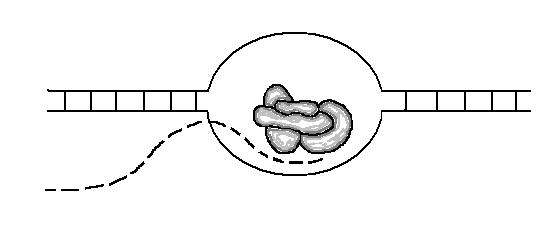
Как ДНК связана с раком? Рак возникает при неконтролируемом делении клеток, когда игнорируются клеточные «стоп»-сигналы, что приводит к образованию опухоли. Это неправильное поведение клеток вызвано накопившимися мутациями — необратимыми изменениями последовательности ДНК клетки.
На самом деле, ошибки в процессе репликации и повреждения ДНК возникают в клетках нашего тела постоянно. Однако в большинстве случаев они не приводят к раку и даже не вызывают мутаций, такие ошибки обычно обнаруживаются и исправляются в процессе репарации ДНК. Если же повреждение исправить не удаётся, то в клетке включается механизм самоуничтожения — (апоптоз), который предотвращает передачу поврежденной ДНК дочерним клеткам.
Мутации возникают и передаются дочерним клеткам только тогда, когда эти механизмы не справляются. В частности, рак возникает в случае накопившихся в одной клетке мутаций генов, связанных с делением.
В этой статье мы подробно рассмотрим механизмы, используемые клетками для исправления ошибок, которые возникают в процессе репликации. К ним относятся:
-
Исправление ошибок – процесс, который возникает во время репликации ДНК.
-
Репарация ошибочно спаренных нуклеотидов, которая происходит сразу же после репликации ДНК.
-
Механизмы репарации, которые выявляют и исправляют повреждения ДНК на протяжении всего клеточного цикла
Исправление ошибок
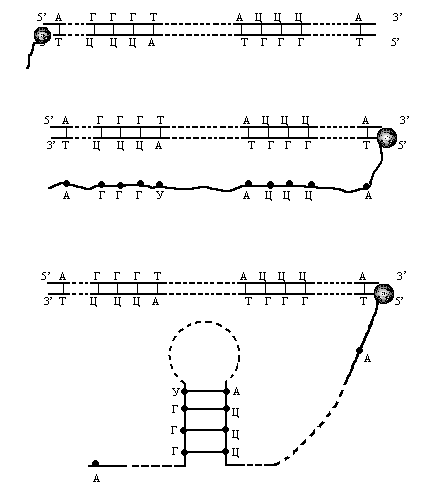
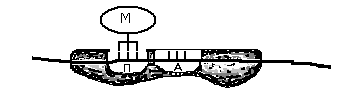
ДНК-полимеразы — это ферменты, участвующие в репликации ДНК. Во время копирования ДНК большинство ДНК-полимераз «проверяют», корректный ли нуклеотид они добавляют. Этот процесс называется исправлением ошибок. Если полимераза обнаружит, что был добавлен неправильный нуклеотид, она сразу же удалит и заменит его и только после этого продолжит синтез ДНКstart superscript, 1, end superscript.
Репарация ошибочно спаренных нуклеотидов
Процесс исправления избавляет от основной массы ошибок, но не от всех. После создания новой ДНК запускается механизм репарации ошибочно спаренных нуклеотидов — удаления и замены ошибочно спаренных нуклеотидов, оставшихся в результате репликации. Исправление несоответствий между парами оснований также может включать в себя исправление небольших вставок и делеций, возникающих вследствие «соскальзывания» полимеразы с исходной цепи squared.
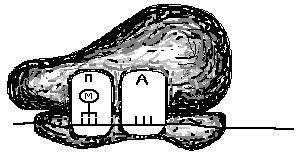
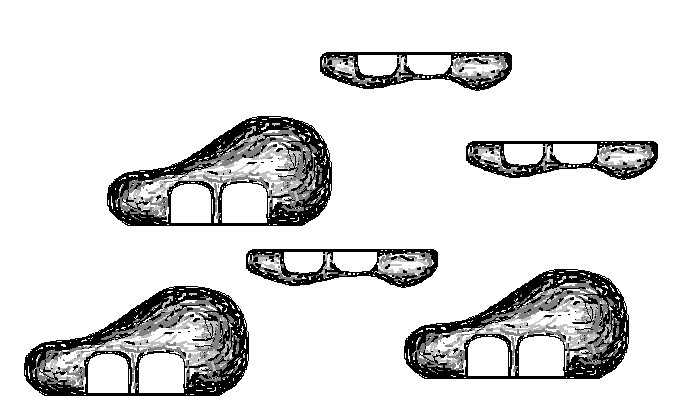
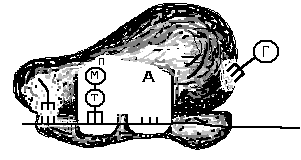
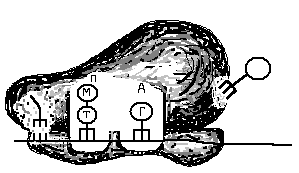
Как происходит восстановление неправильно спаренных нуклеотидов? Во-первых, белковый комплекс распознаёт неправильно спаренный нуклеотид и связывается с ним. Другой комплекс разрезает ДНК в области несовпадения, а ещё одна группа ферментов отщепляет некорректный нуклеотид вместе с небольшим участком вокруг него. Затем ДНК-полимераза заполняет этот пробел правильными нуклеотидами, а фермент ДНК-лигаза сшивает разрывы в цепиsquared.
Удивительно: как белки, участвующие в восстановлении ДНК, определяют, «кто прав» во время репарации ошибочно спаренных нуклеотидов? То есть, когда два основания неправильно соединены (как G (гуанин) и T (тимин) на рисунке выше), какое из этих двух оснований должно быть удалено и заменено?
У бактерий можно отличить исходную и дочернюю цепи ДНК по метилированным основаниям. На исходной цепи ДНК есть метильные (minus, start text, C, H, end text, start subscript, 3, end subscript) группы, присоединенные к некоторым из ее оснований, а у дочерней цепи таких групп еще нетcubed.
У эукариот процессы, позволяющие идентифицировать исходную цепь при устранении несоответствий, включают распознавание одноцепочечных разрывов, которые обнаруживаются только у дочерней цепи cubed.
Механизмы репарации ДНК
С ДНК может что-нибудь случиться практически в любой момент жизни клетки, а не только во время репликации. Фактически, ДНК постоянно повреждается из-за воздействия внешних факторов: ультрафиолетового излучения и радиации, химических веществ, не говоря уже о спонтанных процессах, которые протекают даже без вмешательства окружающей среды!start superscript, 4, end superscript
К счастью, наши клетки имеют механизмы восстановления, с помощью которых они находят и исправляют большинство повреждений ДНК. Можно выделить несколько типов репарации:
-
Прямая репарация. Некоторые повреждения ДНК, вызванные химическими реакциями, могут быть «исправлены» находящимися в клетке ферментами.
-
Эксцизионная репарация. Повреждение одного или нескольких нуклеотидов ДНК часто исправляется удалением и заменой поврежденного участка. При эксцизионной репарации оснований удаляется только поврежденное основание. В случае эксцизионной репарации нуклеотидов, как и в случае репарации ошибочно спаренных нуклеотидов, которое мы рассмотрели выше, удаляются целиком нуклеотиды.
-
Репарация двухцепочечных разрывов: Существуют два основных способа: негомологичное соединение концов и гомологичная рекомбинация. Они используются для восстановления двухцепочечных разрывов ДНК (когда вся хромосома разделяется на две части).
Прямая репарация
В некоторых случаях клетка может исправить повреждение ДНК, обратив вызвавшую его реакцию. Дело в том, что «повреждение ДНК» — это, как правило, присоединение к ней лишней группы в результате химической реакции.
Например, гуанин (G) может подвергаться реакции с присоединением метильной (minus, start text, C, H, end text, start subscript, 3, end subscript) группы к атому кислорода в азотистом основании. Если это не исправить, метил-содержащий гуанин будет связываться с тимином (Т), а не с цитозином (С) во время репликации ДНК. К счастью, у людей и многих других организмов есть фермент, который может удалить метильную группу, обратив реакцию, и тем самым вернуть азотистое основание в нормальное состояниеstart superscript, 5, end superscript.
Эксцизионная репарация оснований
Эксцизионная репарация оснований — это механизм, используемый для обнаружения и удаления определенных типов поврежденных азотистых оснований. Ключевую роль в нем играет группа ферментов, называемых гликозилазами. Каждая гликозилаза обнаруживает и удаляет определенный вид поврежденных оснований.
Например, в процессе реакции дезаминирования цитозин может превратиться в урацил — основание, обычно встречающееся только в РНК. Во время репликации ДНК урацил будет соединяться с аденином, а не с гуанином (в отличие от цитозина), поэтому такое превращение может привести к возникновению мутацииstart superscript, 5, end superscript.
Для предотвращения подобных изменений гликозилаза, являющаяся частью сигнального пути эксцизионной репарации, обнаруживает и удаляет дезаминированные цитозины. После того, как основание было удалено, удаляется и оставшаяся часть нуклеотида, а другие ферменты заполняют пробелstart superscript, 6, end superscript.
Эксцизионная репарация нуклеотидов
Эксцизионная репарация нуклеотидов — это еще один способ удаления и замены поврежденных оснований. В результате нее обнаруживаются и корректируются повреждения, которые искажают форму двойной спирали ДНК. Например, азотистые основания могут измениться, присоединив к себе громоздкие группы атомов, в частности, в результате воздействия химических веществ, содержащихся в сигаретном дымеstart superscript, 7, end superscript.
Эксцизионная репарация нуклеотидов также используется для устранения повреждений, вызванных ультрафиолетовым излучением, например, при получении солнечного ожога. Под воздействием УФ-излучения цитозин и тимин могут вступать в реакцию с соседними основаниями, которые также являются цитозином или тимином, образуя при этом связи, изменяющие форму двойной спирали и вызывающие ошибки в процессе репликации ДНК. Наиболее распространенный тип таких связей — тиминовый димер — он состоит из двух тиминовых оснований, вступающих в реакцию друг с другом и образующих химическую связьstart superscript, 8, end superscript.
При эксцизионной репарации нуклеотидов поврежденные нуклеотиды удаляются вместе с соседними нуклеотидами. В этом процессе хеликаза (фермент, раскручивающий ДНК) раскрывает ДНК, образуя пузырь, а ферменты, разрезающие ДНК, отсекают поврежденную часть пузыря. Полимераза заполняет пробел, а лигаза сшивает разрыв в цепиstart superscript, 9, end superscript.
Репарация двухцепочечных разрывов
Некоторые факторы окружающей среды, например, радиация, могут вызывать разрывы обеих цепочек ДНК (разделение хромосомы на две части). Такие повреждения ДНК, если верить комиксам, ведут к появлению супергероев, но могут встречаться и после реальных катастроф, например, Чернобыльской.
Двухцепочечные разрывы опасны, потому что большие сегменты хромосом и сотни содержащихся в них генов могут быть потеряны, если разрыв не будет восстановлен. Существует два способа восстановления двухцепочечных разрывов ДНК: негомологичное соединение концов и гомологичная рекомбинация.
При негомологичном соединении концов два разорванных конца хромосомы просто склеиваются обратно. Этот механизм восстановления является «грубым» и неточным, в результате в месте разрыва, как правило, либо теряются нуклеотиды, либо добавляются лишние, что может привести к мутациям. Но это в любом случае лучше потери целого фрагмента хромосомыstart superscript, 10, end superscript.
При гомологичной рекомбинации для восстановления разрыва используется фрагмент из гомологичной хромосомы, который соответствует поврежденной хромосоме (или из сестринской хроматиды, если ДНК была реплицирована). В этом процессе две хромосомы объединяются, и неповрежденная область гомологичной хромосомы или хроматиды используется в качестве матрицы для замены поврежденной области. Гомологичная рекомбинация работает «чище», точнее, чем негомологичное соединение концов, и обычно не приводит к образованию мутацийstart superscript, 11, end superscript.
Репарация ДНК и заболевания человека
Доказательства важности механизмов репарации получены на основе генетических заболеваний человека. Во многих случаях мутации в генах, которые кодируют белки, участвующие в репарации, связаны с наследственным раком. Например:
-
Наследственный неполипозный колоректальный рак (также называемый синдромом Линча) вызван мутациями в генах, кодирующих белки, которые участвуют в репарации ошибочно спаренных нуклеотидовstart superscript, 12, comma, 13, end superscript. Поскольку такие нуклеотиды не восстанавливаются, у людей, страдающих этим синдромом, мутации накапливаются гораздо быстрее, чем у здоровых. Это может привести к развитию опухолей толстой кишки.
-
Люди с пигментной ксеродермой очень чувствительны к ультрафиолетовому излучению. Это вызвано мутациями в белках, участвующих в эксцизионной репарации нуклеотидов. Когда они не функционируют, димеры тимина и другие виды повреждений, вызванные ультрафиолетовым излучением, перестают восстанавливаться. У людей с пигментной ксеродермой после нескольких минут пребывания на солнце могут возникнуть сильные солнечные ожоги, и около половины из них заболевают раком кожи в возрасте до 10 лет, если только они не избегают солнечных лучейstart superscript, 14, end superscript.
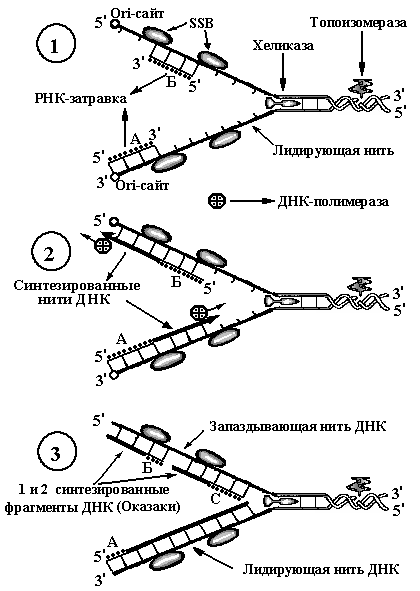
При репликации
ДНК происходит важный процесс коррекции
вставляемых нуклеотидов (рис. 10). В
область синтеза ДНК поступают все четыре
нуклеотида (на рис. 10 они обозначены как
«претенденты нуклеотиды»). ДНК-полимераза
отбирает нужного предшественника путём
пробного спаривания его с нуклеотидом
ДНК-матрицы.
Рис. 7. Схемы
репликации ДНК
13
П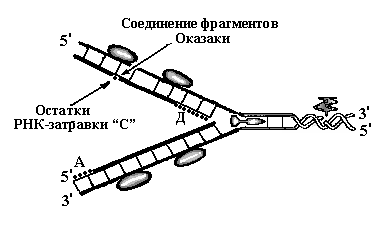
подобранного нуклеотида оценивается
по нескольким параметрам, два из которых
наиболее существенны. Во-первых,
подобранный нуклеотид должен формировать
столько же водородных связей, сколько
и нуклеотид на матричной нити.
Рис. 8. Схема
репликации ДНК – стадия элонгации. На
запаздывающей нити синтезировался
третий участок РНК-затравки – «Д».
РНК-затравки «Б» и «С» разрушены и
фрагменты Оказаки, синтезированные с
их концов соединены в единую нить. На
лидирующей цепочке синтез идёт непрерывно,
РНК-затравка «А» разрушается
Ориджины
Лидирующая цепь
3’
5’
5’
3’
Отстающая
цепь
Репликон
Движение
вилок Движение вилок
Рис. 9. Схема
осуществления синтеза ДНК в двух вилках
репликации
Во-вторых,
расстояние между сахарофосфатными
остовами должно быть постоянным и
соответствовать трём гетероциклическим
кольцам в двух основаниях (одно кольцо,
соответствующее пиримидиновому основанию
в одной нити, и два кольца, соответствующие
пуриновому основанию в другой нити).
Если же претендент нуклеотид и нуклеотид
в матрице будут содержать по два кольца
в молекуле или по одному, то соединение
не происходит.
Проверка правильного
включения нуклеотида в растущую цепь
производится дважды: один раз перед
включением его в состав растущей цепи
и второй раз перед включением следующего
нуклеотида.
14
После того как
прошла проверка на совместимость
нуклеиновых оснований, формируется
связь в сахарофосфатном остове.
-
Конвариантная
редупликация как основа мутационной
изменчивости
Этот термин ввёл
в научный обиход учёный-генетик
Тимофеев-Ресовский. Дословно конвариантная
редупликация означает самовоспроизведение
с изменением. Этот процесс лежит в основе
всего эволюционного процесса.
Несмотря на высокую
точность процессов репликации и
эффективно работающую систему коррекции,
во вновь синтезированных нитях ДНК
всегда имеются нарушения. Эти дефекты
чаще всего носят название «генные
мутации». Подсчёты показали, что они
происходят с частотой 1 ошибка на 1010
пар нуклеотидов. Редупликация,
происходящая с ошибками, носит название
конвариантная редупликация.
В основе нарушений
лежат самые различные причины. Например,
высокая или наоборот очень низкая
концентрация нуклеотидов в месте
синтеза, спонтанная потеря пуриновых
оснований (см. далее), дезаминирование
цитозина, который превращается при этом
в урацил под действием ультрафиолетового
облучения, присутствие в месте синтеза
химических мутагенов и т.д. Судьба
возникших ошибок неоднозначна. Они
могут быть исправлены репарационными
процессами (см. далее). Это наиболее
благоприятный для клетки вариант. В
некоторых случаях повреждение в молекуле
ДНК не устраняется. При этом возможны
два варианта разворачивания событий.
Если повреждение молекулы ДНК затронуло
функционально не активную область ДНК,
то фенотипически такая ошибка не будет
выявляться и, как правило, никаких
тяжёлых последствий наблюдаться не
будет. Иное дело, если ошибка спаривания
произошла в нуклеотидных последовательностях
какого-либо гена. В этом случае вероятность
появления фенотипических нарушений
увеличивается. Это может привести к
гибели клетки или целого организма. При
этом вместе с погибшей клеткой
элиминируется и дефект ДНК. И, наконец,
следует учитывать, что генные мутации
лежат в основе мутационной изменчивости.
А она приводит к возникновению
множественных аллелей, которые делают
генофонд популяций более пластичным.
5. Метилирование
ДНК
И в заключении
необходимо остановиться на важном
процессе, который происходит в момент
или сразу же после синтеза дочерних
цепей ДНК – метилирование вновь
синтезированных цепей. У человека
специальный фермент ДНК-метилаза
метилирует цитозин, присоединяя к нему
группы СН3.
Процесс метилирования скорее всего
необходим для формирования структуры
хромосом (упаковки ДНК) и регуляции
транскрипции генов. Кроме того,
метилирование спо-собствует инактивации
одной Х-хромосомы у млекопитающих. У
бактерий метилирование защищает ДНК
от разрезания своими собственными
ферментами.
15
Сахарофосфатный
остов
Водородные
связи
Т
А

Г
Ц
Дочерняя
цепь
ДНК
А
Т
Ц
А
Г
Ц
Матричная цепь
ДНК Т
Претенденты
нуклеотиды
Рис. 10. Схема подбора
комплементарного основания к цитозиновому
нуклеотиду (Ц). Среди
претендентов с этим нуклеотидом совместим
только гуаниновый нуклеотид (Г), т.к. он
формирует три водородные связи и имеет
два кольца
6. Лекарственные
препараты и репликация
Процесс репликации
подвержен воздействию самых различных
факторов и, в частности, лекарственных
препаратов. Так, например, дауномицин
и другие противоопухолевые препараты
имеют в своей молекуле плоскую циклическую
структуру, которая встраивается
(интеркалируется) между парами оснований.
Это ведёт к локальному изменению
структуры ДНК, в результате чего ферменты
репликации прекращают свою работу.
Например, топоизомераза теряет
способность деспирализовывать ДНК в
месте интеркаляции. Такие алкилирующие
16
вещества, как
тиофосфамид и др., модифицируют основания
путём присоединения к ним алкильных
группировок. Если ферменты репликации
встречают это основание, их работа может
прекратиться.
Ингибитор
ДНК-топоизомеразы – новобиоцин,
вмешиваясь в работу фермента, прекращает
деспирализацию ДНК, а, следовательно,
и синтез РНК.
Резюме.
Репликация ДНК – процесс точной передачи
информации от ДНК на ДНК в результате
самовоспроизведения матричных молекул.
В репликации различают три периода.
1.
Инициация. Происходит образование
репликационной вилки и образование
РНК-затравки. Синтез начинается
одновременно на множестве участков
ДНК. Перед синтезом ДНК деспирализуется,
водородные связи разрываются и нити
отходят друг от друга.
2.
Элонгация. Синтез РНК начинается с
РНК-затравки и идёт одновременно на
обеих нитях материнской ДНК. На одной
нити синтез идёт непрерывно, на другой
– фрагментами (фрагменты Оказаки).
3.
Терминация. Синтез РНК заканчивается
при встрече репликационных вилок или
на конце молекулы ДНК.
РЕПАРАЦИЯ ДНК
1.Общее представление
о репарации
Процесс репарации
характерен для всех живых существ. Это
одно из основных свойств наследственного
материала, напрямую связанное с
интенсивностью процессов старения,
динамикой развития опухолевых заболеваний,
формированием врождённых пороков
развития, возникновением наследственной
патологии и др. Изменения ДНК, не
подвергшиеся репарации, сыграли (и
играют) важную роль в эволюционном
формировании новых адаптивных свойств
живого.
Остановимся на
трёх важных принципах, характерных для
процесса репарации.
1.
Ферменты репарации определяют место
большинства повреждений на молекуле
ДНК по её локальной денатурации в месте
повреждения.
Эффективность
любой репарационной системы, в первую
очередь, зависит от того насколько
быстро и точно ферменты обнаружат места
повреждений ДНК. Поскольку характер
последних чрезвычайно разнообразен,
то трудно представить существование
многочисленных ферментов, опознающих
«свои» специфические повреждения ДНК.
В действительности всё оказалось проще.
Любое нарушение первичной структуры
ДНК приводит к одинаковым последствиям
– сразу же возникает нарушение в
структуре второго, третьего и т.д.
порядка, т.е. в месте повреждения наступает
локальная денатурация ДНК. Возникшие
в ДНК участки денатурации (в отличие от
первичных повреждений) не специфичны.
Это позволяет специальным ферментам
быстро выявлять денатурированные
17
участки ДНК и
подключать для их восстановления
специфические репарационные системы.
2.
Повреждённый участок на одной нити ДНК
восстанавливается в соответствии с
неповреждённым оппозитным участком
второй нити. При повреждении двух нитей
в восстановлении повреждения участвуют
сестринские нити хроматид.
Отмечена
закономерность, что при воздействии на
ДНК мутагенных факторов, повреждения
в основном касаются одной нити ДНК.
Одновременное повреждение обеих нитей
случается не часто и они, как правило,
заканчиваются гибелью клетки. Восстановить
повреждённый участок не трудно, если
имеется план его первоначального (до
повреждения) строения. Такой план всегда
имеется – это последовательность
нуклеотидов на второй, оппозитной
цепочке ДНК, т.е. в нити ДНК, противоположной
месту повреждения. Здесь располагаются
нуклеотиды, комплементарно отражающие
последовательность нуклеотидов
повреждённого участка. Поэтому многие
репарационные системы «ремонтируют»
повреждённый участок, застраивая его
комплементарными нуклеотидами в
соответствии с планом оппозитного
участка.
Иное дело, если
повреждаются одновременно обе нити
ДНК. Это бывает, когда молекула ДНК с
повреждением вступает в период синтеза
ДНК. В этом случае на дефектной ДНК
происходит синтез дочерних нитей ДНК,
причём на повреждённой нити синтезируется
дефектная дочерняя нить. Но и в этом
случае план повреждённых участков
сохраняется в молекуле ДНК, которая
сформировалась в результате репликации
неповреждённой нити ДНК. При максимальном
сближении сестринских хроматид в профазе
мейоза и митоза происходит репарация
повреждённых нитей ДНК в соответствии
с неповреждёнными участками молекулы
ДНК сестринской хроматиды.
У диплоидных
организмов при репарации повреждённого
участка ДНК возможно использование
плана строения неповреждённого участка
ДНК гомологичной хромосомы.
3.
Энергия на процесс репарации черпается
в основном из АТФ. Но в некоторых случаях
используется энергия фотона света,
который активирует ферменты репарации.
Репарация ДНК –
энергозависимый процесс. В качестве
поставщика энергии используются
макроэргические соединения (например,
АТФ). Однако есть одно исключение – это
фотореактивация (световая репарация).
Фермент, осуществляющий эту реакцию,
использует энергию солнечного света,
а не аккумулированную в химических
связях АТФ. Называется этот фермент –
фотолиаза. Фермент репарирует повреждения,
связанные с образованием тиминовых
димеров (см. далее).
2.Виды репарации
Прежде всего, все
виды репарации (или реакции) делятся на
две большие группы – прямые и непрямые.
Прямые реакции отличаются простотой
и непо-
18
Сахарофосфатный
остов
Азотистые основания
Водородные
связи
Г Ц

УФ
Т А
Т А
Г Ц
Рис. 11. Схема
образования тиминовых димеров под
действием УФ-облучения. Образовавшиеся
химические связи между тиминами одной
нити показаны пунктирными линиями
средственным
действием на повреждённый объект.
Никаких «предварительных работ» не
проводится. Практически все они
функционируют до периода синтеза ДНК.
К ним относится фотореактивация. При
непрямом типе репарации имеющееся
повреждение ДНК вначале вырезается. В
результате на одной из нитей формируется
брешь, которая застраивается специальными
ферментами в соответствии с планом
расположения нуклеотидов на противоположной
цепи. К этому типу репарации относится
эксцизионная репарация и ряд других.
Прямой тип репарации
Фотореактивация
Неоспоримым фактом
является то, что ультрафиолетовый свет
(УФ) повреждает уникальную молекулу
ДНК. Повреждения в основном касаются
пиримидиновых оснований – тимина и
цитозина. Под влиянием УФ света происходит
19
перераспределение
валентностей в пиримидиновых основаниях,
т.е. между нахо-
дящимися рядом на
одной нити двумя тиминами, двумя
цитозинами или тимином и цитозином.
Следствием этого является появление
необычной химической связи между
основаниями и возникновение димера
(два нуклеотида) – тиминового (тимин-тимин),
цитозинового (цитозин-цитозин) или
тимин-цитозинового. Водородная связь
между оппозитными нуклеотидами при
этом разрушается (рис.11). Есть данные о
том, что пиримидиновые димеры способны
активировать процессы, приводящие к
развитию опухолевых заболеваний.
Возникшая мутация
репарируется несколькими системами
репарации. Одна из них фотореактивация.
Основной фермент этой реакции белок
фотолиаза
имеет сложную
белковую структуру. На одном участке
молекулы находится светочувствительный
центр, воспринимающий фотоны синего
света и активирующий фермент. Фермент
в таком состоянии находит димеры в
молекуле ДНК, разрывает образованные
УФ связи между тиминами и восстанавливает
межнитевые водородные связи пиримидин
– пурин. По завершению цикла фермент
отходит от ДНК.
Следует отметить,
что при этом типе репарации фермент
непосредственно действует на повреждение,
восстанавливая его. Это классический
тип прямой репарации.
Непрямой тип
репарации
Эксцизионная
репарация
Надрез
Расширение бреши Застройка бреши
Сшивка
(Эндонуклеаза)
(Экзонуклеаза) (ДНК-полимераза)
(Лигаза)
Тиминовый
димер
Рис. 12. Схема
эксцизионной репарации тиминовых
димеров
Тиминовые димеры
могут быть в силу ряда причин не
восстановлены системой фотореактивации.
В этом случае активируются ферменты
системы эксцизионной репарации. Этот
тип репарации позволяет исправить до
95% спонтанных мутаций. Существует
несколько типов реакций эксцизионной
репарации. Их объединяет то, что
повреждённое основание, нуклеотид или
неправильно спаренное основание
(мисмэтч) вначале полностью вырезается
из цепи, а затем вставляется новый
нуклеотид (или нуклеотиды), комплементарный
нуклеотиду противоположной цепочки.
Приведём в качестве примера эксцизионную
репара-
20
цию нуклеотидов
(тиминовых
димеров). Реакция состоит из нескольких
этапов. На первом этапе фермент
эндонуклеаза находит повреждённую нить
ДНК и делает надрез в месте повреждения.
Другой фермент, экзонуклеаза, расширяет
надрез, «откусывая» с обоих концов
надреза нуклеотиды вместе с тиминовым
димером. Образовавшаяся брешь застраивается
с одного конца нити ДНК специальным
ферментом ДНК-полимеразой. При этом
вставляемые нуклеотиды комплементарны
нуклеотидам неповреждённой нити ДНК.
Незастроенным остаётся небольшой
разрыв, который сшивается ДНК-лигазой
(рис.12).
ОБЩЕЕ ПРЕДСТАВЛЕНИЕ
О ТРАНСКРИПЦИИ
Экспрессия гена
– это реализация генетической информации,
закодированной в ДНК, путём её транскрипции
и трансляции.
Транскрипция – первый этап экспрессии
генов. Заключается она в переводе
информации, содержащейся в гене, на РНК
путём синтеза последней на одной нити
ДНК гена. В результате транскрипции
синтезируются все виды РНК – информационная
(иРНК), рибосомальная (рРНК), транспортная
(тРНК) и другие (регуляторные, малые
ядерные и пр.). Все они принимают участие
в экспрессии генов, но только иРНК
переносит информацию о строении белка
с нуклеотидного текста ДНК на аминокислотный
текст белка. Все остальные виды РНК
обеспечивают эффективное осуществление
этого процесса.
Суть транскрипции
заключается в следующем: специальные
ферменты подготавливают молекулу ДНК
в области гена к транскрипции (раскручивают
спираль ДНК, разрывают водородные связи
между нитями и т.д.). Фермент ДНК-зависимая
РНК-полимераза синтезирует РНК на
матричной нити ДНК от стартовой точки
до точки окончания транскрипции. Синтез
РНК заключается в последовательном
наращивании в ней нуклеотидов,
комплементарных матричной нити ДНК.
Исключение составляет урацил РНК,
который вставляется против аденина
матричной нити ДНК.
В транскрипции
принимает участие множество ферментов,
но непосредственно синтез РНК осуществляет
фермент ДНК-зависимая РНК-полимераза
(или просто РНК-полимераза). У прокариот
все виды РНК (иРНК, рРНК, тРНК) синтезируются
одной РНК-полимеразой, а у эукариот они
синтезируются тремя разными ферментами:
РНК-полимеразой I,
РНК-полимеразой II
и РНК-полимеразой III.
Информационные
РНК у
эукариот транскрибируются РНК-полимеразой
II.
Транскрипция –
это сложный многоэтапный процесс и одна
РНК-полимераза не в состоянии полностью
обеспечить его. На разных этапах
транскрипции к РНК-полимеразе
присоединяются и, наоборот, отщепляются
различные белковые субъединицы, которые
модифицируют её активность в соответствии
с требованиями данного этапа.
Транскрипция, как
и все процессы матричного синтеза у
про- и эукариот, состоит из трёх этапов
– инициации, элонгации и терминации.
В дальнейшем процесс транскрипции
будем рассматривать только у эукариот.
21
1. Периоды
транскрипции
Инициация
Инициация – это
подготовительный этап. В эту стадию
происходит множество синхронизированных
во времени процессов. Рассмотрим два
из них:
1. Формирование
инициаторного комплекса.
2. Образование
«транскрипционного глазка».
РНК-полимераза
ТФ
ТФ
Специальный
белок
Промотор
Инициаторный
комплекс
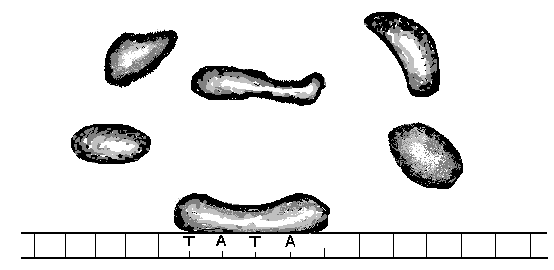
Промотор
Т А Т А
Рис. 13.
Присоединение РНК-полимеразы и
транскрипционных
факторов к ТАТА-боксу
промотора у эукариот
Формирование
инициаторного комплекса происходит на
промоторе. Сама РНК-полимераза, как
правило, не может связаться с промотором.
Поэтому вначале специальный белок
взаимодействует со специфической
областью на промоторе. В этой области
располагается определённая
последовательность нуклеотидов. Эта
последовательность носит название бокс
Прибнова.
Эта
последовательность нуклеотидов богата
адениновыми и тиминовыми нуклеотидами–
ТАТА. Отсюда и другое название этого
участка промотора – ТАТА-бокс. К
специальному белку, осевшему на промоторе,
присоединяется РНК-полимераза и целый
ряд других белков, которые участвуют в
подготовке синтеза РНК. Таким образом,
на первом этапе на промоторе формируется
сложный комплекс, который состоит из
22
специального
белка, осевшего на промотор, РНК-полимеразы
и нескольких белков, которые носят
название транскрипционные факторы
(ТФ). Их несколько – ТФ1, ТФ2, ТФ3 и т.д.
(рис. 13). У эукариот этих факторов намного
больше, чем у прокариот. Совокупность,
состоящая из специального белка,
транскрипционных факторов и РНК-полимеразы
носит название инициаторный комплекс.
После его образования начинается
формирование вилки транскрипции.
Ферменты комплекса (ТФ1, ТФ2 и др.)
раскручивают спираль ДНК, разрывают
водородные связи между нитями. Нити
расходятся. В результате формируется
транскрипционный «глазок» с вилкой
транскрипции. Разошедшиеся нити этой
вилки прочно фиксируются специальными
белками (SSB),
которые могут не входить в инициаторный
комплекс (рис. 14).
Транскрипционный
«глазок»
Белки,
фиксирующие
разошедшиеся
нити
5’ Смысловая
нить
3’
3’ М
нить
5’
5’
РНК-полимераза и
РНК
белки
Рис. 14. Транскрипционный
«глазок»
У прокариот
инициаторный комплекс состоит примерно
из пяти субъединиц-полипептидов и
называется голофермент (холофермент).
В комплексе имеется сигма-субъединица
(СС) или сигма-фактор. Это непостоянная
единица комплекса. Она может выходить
из комплекса, тогда комплекс называется
кор-фермент и вновь входить в него (рис.
15). Функция СС заключается в том, что она
первой связывается с промотором, затем
к ней присоединяется кор-фермент. Без
СС кор-фермент практически не
взаимодействует с промотором (или
взаимодействует очень слабо). Другая
функция СС заключается в том, что этот
белок приводит к стойким изменениям в
структуре других полипептидов
комплекса, в
результате чего голофермент приобретает
способность раскручивать спираль ДНК,
разрывать водородные связи между нитями
ДНК, т.е. формировать вилку транскрипции.
СС находится в голоферменте только на
этапе инициации. Обеспечив связывание
комплекса с промотором, она через
некоторое время после начала транскрипции
покидает комплекс и присоединяется к
новым кор-ферментам (см. далее).
У эукариот
инициаторный комплекс более сложный,
чем у прокариот. Помимо фермента
РНК-полимеразы в него входят более 10
полипептидных субъединиц. У них различная
функция. Часть из них, так же как и СС
прокари-
23
+
=
Рис. 15. РНК-полимераза
в зависимости от присоединения к ней
сигма- субъединицы будет иметь различную
структуру и функцию
от, связывается
с промотором. Затем на них осаждается
РНК-полимераза. Другие субъединицы
участвуют в формировании вилки
транскрипции и т.д.
Следует отметить,
что фермент РНК-полимераза про- и
эукариот имеет активный центр, который
контролирует связывание нуклеотидов
первичного транскрипта между собой. В
случае его блокады активность фермента
падает. Некоторые антибиотики, например
рифампицин и его производные, подавляют
инициацию транскрипции, специфически
связываясь с активным центром в
РНК-полимеразе. Интересно то, что
некоторые бактерии оказались не
чувствительны к антибиотику. Исследования
показали, что у таких бактерий
РНК-полимераза имеет небольшое изменение
в структуре. Это изменение не мешает
синтезировать олигонуклеотид, но не
даёт возможности соединиться с активным
центром антибиотику.
После образования
транскрипционного глазка начинается
следующий этап синтеза РНК – элонгация.
Элонгация
Чаще всего начинается
с присоединения к транскрипционному
комплексу специальных белков – факторов
элонгации, которые запускают процесс
синтеза РНК. Точка на ДНК, где начинается
синтез РНК, называется стартовой
точкой.
РНК-полимераза
вместе с белками двигается по нити ДНК,
последовательно раскручивая спираль.
После синтеза РНК нити ДНК вновь
воссоединяются. Деконденсированной
(свободной) в транскрипционном глазке
находится нить ДНК протяженностью около
20 нуклеотидов. Синтез молекулы РНК
идёт от 5’-конца
синтезированной РНК к 3’
–концу, т.е. при репликации (синтез ДНК)
и при транскрипции наращивание новых
нуклеотидов идёт с 3’-конца
синтезируемой цепи ДНК или РНК. Нить
ДНК, на которой синтезируется РНК,
называется плюс нитью, кодогенной,
антисмысловой, матричной цепью (рис.
16).
24
Скорость синтеза
РНК примерно 30 нуклеотидов в секунду.
РНК-полимераза
Вилка транскрипции Терминатор
Б
Направление
синтеза
Промотор
5’
конец РНК
3’
конец РНК
Рис. 16. Элонгация
Терминация
Несмотря на
многочисленные исследования последнего
этапа транскрипции, ясного представления
о его механизме пока не получено. Если
обобщить имеющиеся сведения, то можно
сделать вывод, что у большинства про- и
эукариот терминация осуществляется
несколькими способами. Сущность их одна
– в зоне терминатора располагаются
специальные элементы, которые останавливают
транскрипцию. Таких элементов в настоящее
время найдено несколько. Назовём только
наиболее исследованные. Их три.
1. В зоне терминации
располагается область, богатая ГЦ
парами.
Химические связи
этих нуклеотидов с комплементарными
нуклеотидами в транскрипте существенно
слабее, чем связи АТ. Это облегчает отрыв
синтезированной РНК от ДНК.
2. В терминаторе
имеются «шпильки ДНК».
Другой механизм
связан с имеющимися в области терминатора
последовательностями нуклеотидов,
которые носят название – инвертированные
повторы (см. рис. 17, А). Это два участка
молекулы ДНК, следующие друг за другом,
имеющие одинаковую последовательность
нуклеотидов, но расположенные в
противоположной (обратной) ориентации.
Так, например, последовательности,
представленные на рисунке 17, А, являются
инвертированными, так как при их чтении
от 5’ к 3’-концу они идентичны в обеих
цепях. Такое расположение нуклеотидов
в ДНК терминатора приводит к тому, что
при их считывании на РНК образуются
участки с комплементарными
последовательностями нуклеотидов (рис.
17, Б). Последние соединяются между собой
и формируют фигуру, которая носит
название «шпилька» (см. рис. 17, В). Эта
шпилька, сформированная на пути
РНК-полимеразы, прекращает её движение.
В некоторых случаях «шпильку» распознаёт
специальный белок, который движется по
вновь синтезированной цепочке РНК вслед
за РНК-полимеразой. Обнаружив шпильку,
белок прекращает движение фермента. У
прокариот инвертированные повторы
обнаруживаются
25
практически в
каждом терминаторе. В последнее время
появились данные о более сложных
механизмах терминации транскрипции у
эукариот.
-
Бессмысленные
(нонсенс) кодоны.
Они не кодируют
никакую аминокислоту. Предполагают,
что опознав их, РНК-полимераза прекращает
синтез РНК.
Последовательность
нуклеотидов в ДНК, которая находится
между стартовой точкой и терминатором
называется единицей транскрипции.
Транскрибируется, как правило, одна из
двух цепей ДНК. Могут, но редко,
транскрибироваться обе цепи одного
гена.
Формирующаяся РНК
на нити ДНК носит название транскрипт
или РНК-транскрипт.
2. Ошибки спаривания
при транскрипции.
Лекарственные
препараты и транскрипция
При транскрипции,
так же как и при любом матричном процессе,
происходят ошибки. Их называют ошибки
спаривания. Эти ошибки происходят с
частотой – одна ошибка на 2х104
включённых нуклеотидов. Как мы отмечали
при репликации ошибки возникают намного
реже – одна на 1010
включений.
При ошибках спаривания в растущую нить
РНК включаются «неправильные» основания.
Это может привести к изменению структуры
РНК. Если это касается рРНК или тРНК,
то, как правило, такие «дефектные» РНК
перестают выполнять свои функции –
формирование рибосом и транспорт
аминокислот. Но это практически не
отражается на здоровье человека, т.к.
появление одной «дефектной» молекулы
РНК приходится на несколько тысяч
нормальных молекул, к тому же ошибочное
спаривание очень редкое явление. Более
неблагоприятный прогноз бывает связан
с появлением ошибки спаривания в иРНК
– молекуле, несущей информацию об
аминокислотной последовательности
белка. В этом случае вероятность
реализации генетического дефекта в
фенотипический определяется характером
нуклеотида, образованного при ошибке
спаривания. Хорошо, если в результате
«вырожденности» третьего основания
триплета, новый кодон кодирует ту же
аминокислоту. Такая ошибка фенотипически
не проявляется (см. ранее). Подсчитано,
что в 67% случаев смысл кодона не меняется
при замене нуклеотида в третьем положении
кодона. Хуже когда сформированный на
основании ошибки спаривания кодон
меняет смысл и начинает кодировать
другую аминокислоту. Это приводит к
появлению в белке новой аминокислоты,
которая может изменить функциональные
свойства белка и последний выключится
из клеточного метаболизма. Но и в этом
случае новая аминокислота может по
физико-химическим свойствам (например,
растворимости) быть сравнима с заменённой.
Фенотипические последствия такой замены
менее опасны.
В целом необходимо
отметить, что ошибки спаривания на
уровне транскрипции менее опасны, чем
на уровне репликации.
Транскрипцию могут
ингибировать различные соединения.
Так, например, опасный шляпочный гриб
бледная поганка содержит токсин
альфа-аманитин.
26
Терминатор
Инвертированные
последовательности
А
А
РНК-полимераза
РНК-полимераза
Б
В
5’
Рис. 17. Терминация.
Образование «шпильки» на РНК при
считывании инвертированных повторов
на матричной нити ДНК. А
– РНК-полимераза «подходит» к области
терминатора. У последнего имеется
инвертированный повтор. Б – РНК-полимераза
синтезировала РНК, в которой имеются
последовательности, комплементарные
инвертированному повтору на матричной
нити ДНК. В – нуклеотиды инвертированного
повтора на РНК сформировали связи, что
привело к образованию «шпильки».
Транскрипция прекратилась
Три характерных
признака этого гриба необходимо помнить
– бледный цвет, «юбочка» на ножке и
булавовидное утолщение в нижней части
ножки.
Этот токсин прочно
связывается с РНК-полимеразой II
у эукариот, которая транскрибирует
иРНК. В результате блокируется транскрипция
многих генов.
Другой токсин –
актиномицин Д является антибиотиком и
прочно связывается с ГЦ-богатыми
участками ДНК. А поскольку такими
участками обогаще-
27
ны рРНК и терминаторы
многих генов, то эти структуры страдают
в первую очередь.
Как мы отмечали
ранее, некоторые противоопухолевые
препараты, например дауномицин и
некоторые другие, содержат в своей
молекуле плоскую циклическую структуру,
которая встраивается (интеркалируется)
между парами оснований. Это ведёт к
локальному изменению структуры ДНК, в
результате чего ферменты транскрипции
прекращают свою работу.
Некоторые
алкилирующие вещества – тиофосфамид
и др. модифицируют основания в ДНК путём
присоединения к ним алкильных группировок.
Если ферменты транскрипции встречают
такие основания, их работа прекращается.
Ингибитор
ДНК-топоизомеразы – новобиоцин,
вмешиваясь в работу фермента, прекращает
деспирализацию ДНК, а, следовательно,
и синтез РНК.
Антибиотик
рифампицин ингибирует только РНК-полимеразу
бактерий, препятствуя инициации
транскрипции. Применяют его при различных
заболеваниях, так как он не действует
на ядерную РНК-полимеразу соматических
клеток человека. К сожалению, в последнее
время обнаружено действие рифампицина
на РНК- полимеразу митохондрий, где
также осуществляется транскрипция
митохондральных РНК. Это является ещё
одним подтверждением версии о том, что
митохондрии являются потомками
прокариотических или иных субмикроскопических
структур, внедрившихся в клетки эукариот
и адаптировавшихся к их метаболизму
так, что стали его полноправными
участниками.
Резюме.
Транскрипция – первый этап экспрессии
генов и заключается она в синтезе РНК
на одной нити ДНК ферментом ДНК-зависимой
РНК-полимеразой (РНК-полимеразой). Состоит
из трёх этапов – инициации, элонгации
и терминации. Во время инициации
формируется инициаторный комплекс,
состоящий из белка, прикреплённого к
промотору, РНК-полимеразы и нескольких
факторов инициации. Одновременно
формируется транскрипционный «глазок».
Во время элонгации происходит наращивание
нити РНК в соответствии с комплементарными
нуклеотидами на матричной (антисмысловой)
цепочке ДНК. Сигналом терминации является
определённая последовательность
нуклеотидов в матричной цепочке ДНК.
При транскрипции чаще, чем при репликации
возникают ошибки при спаривании
нуклеотидов.
3.Посттранскрипционные
процессы. Процессинг (созревание РНК)
Это совокупность
процессов, обеспечивающих превращение
синтезированной РНК (РНК-транскрипта)
в функционально активные РНК (зрелые
РНК), которые могут быть использованы
при синтезе белков. Сами РНК-транскрипты
функционально не активные.
В результате
процессинга изменяется структура и
химическая организация РНК. РНК-транскрипт
до образования зрелой РНК носит название
про-иРНК (или в зависимости от вида РНК
– про-тРНК, про-рРНК), т.е. предшественница
РНК. Практически все РНК-транскрипты
эукариот и прокариот (за
исключением
28
иРНК прокариот)
подвергаются процессингу. Превращение
РНК-транскрипта в зрелую РНК начинается
в ядре, когда синтез РНК ещё не закончен,
и она не отделилась от ДНК. В зависимости
от механизмов различают несколько
этапов созревания РНК:
-
Взаимодействие
про-иРНК с белком. -
Метилирование
про-иРНК. -
Кэпирование
5’-конца. -
Полиаденилирование.
-
Сплайсинг.
Графическая
последовательность этапов изображена
на рисунке 18. Следует отметить, что в
живых организмах все вышеперечисленные
процессы идут параллельно друг другу.
3.1.
Взаимодействие
про-иРНК с белком
У бактерий ещё до
окончания транскрипции 5’-конец
транскрипта сразу же соединяется с
рибосомой и иРНК включается в трансляцию.
Поэтому, для бактериальной иРНК
практически никакой модификации не
требуется. У эукариот синтезированный
транскрипт выходит из ядра, попадает в
цитоплазму и там соединяется с рибосомой.
На своём пути он должен быть ограждён
от случайных встреч с сильными реагентами
и в тоже время должен быть доступен
ферментам процессинга. Поэтому
РНК-транскрипт сразу же по мере удлинения
взаимодействует с белком. Здесь уместна
аналогия – РНК-транскрипт располагается
на белке как на операционном столе, он
фиксируется химическими связями,
одновременно в нём становятся доступными
места модификации. РНК, связанная с
белком, носит название рибонуклеопротеид
(информосома). В такой форме транскрипт
находится в ядре. При выходе из ядра
одни РНК продолжают оставаться в
соединении с белком, другие выходят из
комплекса и принимают участие в
трансляции.
3.2. Метилирование
про-иРНК
Чаще всего происходит
у бактерий, у которых имеется специальный
аппарат защиты от чужеродной ДНК
(фаговой). Этот аппарат состоит из целого
ряда ферментов, разрезающих чужеродную
ДНК или РНК в определённых сайтах, в
которых находится специфическая
последовательность нуклеотидов. Ферменты
носят название рестриктазы.
Понятно, что собственный, только что
синтезированный РНК-транскрипт, также
может быть подвергнут атаке рестриктаз.
Чтобы это не случилось, специальные
ферменты, называемые метилазами,
метилируют собственный РНК-транскрипт
в тех сайтах, которые могут быть разрезаны
рестриктазами. У эукариот РНК-транскрипт
метилируется в меньшей степени.
29
3.3. Кэпирование
5’-конца
Заключается в
химическом и конформационном изменении
5’-конца синтезированной РНК. Кэпирование
происходит в момент синтеза РНК, ещё до
её отделения. Процесс заключается в
присоединении к свободному концу про-РНК
специальных химических веществ, которые
изменяют конформацию концевого участка.
Кэпирование необходимо для инициации
процесса трансляции.
Промотор
Терминатор
Транскрипция
Про-иРНК
П
фикси-
Белок

на белке
М
про-иРНК
К
про-иРНК
П
Сплайсинг
(см. далее)
Рис. 18. Схема
основных моментов процессинга
Специальные
ферменты присоединяют к 5’-концу про-иРНК
ГДФ (гуанозиндифосфат), а затем метилируют
его (рис. 19).
Функции КЭПа:
-
Инициирует
синтез белка. -
Предохраняет
про-иРНК от распада. -
Участвует в
удалении интронов.
3.4. Полиаденилирование
Это процесс
присоединения к 3’-концу про-иРНК 100 –
200 остатков адениловой кислоты (рис.
20).
30
ГДФ
5’
про-иРНК
СН3
КЭП
= ГДФ + СН3
Рис. 19. Структура
КЭПа на 5’-конце пре-иРНК эукариот
Эти остатки носят
название поли-А последовательности
(поли-А хвосты). Полиаденилированию
подвергаются не все про-иРНК. Например,
молекулы иРНК всех типов гистонов не
содержат поли-А последовательности.
Полиаденилирование предохраняет иРНК
от разрушения.
На растущей цепи
и-РНК имеется специальная последовательность
нуклеотидов (ААУААА). Особый фермент
(полиА-полимераза) находит это сочетание
нуклеотидов, разрезает про-иРНК в этом
месте и формирует полиадениловый
хвостик.
Значение поли-А
последовательностей:
-
Облегчают
выход иРНК из ядра в цитоплазму.
2.Предохраняют
иРНК от разрушения.
ГТФ
ПолиА —
последовательность
рАрАрАрАрАрАрАрА-ОН
СН3
КЭП =
ГТФ + СН3
Рис. 20. Структура
КЭПа на 5’-конце про-иРНК эукариот и
полиадениловая последовательность на
3’-конце про -иРНК
Недавно было
выявлено ещё одно интересное свойство
поли-А последовательностей – они
участвуют в терминации синтеза про-иРНК.
РНК-полимераза, формируя последовательность
ААУААА в про-иРНК, получает сигнал о
завершении синтеза РНК-транскрипта. Но
синтез сразу не прекращается. Полная
остановка его наступает после того, как
РНК-полимераза встречает на матричной
нити ДНК специфическую последовательность
нуклеотидов (у разных генов она разная),
которая и даёт окончательный сигнал о
прекращении синтеза РНК.
31
3.5. Сплайсинг
В РНК-транскрипте
содержится определённое количество
нуклеотидных последовательностей,
которые были необходимы для успешного
завершения транскрипции и последующей
модификации транскрипта (кэпирования,
полиаденилирования и т.д.). Для выполнения
основной роли РНК в цитоплазме –
трансляции эти последовательности не
только не будут иметь функционального
значения, но могут помешать нормальному
течению синтеза белка. Поэтому в клетке
предусмотрен механизм освобождения
первичного транскрипта от целого ряда
последовательностей, не имеющих решающего
значения в трансляции.
К таким
последовательностям прежде всего
относят интроны.
Ген, с которого
транскрибировалась про-иРНК, содержит
кодирующие и некодирующие последовательности.
Кодирующие последовательности гена
определяют аминокислоты и их
последовательность в белке. Некодирующие
последовательности таким свойством не
обладают. Кодирующие и некодирующие
последовательности в гене чередуются,
и их количество зависит от индивидуальных
генов. В первичном транскрипте также
содержатся кодирующие и некодирующие
последовательности. Такая организация
генов и про-РНК характерна для эукариот.
Некодирующие последовательности
про-иРНК носят название интроны, а
кодирующие – экзоны. Длина интронов
может быть от 50 до 12000 нуклеотидов. Ген
начинается и заканчивается экзоном.
Чередующееся строение гена характерно
для большинства эукариот. Интроны могут
содержать все виды РНК – иРНК, тРНК,
рРНК.
Вся совокупность
экзонов (кодирующих участков) в геноме
человека занимает всего 1,1 – 1,4 %. Средний
ген человека содержит 9 интронов. По
мере упрощения организации организмов
совокупная величина их экзонов возрастает
(например, у бактерий она равна 86 %).
Экзон 1
Интрон Экзон 2
А
Д
Б
Е
В
Петля
интрона
вырезана
Г
Ж
Рис. 21. Схема
сплайсинга (объяснение в тексте)
32
В вырезании интронов
из РНК-транскрипта и сшивании оставшихся
экзонов принимает участие многокомпонентный
комплекс. Основными его составляющими
являются малые ядерные РНК (мяРНК) и
белки-ферменты.
В целом комплекс
носит название малые ядерные
рибонуклеопротеиды, мяРНП или сплайосома.
Сам процесс достаточно сложен и состоит
из нескольких этапов (см. рис. 21).
1. Формирование
сплайосомы. К началу и концу интрона
прикрепляются фрагменты белка и мяРНК
(рис. 21, Д), формируя сплайосому. Прикрепление
комплекса мяРНП (рис. 21, Е).
-
Сближение
соседних экзонов за счёт образования
петли интрона. Разрезание на границе
экзон-интрон и соединение соседних
(первого и второго) экзонов (рис. 21, В). -
Удаление и
разрушение петли и сплайосомы (рис. 21,
Г, Ж).
Необходимо отметить,
что при повреждении (мутации) интрона
сплайсинг может быть не закончен, интрон
не вырезан и конечный продукт – иРНК
будет нести несвойственные ей
последовательности нуклеотидов. Понятно,
что это может привести к нарушению
трансляции и выключению из метаболизма
опре-
делённого белка.
3.6. Альтернативный
сплайсинг
Такой тип сплайсинга
происходит при экспрессии одного и того
же гена в разных тканях. Сущность его в
том, что один и тот же участок гена в
разных тканях может выступать в качестве
интрона и экзона. Это приводит к
образованию разных иРНК, которые кодируют
белки с различной ферментативной
активностью.
Так в клетках
щитовидной железы синтезируется гормон
кальцитонин. Он тормозит высвобождение
кальция из костей.
Ген, контролирующий
синтез кальцитонина, состоит из 6
экзонов, первичный транскрипт этого
гена (про-иРНК) также состоит из 6 экзонов
(рис. 22). Из первичного транскрипта
формируется зрелая иРНК, содержащая 4
экзона – 1,2,3,4. Экзоны № 5 и 6 были прочитаны
как интроны и вырезаны. На основе такой
иРНК синтезируется кальцитонин. В
клетках головного мозга из первичного
транскрипта, содержащего 6 экзонов,
формируется зрелая иРНК, состоящая из
5 экзонов – 1,2,3,5,6. Четвёртый экзон был
вырезан как интрон. Такая иРНК контролирует
синтез кальцитонинподобного белка,
отвечающего за вкусовое восприятие.
Другой ген Icarus
(названный в честь легендарного Икара)
способен обеспечить за счёт альтернативного
сплайсинга синтез 6 различных полипептидов.
Кроме этого полипептиды образуют между
собой в клетке около 20 различных
ансамблей из одних и тех же полипептидов
или различных.
Нарушение механизма
сплайсинга может привести к патологическим
состояниям, которые носят общее название
талассемии. К ним относят заболевания,
связанные с частичным или полным
подавлением синтеза одной из цепей ге-
33
Ген,
контролирующий кальцитонин
э
и э и э и э и э и
э
Д
1
2 3 4 5 6
э
и э и э и э и э и
э
про-иРНК
1
2 3 4 5 6
В щитовидной
железе В клетках головного
мозга
иРНК
1 2
3 4 1 2 3 5 6
Кальцитонин
Кальцитонинподобный
белок
Рис.22. Альтернативный
сплайсинг кальцитонина и кальцитонинподобного
белка
моглобина (α- или
β-цепи). Например, болезни, связанные с
недостатком синтеза β -цепи гемоглобина,
могут возникнуть в результате мутаций
в двух участках гена, кодирующего β-цепь
– в сайте, ответственном за полиаденилирование
и в одном из интронов. В первом случае
нарушается процесс формирования
полиаденилового хвостика и формируется
неполноценная β-цепь гемоглобина. Во
втором случае сплайосома не способна
вырезать повреждённый интрон и зрелая
иРНК β-цепи гемоглобина не образуется.
В любом случае нормальная функция
эритроцитов будет существенно нарушена.
Резюме.
Процессинг (или созревание РНК) –
это процесс
превращения только что синтезированной,
не активной РНК (про-иРНК) в функционально
активную РНК. Процесс связан со
структурными и химическими модификациями
про-иРНК. Он происходит в ядре до момента
выхода РНК в цитоплазму и состоит из
нескольких этапов: присоединение
про-иРНК к белку, метилирование некоторых
оснований, маркировка одного из концов,
полиаденилирование друго-
34
го (противоположного)
конца, вырезания интронов и сшивания
экзонов. Последние два процесса носят
название сплайсинг.
ТРАНСЛЯЦИЯ
-
Общее
представление о трансляции.
Материальное
обеспечение процесса
Трансляция – это
процесс переноса информации (декодирование
её) в рибосомах с иРНК в аминокислотную
последовательность белка. Это сложный
процесс, имеющий собственное сырьевое,
ферментативное и энергетическое
обеспечение.
В трансляции
задействованы следующие органические
соединения и органоиды:
-
иРНК.
-
тРНК.
-
рРНК.
-
Различные ферменты.
-
Рибосомы.
-
АТФ.
Рассмотрим их
подробнее.
1) иРНК.
В предыдущем
разделе мы описали как «созревает» иРНК
во время и после транскрипции. У эукариот
этот процесс идёт практически всё время
пока иРНК находится в ядре, где она
связана с белком и представляет собой
рибонуклеопротеид, называемый
информосомой. Переходя в цитоплазму,
иРНК выходит из комплекса с ядерным
белком и через ядерные поры попадает в
цитоплазму, где вновь связывается с
белком, формируя цитоплазматическую
информосому. В виде информосомы иРНК
может существовать в цитоплазме
достаточно долго.
Фактически это
выработанная в эволюции форма депонирования
иРНК в клетке. При необходимости, например
во время митоза, когда сильная компактизация
хромосом практически выключает синтез
всех видов РНК, информосомы распадаются
и освободившаяся иРНК включается в
трансляцию.
2) тРНК.
тРНК в ядре, также
как и иРНК, соединена с белком и
представляет собой рибонуклеопротеид.
Попадая в цитоплазму, она также соединяется
с белками. Основная функция тРНК –
доставка аминокислот к месту синтеза
белка.
Существует около
20 тРНК. Их пространственная структура
универсальна (см. рис. 23).
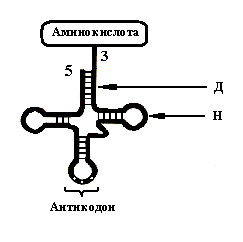
Отметим три
особенности в структуре тРНК.
1. Наличие в тРНК
минорных оснований. Эти основания
существенно отличаются по физико-химическим
параметрам от классических оснований,
имеющихся в иРНК и рРНК. Это придаёт
молекуле тРНК целый ряд свойств, которые
не характерны для других РНК. Например,
молекулы тРНК достаточно
35
Рис. 23.
Пространственная структура тРНК
стойкие и не
подвергаются разрушительному действию
внутриклеточных нуклеаз.
2. В нити тРНК
выявлены участки, где имеются обратные
повторы нуклеотидов. Это приводит к
тому, что при сближении между собой
обратные повторы создают двунитчатые
структуры за счёт образования
комплементарных пар между основаниями
обратных повторов. На рисунке один такой
участок обозначен буквой «Д». Другие
участки тРНК из-за отсутствия
комплементарных повторов остаются
неспаренными. На этом же рисунке один
такой участок обозначен буквой «Н».
Наличие в нити тРНК участков с уникальной
последовательностью нуклеотидов и
обратными повторами создаёт своеобразную
вторичную структуру тРНК, называемую
«кленовым листом».
3. В структуре тРНК
имеются две области, значимые для
трансляции – область антикодона
и область
присоединения аминокислоты. Антикодон
– группа из трёх нуклеотидов,
располагающаяся примерно в середине
тРНК. Антикодон занимает фиксированное
положение и комплементарен кодону,
находящемуся в информационной РНК.
Другая область – 3’
–конец тРНК. К нему специальный фермент
присоединяет аминокислоту. Комплекс
тРНК с аминокислотой носит название
аминоацил-тРНК. Таким образом, в синтезе
белка принимают участие не свободные
аминокислоты, а аминокислоты в составе
аминоацил-тРНК.
Фермент, который
присоединяет аминокислоту к тРНК, имеет
два распознающих центра (рис.24). Один
центр определяет необходимую тРНК путём
взаимодействия с некоторыми специфическими
областями на её молекуле (петлями и в
некоторых случаях с антикодоном). Другой
центр распознаёт среди массы окружающих
его в цитоплазме аминокислот ту, которая
соответствует триплету в антикодоне.
После того как фермент определил
необходимую
36
Аминокислота
Петля
тРНК
Фермент
А
Б
В
Рис.24. Схема
формирования аминоацил-тРНК. А
– компоненты– тРНК, аминокислота,
фермент; Б – фермент присоединяет
аминокислоту к тРНК в соответствии с
петлёй тРНК; В – после присоединения
фермент удаляется, а тРНК остаётся с
присоединённой аминокислотой
тРНК и аминокислоту
происходит присоединение аминокислоты
к 3’-концу
тРНК.
3) рРНК
рРНК синтезируются
на структурных генах и после процессинга
накапливаются в ядрышке ядра. В ядрышке
в зависимости от молекулярного веса
различают несколько типов рРНК. Все они
участвуют в строительстве рибосом,
являясь своеобразным каркасом, к которому
прикрепляется множество различных по
структуре и функции белков. Объединяет
белки то, что они являются участниками
различных этапов трансляции. Белки в
ядрышко поступают через ядерные поры
из цитоплазмы. Таким образом, в ядрышках
формируются «полуфабрикаты» малой и
большой субъединиц рибосом. В таком
виде они выходят через ядерные поры в
цитоплазму, где формирование малой и
большой субъединиц полностью заканчивается.
В полностью сформированной малой
субъединице расположена одна рРНК, в
большой – их несколько. рРНК, находясь
в рибосомах, выполняет несколько функций,
главные из которых следующие:
— рРНК является
каркасом для формирования белковой
основы рибосом,
— рРНК принимает
участие в формировании инициаторного
комплекса,
— рРНК обеспечивает
взаимодействие тРНК с мРНК.
В цитоплазме малая
и большая субъединицы находятся в
диспергированном состоянии (отдельно
друг от друга).
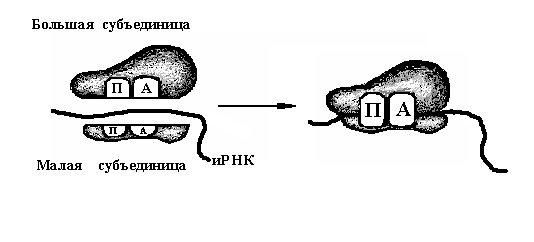
4) Рибосома.
Состоит из малой
и большой субъединиц. Важно отметить,
что в большой и малой субъединице имеются
два функциональных центра: –
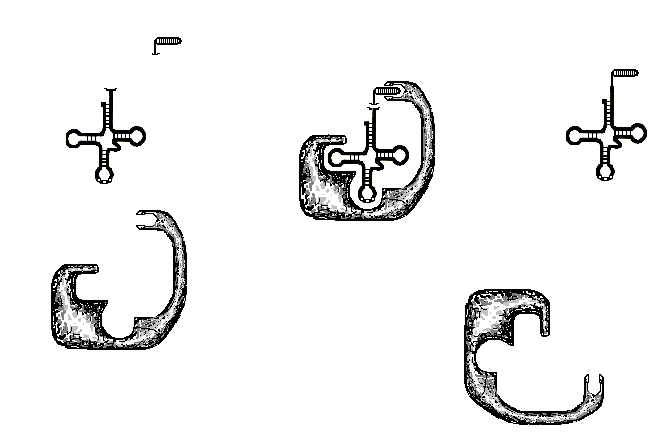
«П» (пептидильный) и «А» (аминоацильный),
объединяющиеся после соединения
субъединиц (рис. 25).
37
Рис. 25. Два
функциональных центра в рибосоме до
соединения субъединиц и после
Процесс трансляции,
как и любой процесс матричного синтеза,
состоит из трёх стадий – инициации,
элонгации и терминации.
2. Периоды
трансляции
Инициация
Рибосомы находятся
в цитоплазме в трёх состояниях:
— диспергированном,
когда большая и малая субъединицы
находятся отдельно друг от друга;
— в состоянии
комплекса, когда малая и большая
субъединицы объединены в один ансамбль,
а между ними проходит иРНК;
— в форме полирибосомы
(полисомы) – на одну нить иРНК «нанизаны»
несколько рибосомальных комплексов.
Каждый из них синтезирует белок.
Во время инициации
происходит процесс формирования
инициаторного комплекса. В него входит
три следующих друг за другом этапа.
1. Малая субъединица
рибосомы определяет 5’-конец
иРНК, содержащий «кэп», и присоединяется
к нему.
2. Скользя по иРНК,
малая субъединица «находит» расположенный
вблизи «кэпа» стартовый кодон. В этом
месте субъединица останавливается и
фиксируется на иРНК. Сформировалась
система, состоящая из двух элементов —
малой субъединицы и нити иРНК. Система
устроена таким образом, что в малой
субъединице располагается только 2
кодона, каждый из них занимает свою
активную область или центр, либо П-центр,
или А-центр. Стартовый кодон располагается
в функциональном центре «П» (рис. 26, А).
В другом функциональном центре (А)
располагается кодон первой аминокислоты,
входящей в белок. Ещё раз подчеркнём,
что два функциональных центра в малой
субъединице не активны. Они активируются
только при присоединении большой
субъединицы, в которой находятся
аналогичные центры П и А.
38
Кэп
Стартовый кодон
А
+
=
Малая
субъединица
иРНК
Б
+ =
Метиониновая
Инициаторный
аминоацил-тРНК
комплекс
В
+
=
Большая
субъединица
Рис. 26. Схема
формирования инициаторного комплекса
и рибосомы. А
– малая субъединица рибосомы соединяется
с иРНК, Б – антикодон метиониновой-тРНК
соединяется с кодоном иРНК в участке
«П». Формируется инициаторный комплекс,
В – инициаторный комплекс соединяется
с большой субъединицей рибосомы.
Формируется рибосома
У многих организмов
стартовый кодон (или инициирующий кодон)
в иРНК содержит триплет, комплементарный
антикодону аминоацил-тРНК, несущей
метионин. С метионинового кодона, как
правило, начинается синтез белка.
3. К стартовому
кодону, находящемуся в «П» участке,
прикрепляется аминоацил-тРНК, несущая
аминокислоту метионин. Комплекс,
состоящий из малой субъединицы рибосомы,
иРНК, метиониновой-тРНК, называют
инициаторным комплексом (рис.26, Б).
Элонгация
Как только к
инициаторному комплексу присоединяется
большая субъединица рибосомы, начинается
этап элонгации. С присоединением большой
субъединицы в рибосоме формируется два
полноценных функциональных центра «П»
и «А». В обоих центрах размещаются только
два кодона иРНК. В центре «П» находится
метиониновая-тРНК, а к участку «А»,
который открыт в цитоплазму, пробуют
присоединиться аминоацил-тРНК, несущие
разные аминокислоты. Присоединяется
только та аминоацил-тРНК, антикодон
которой компле-
39
Инициаторный
комплекс
3’
Б
А
3’
3’
Г
В
3’
3’
Д
Е
3’
3’
Ж
З
Рис. 27. Схема
трансляции. А
– компоненты аппарата трансляции
(малая, большая субъединицы рибосом,
иРНК, аминоацил-тРНК, тРНК и аминокислоты)
в цитоплазме перед началом синтеза
белка, Б – инициаторный комплекс, В –
начало элонгации. Большая и малая
субъединица соединены, в функциональном
центре «П» аминоацил-тРНК с метионином
(М), Г – в функциональном центре «А»
аминоацил-тРНК с триптофаном (Т), Д –
соединение аминокислот метионина и
триптофана в функциональном центре
«А», Е – образовался дипептид, состоящий
из аминокислот метионина и триптофана,
Ж – перемещение аминокислот вместе с
иРНК в центр «П», З – центр «А» заполнен
аминоацил-тРНК, которая несёт аминокислоту
глицин (Г).
ментарен кодону
иРНК, находящемуся в «А» участке. В
нашем случае в «А»участок попадает
триптофановая аминоацил-тРНК (Т) (рис.27,
В, Г).
Специальные
ферменты соединяют пептидной связью
две аминокислоты, находящиеся в
функциональных участках между собой
(рис. 27, Д). Одновремен-
но происходит
разрыв между тРНК и аминокислотой
метионином. Метионин ос-
40
таётся присоединённым
к триптофану в участке «А», а в участке
«П» находится освобождённая от
аминокислоты тРНК (рис. 27, Е). Специальный
фермент, используя энергию макроэргов
(АТФ) продвигает рибосому по иРНК на
один триплет (шаг) по направлению к 3’
-концу иРНК.
При этом из участка «П» тРНК освобождается
и выходит в цитоплазму, а её место
занимает аминоацил-тРНК, несущая
триптофан (Т) и прикреплённый к триптофану
метионин (М). «А» центр становится
свободным и на кодон, находящейся в нём
иРНК, начинают претендовать другие
цитоплазматические аминоацил-тРНК
(рис. 27, Ж). Присоединяется та аминокислота,
антикодон которой комплементарен кодону
иРНК «А» участка (рис. 27, З). Затем цикл
повторяется.
Функциональные
обязанности малой и большой субъединиц
рибосом различны. Малая субъединица
присоединяет аминоацил-тРНК (т.е.
декодирует информацию), а большая
субъединица отвечает за образование
пептидной связи между аминокислотами.
Терминация
Окончание трансляции
происходит тогда, когда в «А» участок
рибосомы попадает один из стоп-кодонов
(УАГ, УАА, УГА). Для них нет соответствующих
аминоацил- тРНК и процесс синтеза белка
останавливается.
К стоп-кодону
присоединяются факторы терминации
(белки), которые активируют ферменты,
находящиеся в рибосомах. Эти ферменты,
в свою очередь, осуществляют процесс
отщепления синтезированного белка от
тРНК и вызывают диссоциацию рибосомы
на субъединицы. Следует отметить
интересный феномен, наблюдаемый во
время терминации. Ранее мы отмечали (см
раздел «Процессинг»), что конец нити
иРНК, где располагается терминатор,
заканчивается полиадениловым «хвостиком»
–
поли-А. При окончании синтеза полипептида,
рибосома отсоединяется от нити иРНК,
«откусывая» при этом одно адениловое
основание от поли-А. Следующая рибосома,
завершив синтез, также отщепляет одно
основание и т.д. Как только все основания
будут утрачены, иРНК разрушается
ферментами. Таким образом, поли-А являются
своеобразными биологическими часами,
отмеряющими длительность существования
иРНК и количество синтезированных с
определённой иРНК белков. Чем длиннее
поли-А, тем больше молекул белка будет
синтезироваться с этой иРНК и наоборот.
Нарушение
трансляции
Трансляция, как и
другие процессы матричного синтеза,
может быть нарушена различными факторами
внутренней и внешней среды. Достаточно
часто такие нарушения связаны с
воздействием на процесс химических
агентов самой различной природы. В
медицинской практике нарушение трансляции
может происходить при употреблении
антибиотиков. В этом случае в основе
механизма повреждения ДНК чаще всего
лежат три феномена.
41
1. Антибиотик может
связаться с активным центром рибосомы
(например,
с «П» или «А»
центром) и блокировать взаимодействие
с этим центром участников процесса
трансляции. Так стрептомицин связывается
с «П», а тетрациклин с «А» центром рибосом
у микроорганизмов, полностью подавляя
их активность. Следует отметить, что в
рибосоме человека другая структура
этих центров, поэтому с ними эти
антибиотики не связываются. Однако
другой антибиотик – пуромицин связывается
с «А» центром рибосом человека и
прекращает трансляцию. Понятно, что в
качестве лекарственного препарата его
можно использовать с очень большой
осторожностью.
2. Другой механизм
действия веществ, нарушающих синтез
белка, заключается в присоединении их
к какому-либо ферменту-участнику синтеза.
В этом случае фермент выключается из
процесса. Так, дифтерийный токсин
инактивирует некоторые ферменты на
этапе элонгации.
3. Дистантный
механизм действия химических соединений
заключается в воздействии химического
агента не на сам процесс трансляции, а
на структуры, которые определяют его
течение. Такие структуры располагаются
в различных областях клетки. Ими могут
быть рецепторы, располагающиеся на
поверхности плазматической мембраны.
Химический агент, связываясь с рецептором,
индуцирует в цитоплазме цепочку
биохимических реакций, которые влияют
на интенсивность трансляции, вплоть до
её полного прекращения. Примерно так
действует интерферон.
Резюме.
Трансляция –
это перевод информации из полинуклеотидной
последовательности иРНК в аминокислотную
последовательность белка. Осуществляется
этот перевод путём синтеза белка на
матрице – иРНК. В трансляции принимают
участие рибосомы, тРНК, рРНК, различные
ферменты. Состоит из трёх этапов –
инициации, элонгации и терминации. На
стадии инициации образуется инициаторный
комплекс, который состоит из малой
субъединицы рибосомы, иРНК, тРНК, несущей
метионин. После присоединения к нему
большой субъединицы рибосомы наступает
стадия элонгации, которая заключается
в присоединении тРНК, несущих аминокислоты
к иРНК, и связывании аминокислот друг
с другом. Процесс происходит в двух
активных центрах, расположенных на
границе малой и большой субъединиц.
Трансляция заканчивается, когда в
рибосому попадает «бессмысленный»
кодон, не кодирующий аминокислоты.
3. Посттрансляционные
процессы. Фолдинг и модификация белка
После освобождения
синтезированной полипептидной цепи из
связи с рибосомой начинается фолдинг
– сворачивание полипептидной цепи в
определённую третичную структуру. В
этом процессе могут принимать участие
специальные соединения, находящиеся в
клетке. Небольшие полипептидные цепочки
приобретают третичную структуру
спонтанно. В укладке полипептидов с
высоким молекулярным весом принимают
участие специальные ферменты, например
42
шапероны и такие
ионы как кальций. Другой, не менее важный
процесс – модификация некоторых белков
заключается в присоединении к ним
углеводного или
другого компонента.
В результате формируются сложные белки,
например, гликопротеины.
ЭКСПРЕССИЯ ГЕНОВ.
ОСОБЕННОСТИ ЭКСПРЕССИИ ГЕНОВ
У ПРО- И ЭУКАРИОТ
Термин «экспрессия
гена» происходит от латинского слова
expression
– выражение. В зависимости от типа гена
его информация может быть выражена в
структуру какой-либо РНК (тРНК, рРНК или
мяРНК) или в структуру определённого
белка (белка-фермента, строительного
белка, сигнального белка, белка-регулятора
и т.д.). Поэтому существует несколько
определений экспрессии гена.
Мы рассмотрим
определение, характерное для генов,
несущих информацию о белке-ферменте.
Для них наиболее распространённым
понятием экспрессии является следующее:
экспрессия генов –
это совокупность процессов в клетке,
обеспечивающих реализацию информации
гена в признак.
1. Этапы экспрессии
генов у эукариот
В сформированном
организме эукариот экспрессия
структурных генов, несущих информацию
о структуре белка, состоит из нескольких
этапов: транскрипции – процессинга –
трансляции – фолдинга – биохимического
процесса, участником которого является
белок-фермент – физиологической реакции
и признака. Сразу же отметим, что мы
представили наиболее полную схему
экспрессии генов. На самом деле для
некоторых структурных генов, кодирующих
ферменты, этапы экспрессии могут быть
другие. Например, может отсутствовать
фолдинг, может отсутствовать физиологический
процесс и биохимический цикл может
сразу реализоваться в какой-либо признак
и т.д.
2. Особенности
экспрессии генов у прокариот
Последовательность
событий, приводящих к экспрессии генов
у прокариот, в целом сходны с таковыми
для эукариот. Однако есть и существенные
отличия. Приведём наиболее значимые из
них.
-
В реализации
генетической информации у прокариот
отсутствует процессинг. -
Поскольку в
прокариотической клетке отсутствует
пространственное разграничение ядра
и цитоплазмы, а так же по ряду других
причин у прокариот процессы транскрипции
иРНК и трансляции с этой иРНК информации
происходят одновременно.
Цепочка реализации
гена в признак у прокариот короче, т.к.
упрощён (или отстутствует) громоздкий
аппарат физиологических реакций.
43
3. Регуляция
экспрессии гена
Одно из замечательных
свойств про- и эукариот заключается в
их способ-
ности осуществлять
дифференциальную регуляцию экспрессии
генов. Это даёт возможность клеткам и
организмам приспосабливать свой фенотип
к определённым условиям внешней и
внутренней среды. А поскольку фенотипические
признаки клеток разных типов в различных
условиях зависят от количества и свойств
продуцируемых ими структурных,
каталитических и регуляторных белков,
то в основе большинства регуляторных
механизмов лежит регуляция одного или
нескольких этапов считывания информации
при синтезе этих белков. В настоящее
время известно достаточно большое
количество механизмов регуляции. Их
обычно рассматривают в зависимости от
того звена в экспрессии генов, которое
они регулируют – регуляция транскрипции
РНК (инициация, элонгация и терминация),
регулирование перехода РНК из ядра в
цитоплазму (у эукариот), регуляция
трансляции (инициация, элонгация и
терминация), фолдинга и т.д. Все эти этапы
у про- и эукариот контролируются
специфическими механизмами, однако
логика этих процессов в целом одинакова.
Не будем рассматривать все известные
в настоящее время механизмы регуляции
экспрессии генов. Их много. Остановимся
на регуляции одного этапа в экспрессии
генов – инициации транскрипции. Регуляция
активности генов на этом уровне широко
распространена среди организмов и
наиболее изучена.
3.1.Регуляция
экспрессии генов у прокариот на уровне
инициации
транскрипции
Этот тип регуляции
осуществляется несколькими способами.
Из них наиболее значимы два.
1. Регуляция
транскрипции путём изменения вторичной
структуры участка ДНК, на котором
фермент РНК-полимераза осуществляет
синтез РНК. Пространственную структуру
ДНК изменяют специальные ферменты. Эти
изменения могут быть самыми разнообразными,
например возможен такой вариант, когда
на кодирующей части ДНК формируются
изгибы или шпильки. Эти структуры
блокируют движение по ДНК ферментов,
обеспечивающих самый первый процесс
синтеза РНК – инициацию. В результате
не происходит деспирализации ДНК, не
разрываются водородные связи между
нитями ДНК, не отходят друг от друга
нити ДНК, т.е. не формируется вилка
транскрипции. Процесс транскрипции не
начинается.
2. Регуляция путём
взаимодействия специальных
белков-регуляторов с оператором.
Этот механизм был
предложен Ф. Жакобом и Ж. Моно в 1961 г.
Предложенная ими гипотеза регуляции в
настоящее время полностью подтверждена
и хорошо исследована. Этот тип регуляции
называется «Контроль синтеза белка на
уровне транскрипции» или просто «Теория
оперона».
44
Как мы уже писали
ранее, оперон прокариот состоит из
промотора, оператора и кодирующей части.
К промотору присоединяется РНК-полимераза,
которая «проходит» через оператор и
транскрибирует РНК с матричной цепи
ДНК. Промотор и оператор взаимно
перекрываются. К оператору присоединяются
два
типа белков-
регуляторов – активатор и репрессор.
Это генетические факторы регуляции.
Репрессор,
взаимодействуя
с оператором, перекрывает его и частично
промотор, создавая стерическое препятствие
для присоединения РНК-полимеразы к
промотору (рис. 28, Б). Такая регуляция
носит название негативный контроль.
Активатор взаимодействует с оператором
таким образом, что эта связь, не только
не нарушает движение РНК-полимеразы
через оператор (рис. 28, А), но и ускоряет
осаждение на промотор всё новых и новых
молекул РНК-полимераз. Это повышает
интенсивность транскрипции гена, что
приводит к существенному увеличению
синтеза РНК и синтеза белка. Этот тип
регуляции называется позитивным
контролем.
Важно отметить,
что без активатора связывание
РНК-полимеразы с промотором так же
происходит, но очень медленно.
Вышеописанный
механизм интегрирован и в более высокие
уровни регуляции экспрессии генов. Его
легко понять, если помнить, что на более
высоком уровне регуляции происходят
те же процессы, что и изложенные выше,
но к ним добавляется звено, которое
регулирует действие активаторов и
репрессоров. Эндогенные или экзогенные
факторы (ими могут быть физические
факторы или химические соединения)
могут активировать или инактивировать
активатор или репрессор. Если происходит
активация активатора и инактивация
репрессора, то интенсивность транскрипции
повысится, и наоборот, при активации
репрессора и инактивации активатора
интенсивность транскрипции снизится.
3.2. Регуляция
экспрессии генов у эукариот
Существует несколько
механизмов регуляции экспрессии генов
у эукариот. Они контролируют практически
все этапы экспрессии генов. Как и в
предыдущем разделе (см. раздел 11.1.)
рассмотрим механизмы регуляции только
на уровне транскрипции.
Механизмы
регуляции транскрипции
К наиболее изученным
механизмам регуляции относятся следующие.
1. Регуляция
транскрипции через формирование
инициирующего комплекса (ТИК). Этот
комплекс формируется следующим образом:
факторы транскрипции взаимодействуют
с сигнальными последовательностями
ДНК промотора, создавая прочный
белково-нуклеотидный комплекс. К нему
присоединяется РНК-полимераза,состоящая
примерно из 10 полипептидов. Этот
многоэтапный процесс образования ТИК
контролируется белками-регуляторами,
которые, взаимодействуя с различными
составляющими комплекса, могут ускорить
образование ТИК или, наоборот, затормозить
его формирование.
45
2. Дистантное
влияние на формирование ТИК.
У эукариот, как
известно, имеется промотор, часто лежащий
рядом с геном, но отсутствует оператор.
Вместо него имеются регуляторные
области, находящиеся в ДНК или рядом с
промотором или на расстоянии (иногда
значительном) от него. Эти регуляторные
последовательности состоят из
относитель-
Активация
транскрипции
А
ДНК
Активатор
Репрессор
Торможение
транскрипции
ДНК
Б
— РНК-полимераза,
— активатор, — репрессор
Промотор
Оператор Ген
Рис.28. Влияние
белков регуляторов (активатора и
репрессора) на связывание РНК-полимеразы
с промотором и модификация транскрипции.
А – активатор
связался с оператором и активировал
связывание РНК-полимеразы с промотором.
Синтез РНК увеличился. Б – репрессор
связался с оператором и частично с
промотором, препятствуя соединению
РНК-полимеразы с промотором. Транскрипция
не происходит
но коротких
последовательностей ДНК, с которыми
связываются белки-регуляторы. Эти
белки-регуляторы и влияют на формирование
ТИК, которое происходит в области
промотора. Пока не выяснено каким образом
этот белок-регулятор может влиять на
формирование ТИК, находящийся на
достаточном удалении от белка-регулятора.
Предполагают, что это связано с тем, что
молекула ДНК в ядре делает петлю, в
результате чего два участка (участок с
белком-регулятором и участок, где
формируется ТИК) сближаются. Это позволяет
белку-регулятору влиять на образование
ТИК (см. рис. 29). Считают, что именно таким
образом действуют белки-регуляторы,
связанные с энхансерами и сайлен-
46
серами – участками
ДНК размером 10 – 20 пар нуклеотидов.
Энхансеры увеличивают скорость
транскрипции, сайленсеры –
замедляют.
3. Плейотропность
в регуляции генов эукариот. Среди
белков-регуляторов у эукариот существует
своеобразная иерархия. Один главный
белок-регулятор контролирует транскрипцию
нескольких генов-регуляторов. Последние,
в свою очередь, контролируют активность
структурных генов.
Энхансер
Сайленсер Белок-регулятор
сайленсера
Белок-регулятор,
прикреплённый
к
энхансеру
П
ДНК
Факторы
транскрипции
РНК-полимераза
Белок, связанный
с ДНК- промотором
Промотор
Рис.29. Петля ДНК.
Белки-регуляторы, осаждённые на энхансере
и сайленсере, взаимодействуют с факторами
инициации промотора
Механизмы
регуляции процессинга РНК у эукариот
Один из способов
регуляции экспрессии генов при созревании
мРНК – альтернативный сплайсинг. О нём
мы писали в разделе 7.5. Другой механизм
– редактирование ДНК, когда первичная
структура мРНК после транскрипции в
одних случаях сохраняется, а в других
изменяется в результате мутации. В
последнем случае про-иРНК может нести
другую функцию или вовсе её утратить.
Приведём пример.
Последовательности – УАА, УАГ и УГА
являются терминирующими кодонами. Они
располагаются в сайте терминации и
служат сигналом остановки РНК-полимеразы
и прекращения синтеза любой РНК. В
результате мутаций внутри гена может
происходить замена одного нуклеотида
на другой. Например, при дезаминировании
цитозин может превратиться в урацил.
В этом случае кодоны ЦАА, ЦАГ и ЦГА,
кодирующие аминокислоты (валин и аланин),
превратятся в бессмысленные кодоны
УАА, УАГ и УГА. Этот феномен превращения
смысловых кодонов в бессмысленные в
результате мутаций используется в живых
организмах в качестве регулирующего
механизма.
47
Так, у человека
имеется ген, кодирующий образование
липопротеинов, ответственных за обмен
жиров (в частности, транспортировку их
из кишечника в лимфу, а затем в кровь).
Этот ген имеется во всех клетках организма
человека, но функционирует он только в
дух органах – в печени и кишечнике. И в
печени и в кишечнике ген имеет одно и
тоже строение и один и тот же нуклеотидный
состав. В печени экспрессия гена
реализуется в полипептид апопротеин
В-100 (апо-В-100 или В-100), а в кишечнике
синтезируется апопротеин, содержащий
всего 48% аминокислот по сравнению с
В-100. Поэтому такой протеин назвали
апопротеин В-48 или просто В-48. Оказалось,
что в клетках кишечника, в середине
гена, кодирующего апопротеин, находился
(как и в клетках печени) триплет ЦАА, но
в результате дезаминирования цитозин
триплета превратился в урацил и триплет
приобрёл статус бессмысленного кодона
УАА. Понятно, что, подойдя к нему,
РНК-полимераза заканчивает транскрипцию
мРНК, в результате чего при трансляции
формируется не 100% белок В-100, а В-48. Однако
и белок В-100 и белок В-48 исправно несут
свои функции, хотя и отличающиеся друг
от друга.
Механизм регуляции
перехода мРНК из ядра в цитоплазму.
Для участия в
трансляции мРНК должна выйти из ядра
(места своего синтеза) через ядерные
поры в цитоплазму. Специальные ферменты
нуклеазы расщепляют мРНК при таком
переходе. Деградация приостанавливается,
если мРНК связана с белком. Понятно, что
в этом случае количественный выход мРНК
из ядра в цитоплазму зависит от двух
факторов: от количества ферментов,
расщепляющих иРНК, и количества белка,
способного связаться с мРНК. Синтез
нуклеаз и белка регулируется. Например,
если клетке необходимо синтезировать
большое количество гистонов (это бывает
в синтетическом периоде, когда идёт
интенсивный синтез ДНК и строительство
нуклеосом из гистонов), то усиливается
выработка белков, взаимодействующих с
гистоновой мРНК. Выход её в цитоплазму
увеличивается.
Существуют и
другие механизмы регуляции, о которых
мы только упомянем – регуляция
стабильности мРНК, регуляция скорости
трансляции, регуляция продолжительности
жизни молекул белка и др.
В заключении
необходимо отметить, что в изучении
регуляции экспрессии сейчас всё большее
значение придают химическим изменениям,
происходящим в определённых участках
генома. Наиболее известное из них –
метилирование, т.е. присоединение к
цитозину метильной группы (-СН3).
Такая модификация часто происходит в
ДНК рядом с геном и существенно сказывается
на его работе. Важным является то, что
метилирование не изменяет нуклеотидную
последовательность ДНК, т.е. это не
мутационная изменчивость. Не затрагивает
метилирование и информацию в гене. Это
не мутационная эпигенетическая
изменчивость. Сейчас изучение этой
изменчивости стало одним из важнейших
направлений в генетике – эпигеномикой
(от греческого «эпи» – рядом, около).
ХРАНЕНИЕ И РЕАЛИЗАЦИЯ
НАСЛЕДСТВЕННОЙ ИНФОРМАЦИИ
Редактор-корректор
Дудичева
Г.П.
Подписано в
печать……………..
Печать на ризографе.
Бумага офсетная.
Формат 60Х841/16.
Усл. печ. л. 2,79.
Тираж ……….. экз.
Заказ №…………
420012, Казань,
Бутлерова, 49, типография КГМУ
Текст работы размещён без изображений и формул.
Полная версия работы доступна во вкладке «Файлы работы» в формате PDF
Актуальность: Данная тема является актуальной по причине того, что репарация является свойством живой клетки бороться с различными повреждениями ДНК, чтобы сохранить целостность ДНК. Данная тема затрагивает одну из важных задач современной медицины.
Цель: понять, как нарушается целостность генетического материала клетки и какие существуют восстановительные механизмы ДНК и как они работают.
Задачи:
1. Изучить, что такое репарация.
2. Разобрать, как происходит повреждение ДНК и по каким причинам
3. Выяснить, как работают репарационные механизмы ДНК
Содержание………………………………………………………………….стр.
1. Введение………………………………………………………………….…3
2. Нарушения в ДНК…………………………..…………………………….…4
3. «Световое восстановление»………………………………………….……..5
4. «Темновое восстановление»……………………………………………….6
5. Система репарации………………………………………………….……..7
6. Классификация репарации………………………………………………..8
7. Виды репарации……………………………………………………………9
8. Интересные факты о репарации………………………………….………11
9. Заключение………………………………………………………………..12
10. Список литературы………………………………………………………13
Введение
Репарация (от лат. reparatio — восстановление) — особая функция клеток, заключающаяся в способности исправлять химические повреждения и разрывы в молекулах ДНК, повреждённых при нормальном биосинтезе ДНК в клетке или в результате воздействия физических или химических реагентов. Осуществляется специальными ферментными системами клетки. Ряд наследственных болезней (напр., пигментная ксеродерма) связан с нарушениями систем репарации. В окружающем мире существует множество факторов, способных вызвать необратимые изменения в живом организме. Чтобы сохранить свою целостность, избежать патологических и несовместимых с жизнью мутаций, должна существовать система самостоятельного восстановления.
Нарушения в ДНК
Молекула дезоксирибонуклеиновой кислоты может быть разорвана как в ходе биосинтеза, так и под влиянием вредных веществ.
Источники повреждения ДНК:
— Ультрафиолетовое излучение
— Радиация
— Химические вещества
— Ошибки репликации ДНК
— Апуринизация — отщепление азотистых оснований от сахарофосфатного остова
— Дезаминирование — отщепление аминогруппы от азотистого основания
К негативным факторам, в частности, относят температуру или физические силы различного происхождения. Если разрушение произошло, клетка запускает процесс репарации. Так начинается восстановление исходной структуры молекулы ДНК. За репарацию отвечают особые ферментные комплексы, присутствующие внутри клеток. С невозможностью отдельных клеток осуществлять восстановление связаны некоторые заболевания.
«Световое восстановление»
Впоследствии исследования Кельнера получили свое логическое продолжение в работах американских биологов Сетлоу, Руперта и некоторых других. Благодаря труду этой группы ученых было достоверно установлено, что фотореактивация является процессом, который запускается благодаря особому веществу – ферменту, катализирующему расщепление димеров тимина. Именно они, как выяснилось, образовывались в ходе экспериментов под воздействием ультрафиолета. При этом яркий видимый свет запускал действие фермента, который способствовал расщеплению димеров и восстановлению первоначального состояния поврежденных тканей. В данном случае речь идет о световой разновидности восстановления ДНК. Определим это более четко. Можно сказать, что световая репарация – это восстановление под воздействием света первоначальной структуры ДНК после повреждений. Однако данный процесс не является единственным, способствующим устранению повреждений.
«Темновое восстановление»
Спустя некоторое время после открытия световой была обнаружена темновая репарация. Это явление происходит без какого-либо воздействия световых лучей видимого спектра. Данная способность к восстановлению обнаружилась во время исследования чувствительности некоторых бактерий к ультрафиолетовым лучам и ионизирующему излучению. Темновая репарация ДНК – это способность клеток убирать любые патогенные изменения дезоксирибонуклеиновой кислоты. Но следует сказать, что это уже не фотохимический процесс, в отличие от светового восстановления.
Механизм «темнового» устранения повреждений Наблюдения за бактериями показали, что спустя некоторое время после того, как одноклеточный организм получил порцию ультрафиолета, вследствие чего некоторые участки ДНК оказались поврежденными, клетка регулирует свои внутренние процессы определенным образом. В результате измененный кусочек ДНК просто отрезается от общей цепочки. Получившиеся же промежутки заново заполняются необходимым материалом из аминокислот. Иными словами, осуществляется ресинтез участков ДНК. Открытие учеными такого явления, как темновая репарация тканей, – это еще один шаг в изучении удивительных защитных способностей организма животного и человека.
Система репарации
Эксперименты, позволившие выявить механизмы восстановления и само существование этой способности, проводились с помощью одноклеточных организмов. Но процессы репарации присущи живым клеткам животных и человека. Некоторые люди страдают пигментной ксеродермой. Это заболевание вызвано отсутствием способности клеток ресинтезировать поврежденную ДНК. Ксеродерма передается по наследству. Из чего же состоит репарационная система? Четыре фермента, на которых держится процесс репарации – это ДНК-хеликаза, -экзонуклеаза, -полимераза и -лигаза. Первый из этих соединений способен распознавать повреждения в цепи молекулы дезоксирибонуклеиновой кислоты. Он не только распознает, но и обрезает цепь в нужном месте, чтобы удалить измененный отрезок молекулы. Само устранение осуществляется с помощью ДНК-экзонуклеазы. Далее происходит синтез нового участка молекулы дезоксирибонуклеиновой кислоты из аминокислот с целью полностью заменить поврежденный отрезок. Ну и финальный аккорд этой сложнейшей биологической процедуры совершается с помощью фермента ДНК-лигазы. Он отвечает за прикрепление синтезированного участка к поврежденной молекуле. После того как все четыре фермента сделали свою работу, молекула ДНК полностью обновлена и все повреждения остаются в прошлом. Вот так слаженно работают механизмы внутри живой клетки.
Классификация репарации
На данный момент ученые выделяют следующие разновидности систем репарации. Они активируются в зависимости от разных факторов. К ним относятся: реактивация, рекомбинационное восстановление, репарация гетеродуплексов, эксцизионная репарация, воссоединение негомологичных концов молекул ДНК. Все одноклеточные организмы обладают как минимум тремя ферментными системами. Каждая из них обладает способностью осуществлять процесс восстановления. К этим системам относят: прямую, эксцизионную и пострепликативную. Этими тремя видами восстановления ДНК обладают прокариоты. Что касается эукариот, то в их распоряжении находятся дополнительные механизмы, которые называются Miss-mathe и Sos-репарация. Биология подробно изучила все эти виды самовосстановления генетического материала клеток.
Виды репарации
1. Прямая репарация — наиболее простой путь устранения повреждений в ДНК, в котором обычно задействованы специфические ферменты, способные быстро (как правило, в одну стадию) устранять соответствующее повреждение, восстанавливая исходную структуру нуклеотидов. Так действует, например, O6-метилгуанин-ДНК-метилтрансфераза, которая снимает метильную группу с азотистого основания на один из собственных остатков цистеина.
2. Эксцизионная репарация (англ. excision — вырезание) включает удаление повреждённых азотистых оснований из ДНК и последующее восстановление нормальной структуры молекулы. Эксцизионная репарация (excision repair): процесс с участием ферментативной системы, которая удаляет короткую однонитевую последовательность двунитевой ДНК , содержащей ошибочно спаренные или поврежденные основания , и замещает их путем синтеза последовательности, комплементарной оставшейся нити. Эксцизионная репарация является наиболее распространенным способом репарации модифицированных оснований ДНК. Этот тип репарации базируется на распознавании модифицированного основания различными гликозилазами, расщепляющими N-гликозидную связь этого основания с сахарофосфатным остовом молекулы ДНК. При этом существуют гликозилазы, специфически распознающие присутствие в ДНК определенных модифицированных оснований (оксиметилурацила, гипоксантина, 5-метилурацила, 3-метиладенина, 7-метилгуанина и т.д.). Для многих гликозилаз к настоящему времени описан полиморфизм, связанный с заменой одного из нуклеотидов в кодирующей последовательности гена. Для ряда изоформ этих ферментов была установлена ассоциация с повышенным риском возникновения онкологических заболеваний.
3. Пострепликативная репарация Tип репарации, имеющей место в тех случаях, когда процесс эксцизионной репарации недостаточен для полного исправления повреждения: после репликации с образованием ДНК, содержащей поврежденные участки, образуются одноцепочечные бреши, заполняемые в процессе гомологичной рекомбинации при помощи белка. Пострепликативная репарация была открыта в клетках E.Coli, не способных выщеплять тиминовые димеры. Это единственный тип репарации, не имеющий этапа узнавания повреждения.
Интересные факты о репарации
1. Полагают, что от 80 % до 90 % всех раковых заболеваний связаны с отсутствием репарации ДНК[4].
2. Повреждение ДНК под воздействием факторов окружающей среды, а также нормальных метаболических процессов, происходящих в клетке, происходит с частотой от нескольких сотен до 1000 случаев в каждой клетке, каждый час.
3. По сути ошибки в репарации происходят так же часто как и в репликации, а при некоторых условиях даже чаще.
4. В половых клетках сложная репарация, связанная с гомологичной рекомбинацией не происходит из-за гаплоидности генома этих клеток.
Заключение
Репарация – это обязательное условие нормального функционирования организма. Подвергаясь ежедневно и ежечасно угрозам повреждений и мутаций ДНК, многоклеточная структура приспосабливается и выживает. Это происходит в том числе и за счет налаженной системы репарации. Отсутствие нормальной восстановительной способности вызывает болезни, мутации и другие отклонения. К ним относятся различные патологии развития, онкология и даже само старение. Наследственные болезни вследствие нарушений репарации могут приводить к тяжелым злокачественным опухолям и другим аномалиям организма. Сейчас определены некоторые заболевания, вызываемые именно сбоями систем репарации ДНК. Это такие, например, патологии, как синдром Кокейна, ксеродерма, неполипозный рак толстой кишки, трихотиодистрофия и некоторые раковые опухоли.
Список литературы
1. Кирпичев А.С., Севастьянова Г.А. Молекулярная биология М. AKADEMA. 2005г.
2. С.Коничев, Г.А.Севастьянова Молекулярная биология. — Москва: Академия, 2003г.
3. С.Г. Инге-Вечтомов. Генетика с основами селекции. — Москва: Высшая школа, 1989г.
4. Кирилл Стасевич Как клетка чинит свою ДНК. Наука и жизнь. — 2015г.
5. Б. Льюин. Гены 1987г.