Актуальные вопросы диагностики муковисцидоза
Статьи
ЖУРНАЛ «ПРАКТИКА ПЕДИАТРА»
Опубликовано в журнале:
«ПРАКТИКА ПЕДИАТРА»; март-аперль; 2015; стр. 20-27.
Е.И. Кондратьева, д. м. н., профессор, В.Д. Шерман, к. м. н., Н.И. Капранов, д. м. н., профессор, Н.Ю. Каширская, д. м. н., профессор, НКО муковисцидоза ФГБНУ «МГНЦ», ГБУЗ «ДГКБ № 13 им. Н.Ф. Филатова ДЗМ», г. Москва
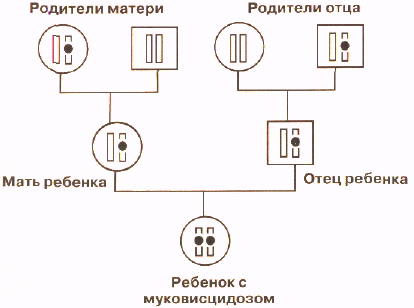
Муковисцидоз (МВ), или кистозный фиброз (cysticfibrosis), — одно из наиболее частых моногенных наследственных заболеваний с полиорганной патологией, резко сокращающее продолжительность и качество жизни пациентов без адекватного комплексного лечения в течение всей жизни. МВ распространен среди населения всей Земли, но наиболее часто поражает европеоидов: в среднем с частотой 1 на 2500-4500 новорожденных. Еще совсем недавно больные муковисцидозом умирали в раннем детском возрасте или даже на первом году жизни от пневмонии и истощения, обусловленными мальабсорбцией.
Ключевые слова: диагностика, генетика, мутации, неонатальный скрининг, потовая проба, эластаза кала.
Key words: cystic fibrosis, diagnosis, genetics, mutation, newborn screening, sweat test, fecal elastase.
Болезнь прежде всего характеризуется повышенной продукцией вязкого бронхиального секрета, частыми легочными инфекциями и обструкцией дыхательных путей. По мере прогрессирования легочной болезни образуются участки ателектазов, развивается эмфизема, постепенно разрушается паренхима легких с развитием бронхоэктазов и участков пневмосклероза, а больной имеет высокий риск погибнуть от легочно-сердечной недостаточности. В финальной стадии заболевания пересадка комплекса «сердце-легкие» остается для больного единственной надеждой. Помимо бронхолегочной системы у большинства больных муковисцидозом поражается поджелудочная железа, при этом это происходит внутриутробно. Недостаточность панкреатических ферментов обусловливает нарушение всасывания жиров и белков, развитие нутритивной недостаточности. В результате больные отстают в росте и страдают гипотрофией. Продукция инсулина также может быть нарушена, что ведет к развитию диабета. К частым осложнениям течения муковисцидоза относят остеопороз, а также жировой гепатоз с переходом в цирроз. При наличии «мягкой» мутации клинические проявления развиваются постепенно, преобладают моносимптомы, диагноз «муковисцидоз» устанавливается поздно или случайно.
Своевременная диагностика муковисцидоза, обеспечивающая в большинстве случаев раннее начало терапии, в том числе на доклиническом этапе, улучшает прогноз заболевания, повышает эффективность лечения, позволяет предупредить развитие тяжелых осложнений, значительного отставания в физическом развитии, а в ряде случаев и необратимых изменений в легких. Ранняя диагностика позволяет семье вовремя решить необходимые вопросы, связанные с рождением здорового ребенка (генетическое консультирование, пренатальная диагностика МВ в последующие беременности).
Диагностика делится на:
1) пренатальную диагностику;
2) диагностику по неонатальному скринингу (до клинических проявлений или при их дебюте);
3) диагностику при клинических проявлениях:
4) диагностику среди родственников больных.
В настоящее время налаживается дородовая диагностика муковисцидоза в перспективных и информативных семьях (Москва, Санкт-Петербург, Уфа, Томск, Красноярск, Ростов-на-Дону, Владивосток и некоторые другие города), что, безусловно, важно для профилактики этой тяжелой патологии. Пренатальная диагностика возможна в виде ДНК-диагностики при проведении амниоцентеза (получение околоплодных вод в ранний срок -13-14 недель и поздний — обычно 16-20 недель беременности) в семье носителей одной мутации гена CFTR и имеющей больного ребенка. Диагноз может быть заподозрен при УЗИ плода внутриутробно при наличии характерной УЗ-характеристики в виде гиперэхогенного кишечника. УЗИ во время беременности рекомендуют в скрининговые сроки: 11-14, 18-21 и 30-34 недели беременности. Обязательно проводят повторное исследование. В 50-78% случаев это состояние будет связано с МВ и проявится мекониальным илеусом. Диагноз в этом случае может быть установлен еще до рождения ребенка. В то же время этот признак не является высокоспецифичным для МВ, может быть транзиторным явлением, а также связанным с другими патологическими состояниями. При этом ДНК-диагностика родителей дает необходимую информацию о наличии мутаций у каждого из родителей и позволяет предполагать заболевание у ребенка при рождении.
Клинические признаки
1. Диагностика классической формы МВ обычно не представляет сложностей. Классический фенотип больного является результатом наличия двух мутантных копий гена муковисцидозного трансмембранного регулятора (CFTR) и характеризуется хронической бактериальной инфекцией дыхательных путей и придаточных пазух носа, стеатореей из-за внешнесекреторной недостаточности поджелудочной железы, мужским бесплодием из-за обструктивной азооспермии, а также повышенной концентрацией хлоридов потовой жидкости.
2. Проблемы диагностики МВ, как правило, связаны с фенотипическим разнообразием его форм, обусловленным генетическим полимор-
В ряде случаев атипичного течения МВ возможна его диагностика во взрослом возрасте. Как правило, в этой группе больных отмечается более мягкое течение болезни в связи с сохранностью функции поджелудочной железы и нетяжелым поражением органов дыхания.
В абсолютном большинстве случаев МВ может быть диагностирован в раннем детском возрасте (в 90% случаев — на первом году жизни). К сожалению, нередки случаи диагностики МВ у взрослых с классическим фенотипом.
Диагностика МВ у носителей «мягких» генотипов (актуально для детей, рожденных до 2006-2007 гг., и взрослых):
В настоящее время выделяют несколько групп риска по МВ.
Основной группой риска по заболеванию в РФ в настоящее время являются новорожденные с неонатальной гипертрипсиногенемией. Учитывая возможность получения ложноотрицательных результатов неонатального скрининга, а также то обстоятельство, что в РФ неонатальный скрининг на МВ проводится с 2006-2007 гг., не теряет своей актуальности анализ групп риска, включающих пациентов с патологией желудочно-кишечного тракта, бронхолегочными нарушениями, патологией других органов и родственников больных МВ (табл. 1).
Таблица 1.
Группы риска для дифференциальной диагностики муковисцидоза
| I. Бронхолегочные нарушения |
| 1. Повторные и рецидивирующие пневмонии с затяжным течением, особенно двусторонние 2. Бронхиальная астма, рефрактерная к традиционной терапии 3. Рецидивирующие бронхиты, бронхиолиты, особенно с высевом Ps. aeruginosa 4. Двусторонние бронхоэктазы |
| II. Изменения со стороны желудочно-кишечного тракта |
| 1. Синдром нарушенного кишечного всасывания неясного генеза 2. Мекониальный илеус и его эквиваленты 3. Гиперэхогенность кишечника плода 4. Желтуха обструктивного типа у новорожденных с затяжным течением 5. Цирроз печени 6. Сахарный диабет 7. Гастроэзофагеальный рефлюкс 8. Выпадение прямой кишки |
| III. Патология со стороны других органов |
| 1. Нарушение роста и развития 2. Задержка полового развития 3. Мужское бесплодие 4. Хронический синусит 5. Полипы носа 6. Электролитные нарушения |
| IV. Члены семей больных муковисцидозом |
Среди клинических проявлений, характерных для МВ, можно выделить высоко-и менее специфичные (табл. 2). Состояния, представленные в левой колонке таблицы, в абсолютном большинстве случаев встречаются у больных МВ. Причиной состояний из правой колонки могут быть другие заболевания, например первичная цилиарная дискинезия, гуморальный иммунодефицит и т. д.
Таблица 2.
Клинические проявления, характерные для МВ
| Высокоспецифичные для МВ | Менее специфичные для МВ |
| Желудочно-кишечные:
|
Желудочно-кишечные:
|
| Со стороны дыхательных путей:
|
Со стороны дыхательных путей:
|
| Другое:
|
Другое:
|
В таблице 3 представлены особенности проявлений МВ в разные возрастные периоды. Знание этих особенностей помогает специалистам, наблюдающим пациента с теми или иными симптомами, включить МВ в перечень заболеваний для дифференциальной диагностики. Особенно это касается детей раннего возраста, когда клиническая картина еще может быть неполной, но на себя будут обращать внимание некоторые проявления, например мекониальный илеус при рождении или синдром потери солей, не имеющий связи с патологией почек. Диагноз в этом случае может быть установлен еще до рождения ребенка. В то же время этот признак не является высоко специфичным для МВ, может быть транзиторным явлением, а также связанным с другими патологическими состояниями.
Таблица 3.
Клинические особенности проявлений МВ в различные возрастные периоды
| 0-2 года | |
|
|
|
| 3-16 лет | |
|
|
|
Диагностические критерии МВ
Для решения проблем диагностики МВ, в том числе и его атипичных форм, были разработаны критерии, согласно которым обязательным для МВ является наличие характерного клинического синдрома плюс доказательство какого-либо нарушения функции хлорного канала.
Учитывая все научные достижения в понимании природы муковисцидоза и МВ-зависимых заболеваний за последние 10 лет, в 2013 году группа экспертов Европейского общества муковисцидоза (European Cystic Fibrosis Society) под руководством Carlo Castellani подготовила новые стандарты диагностики в редакции Alan R. Smyth и Scott Bell (схема).
Схема.
Диагностические критерии муковисцидоза ECFS 2013
| Положительная потовая проба и/или две мутации МВТР, вызывающие МВ (согласно базе CFTR-2) |
И | Неонатальная гипертрипсиногенемия или характерные клинические проявления, такие как диффузные бронхоэктазы, высев из мокроты значимой для МВ патогенной микрофлоры (особенно синегнойной палочки), экзокринная панкреатическая недостаточность, синдром потери солей, обструктивная азооспермия |
Неонатальный скрининг
Проводится на основании Методических рекомендаций по проведению неонатального скрининга в РФ с использованием Европейских рекомендаций по неонатальному скринингу. 90% новорожденных без клинических проявлений муковисцидоза диагноз может быть установлен на основании скрининга в возрасте до 6 недель. В 5-10% случаев возникают трудности с диагностикой муковисцидоза (Cystic Fibrosis Foundation Patient Registry, 2005 Annual Data Report to the Center Directors. Bethesda, MD: CFF).
Проблемы неонатального скрининга:
Потовая проба
Показания:
1. При положительном результате неонатального скрининга (двукратном повышении уровня иммунореактивного трипсиногена в крови в течение первого месяца жизни ребенка).
2. При наличии у пациента каких-либо характерных клинических проявлений МВ.
3. Случаи МВ в семье.
Потовая проба является надежным методом диагностики МВ у 98% больных. Исследование можно проводить всем детям через 48 часов после рождения, хотя у новорожденных могут быть проблемы с набором пота. Несмотря на то, что «золотым стандартом» диагностики МВ считается количественное определение хлоридов в потовой жидкости (классический метод Гибсона — Кука), метод определения проводимости на аппаратах «Макродакт» и «Нанодакт» («Вескор», США) показал хорошую с ним корреляцию в многочисленных исследованиях.
Оценка результата
При положительном результате потовой пробы (хлориды > 60 ммоль/л при классическом методе Гибсона — Кука и/или проводимость > 80 ммоль/л NaCl) диагноз подтверждается.
Генетическое исследование
Генетическое исследование проводится после потовой пробы. Однако в связи с ограниченными возможностями ДНК-диагностики в России данный метод не является обязательным, однако применяется с исследовательской целью и для окончательного подтверждения диагноза.
На первом этапе ДНК-обследования наиболее часто используется панель, включающая 28 мутаций, как наиболее частых в мире, так и специфичных для России: F508del, CFTRdele2,3(21kb), 3849+10kbC>T, W1282X, 2143delT, 2184insA, 1677delTA, N1303K, G542X, R334W, E92K, L138ins, 394delTT, 3821delT, S1196X, 2789+5G>A, G85E, 2183AA>G, 604insA, 621+1G>T, R117H, R347P, R553X, 3667insTCAA, G551D, I507del, 1717-1G>A, 2184delA. По данным лаборатории генетической эпидемиологии ФГБУ «Медико-генетический научный центр» (МГНЦ) РАМН, при использовании данной панели удается обнаружить лишь около 82,5% мутантных аллелей у больных МВ. В случае когда при положительной потовой пробе не будет найдено ни одной мутации гена (что само по себе маловероятно), может потребоваться секвенирование гена МВ, позволяющее идентифицировать примерно 98% мутаций в гене CFTR.
Рекомендации:
1. На основании данных национального регистра больных МВ по ДНК-диагностике гена CFTR установлены особенности характера и частоты мутаций в регионах страны. На основе данных регистра рекомендуется создание региональных рекомендаций по определению мутаций со ссылкой на регистр (последнюю версию).
2. Отсутствие мутациий без проведения секвенирования — недостаточно для исключения МВ.
3. Некоторые мутации МВТР (3849+10 kb C>T) ассоциированы с нормальным или пограничным результатом потового теста.
4. «Мягкие» мутации характеризуются поздним дебютом заболевания, пограничным значением потовых проб, выявляются чаще при секвенировании.
5. Пациенты с пограничными результатами потовых проб (хлориды 30-60 ммоль/л и/или проводимость 50-80 ммоль/л), единственной мутацией гена представляют реальные трудности для диагностики.
Для диагностики МВ или его исключения при пограничных результатах пробы необходимо:
В европейских странах для подтверждения дефекта ионного транспорта применяется метод определения разности назальных потенциалов или измерение электрического тока в биоптате кишки, отражающие нарушение функции хлорного канала. Оба метода основаны на электрическом характере транспорта ионов и являются высокоинформативными для диагностики МВ.
Диагностика панкреатической недостаточности включает:
У больных МВ показатель эластазы может снижаться в течение первых лет жизни, поэтому определяется в динамике. Низкий уровень панкреатической эластазы расценивается как один из признаков МВ. Приблизительно 1% пациентов с МВ имеет пограничный результат потового теста в комплексе с сохранной функцией поджелудочной железы и хроническим бронхитом.
Диагностика хронического бронхолегочного процесса:
В качестве дополнительных диагностических маркеров могут быть использованы азооспермия в постпубертатном возрасте, идентификация МВ-ассоциированных патогенов из респираторного тракта, рентгенологические признаки синусита.
Знание основных симптомов МВ и особенностей его течения в разные возрастные периоды позволяет своевременно заподозрить наличие заболевания и направить пациента для дальнейшего обследования. Нередкие случаи поздней диагностики МВ связаны как с отсутствием у врачей достаточных знаний о заболевании, так и с фенотипическим разнообразием его форм. Ограниченные возможности ДНК-диагностики МВ в России и ее низкая доступность затрудняют и затягивают окончательную верификацию заболевания.
ЛИТЕРАТУРА
1. Муковисцидоз. Под ред. Н.И. Капранова, Н.Ю. Каширской. М.: ИД «МЕДПРАКТИКА-М», 2014, 672 с. ISBN 978-5-98803-314-1
2. Welsh M.J., Ramsey B.W., Accurso F.J., Cutting G.R. Cystic fibrosis. In: Scriver C.R., Beaudet A.L., Sly W.S., Valle D., eds. The metabolic and molecular bases of inherited disease. 8th ed. New York: McGraw-Hill, 2001: 5121-88.
3. European cystic fibrosis society standards of care working group. Best practice guidelines. В редакции Alan R. Smith и Scott Bell, 2014.
4. Farell P.M., Rosenstein B.J., White T.B. et al. Cystic fibrosis foundation. Guidelines for diagnosis of cystic fibrosis in newborns through older adults: Cystic Fibrosis Foundation consensus report // J. Pediatr., 2008; 153 (2): S4-S14.
5. Красовский С.А., Каширская Н.Ю., Усачева М.В., Амелина Е.Л., Черняк А.В., Науменко Ж.К. Влияние возраста постановки диагноза и начала специфической терапии на основные клинико-лабораторные проявления заболевания у больных муковисцидозом // Вопросы современной педиатрии, 2014, т. 13, № 2, с. 36-43.
6. de Boeck K., Wilschanski M., Castellani C. et al. Cystic fibrosis: terminology and diagnostic algorithms. Thorax, 2006; 61: 627-635.
7. de Oronzo M.A. Hyperechogenic fetal bowel: an ultrasonographic marker for adverse fetal and neonatal outcome? // J. Prenat. Med., 2011 Jan-Mar; 5 (1): 9-13.
8. Bombieri C. et al. Recommendations for the classification of diseases as CFTR-related disorders // Journal of Cystic Fibrosis, 2011, vol. 10, suppl. 2; S86-S102.
9. Hall E., Lapworth R. Use of sweat conductivity measurements. Annals of Clinical Biochemistry, 2010; 47: 390-392.
10. Sands D., Oltarzewski M., Nowakowska A., Zybert K. Bilateral sweat tests with two different methods as a part of cystic fibrosis newborn screening (CF NBS) protocol and additional quality control. Folia Histochem Cystobiol., 2010 Sep 30; 48 (3): 358-65.
11. Sezer R.G., Aydemir G., Akcan A.B. et al. Nanoduct sweat conductivity measurements in 2664 patients: relationship to age, arterial blood gas, serum electrolyte profiles and clinical diagnosis // J. Clin. Med. Res., 2013 Feb; 5 (1): 34-41.
12. Петрова Н.В. Молекулярно-генетические и клинико-генотипические особенности муковисцидоза в российских популяциях. Автореф. дисс. докт. биол. наук. М., 2009, 42 с.
13. Derichs N., Sanz J., Von Kanel T. et al. Intestinal current measurement for diagnostic classification of patients with questionable cystic fibrosis: validation and reference data. Thorax, 2010 Jul; 65 (7): 594-9.
14. Servidoni M.F., Sousa M., Vinagre A.M. et al. Rectal forceps biopsy procedure in cystic fibrosis: technical aspects and patients perspective for clinical trials feasibility. BMC Gastroenterol., 2013 May 20; 13 (1): 91.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
- Research
- Open Access
- Published: 09 April 2021
Italian Journal of Pediatrics
volume 47, Article number: 87 (2021)
Cite this article
-
2016 Accesses
-
1 Citations
-
1 Altmetric
-
Metrics details
Abstract
Background
Cystic Fibrosis newborn screening (CFNBS) is the optimal method to diagnose the disease during the asymptomatic period. The aim of the study was to determine how CFNBS affects long term clinical outcomes.
Methods
Data from infants who were born in Lodz Voivodship, referred to CF center as a part of CFNBS according to IRT/DNA protocol were compared to the data of children with established CF diagnosis before the start of NBS in Poland (Group CF, n = 52).
Results
In 37 children (during 151 referred infants) the diagnosis of CF was established due to CF NBS (CF NBS Group, n = 37). The average time of diagnosis was 1.59 month in Group CF NBS and 45.25 months in 52 children from Group CF.
Pulmonary exacerbations occurred on average 4.2 times in Group CFNBS and they were hospitalized on average 0.5 times compared to Group CF – respectively 6.77 and 2.14 (p < 0.001).
The number of PA infected patients increased between the fifth and eighth year of age (OR = 1.16 (95% CI: 1.04–19) (P = 0.007)) regardless of the study group (P = 0.984). Patients with MRSA infection have a higher risk of PA infections in subsequent years of their life (OR = 1.45 (95% CI: 1.03–2.03) (P = 0.032)).
Conclusions
CF NBS has beneficial effects primarily on decrease of pulmonary withhope for a longer life expectancy and better and centralised treatment in multidisciplinary CF focused centres.
Introduction
Cystic fibrosis (CF) is the most common fatal autosomal recessive disease in Caucasians [1]. It is widely recognized that CF is a variable condition, that may affect the respiratory tract, pancreas, intestine, male genital tract, hepatobiliary system and exocrine sweat glands, resulting in complex multisystem disease. The severity of clinical symptoms results due to pathogenic mutations in both alleles of the CF transmembrane conductance regulator (CFTR) gene. More than 1950 mutations have been described so far in the CFTR gene, grouped in 5 classes based on the impact on protein synthesis or activity [2, 3].
Over the last 50 years, European countries have introduced newborn bloodspot screening (NBS) for a range of inherited diseases as an important public health program. In 2004, the European CF Society established the Neonatal Screening Working Group (NSWG) to support the implementation of CF NBS program across Europe [4, 5]. CF NBS is the optimal method to diagnose the disease during the asymptomatic period. The primary goal of newborn screening is to decrease morbidity, mortality and associated disabilities. The early diagnosis is associated with improved physical development and slower lung deterioration due to the lower frequency of infections.
All CF NBS programs begin with detection of an elevated immunoreactive trypsinogen (IRT) level in a dried blood specimen from the newborn [3, 5, 6]. A positive IRTscreen is triaged to second-tier testing, which is DNA mutation testing in many national screening programs, including Poland (IRT/DNA protocol) [3,4,5,6,7]. Despite the advent of NBS and improved knowledge about CFTR genetics, CF diagnosis remains incomplete for many reasons, such as inconclusive sweat chloride values, CFTR mutations of uncertain pathogenicity, and differential expression of CFTR or modifier effects [8]. Also CF NBS introduced a new complexity and diagnostic dilemma, namely infants with abnormal screening tests, because of elevated immunoreactive IRT levels but inconclusive sweat tests and/or DNA results. The term for infants with an inconclusive diagnosis have been proposed: CF screen positive, inconclusive diagnosis (CFSPID) in Europe [9].
The first pilot NBS CF study was performed in Poland from 1999 to 2002 and included about 25% of the Polish population. The current program was implemented in 2006 and was expanded to the whole country in the summer of 2009. In Lodz Voivodeship, CF NBS was introduced on 1st June 2009 [3, 6, 7].
The research presents 10 years of experience of our CF center with the national newborn CF screening program in Lodz Voivodship and including the analyzis of diagnostic dilemma occurred during the program. The aim of the study was to determine how early diagnosis of CF, using neonatal screening with IRT/DNA protocol, affects long term clinical outcomes in comparison to CF patients with disease diagnosed before CF NBS?
Material and methods
Patients
Patients participated in the screening program
The study population comprised of infants who were born between 01.07.2009 and 31.12.2019 in Lodz Voivodship and were referred to our CF center as a part of NBS for CF and performed CFTR gene analysis according to IRT/DNA protocol described below. The infants had been evaluated at least once per 3 months. They were divided to three groups according to laboratory tests and further clinical evaluation as CF NBS Group, CF SPID and false positive NBS. Cystic fibrosis (CF NBS Group) was diagnosed in infants based on the level of sweat chloride in addition to evidence of CFTR dysfunction. The designation CF SPID was established to asymptomatic infants if they presented a positive CF NBS test plus: sweat chloride < 59 mmol/L and 2 CFTR mutations with 0–1 CF-causing CFTR mutations. The asymptomatic CF NBS positive infant with presence of no CFTR mutation or mutation in one allele plus a negative sweat test, referred as false positive NBS (including carriers).
Patients diagnosed with CF before introduction of screening program
We also analyzed data of 52 patients (24 females and 28 males) with established CF diagnosis born between 1996 and 2009 (before the newborn screening in Poland) attending our Cystic Fibrosis Outpatient Center in Copernicus Hospital in Lodz, Poland. Patients in this group had been referred to the Center due to occurrence of symptoms suggesting CF (CF Group).
Next, we compared both groups CF NBS and CF. We have chosen the interval — between 5 and 8 years of age to compare both groups, because at that time the most data were available.
Data assessment
In both groups the data were obtained retrospectively after a review of patient charts. The socio-economic data were analysed. These included a place of living defined as a large city above 100,000 inhabitants, a small city 10,000–100,000 inhabitants, and a village below 10,000 inhabitants. The perinatal period contained data: delivery data and weight, Apgar score and presence of meconium ileus (MI), time of CF diagnosis. We also analysed body weight and percentile of body weight at 5 and 8 years of age.
Clinical evaluation
Respiratory status was assessed by the forced expiratory volume in 1 s (FEV1) in spirometry, expressed as percentages of predicted values for height, weight, age, and gender. All analyzed measurements were done in fifth and 8 year of life, only in stable periods (using a Jaeger MasterScreen Body spirometer; E Jaeger GmbH; Wurzburg, Germany). The tests were performed according to American Thoracic Society standards [10].
The number of bronchopulmonary exacerbations and number of hospitalizations (due to pulmonary disease, longer than 3 days) between five and 8 years of life were evaluated. Pulmonary exacerbation was defined as excessive sputum expectoration, general malaise, and need for antibiotics. Chronic bacteria colonization Pseudomonas aeruginosa (PA) or methicillin-resistant Staphylococcus aureus (MRSA) were also collected, and defined as three positive consecutive sputum cultures over a period of 6 months in fifth and 8 year of life.
CF NBS protocol
IRT was measured in dried blood samples from 3 to 5 days old neonates. The IRT concentration cut-off was established as > 99.4 percentile (according to the pilot CF NBS program [6]). The elevated IRT caused further genetic testing from the same dried blood samples. In neonates with meconium ileus (MI), the DNA analysis was performed regardless of IRT level. The measurements of IRT (by using IRT Neonatal Screening ELISA colorimetric assay — IBL International) and DNA analysis from sampling paper (processing with the Extract Blood PCR Kit) were performed in the Genetic Department, Institute of Mother and Child, Warsaw, Poland. Since September 2011, the extended DNA analysis panel has been used and comprised 95% of mutated alleles in the Polish population.
Neonates with one or two mutations in CFTR detected due to NBS examinations were directed to CF Centres for clinical assessment and sweat tests (measured by the quantitative pilocarpine iontophoresis method and Nanoduct method parallel) [6]. CF NBS was conducted as a pilot programme in four Polish districts in the period 1999–2003. In 2006 CF NBS started again in the same regions and was gradually extended across the country. In June 2009 covered all of newborn population in Poland. In the 1980s, the prevalence of CF for Caucasians was estimated at 1: 2500 live births. The disease incidence was more accurately calculated to 1: 4000–5000 thanks to the extensive implementation of CF NBS in the world. In Poland due to data from CF NBS in the years 2006–2010 it is believed that one child every 4394 live births is born with CF.
The study was approved by the Ethical Committee of the Medical University of Lodz, Poland (nr RNN/145/20/KE).
Statistical analysis
Numerical traits were described by way of the arithmetic mean, standard deviation (SD), standard error (SE), when applicable, and their minimum-to-maximum values. Categorical variables were depicted by using counts (n) and percentages (%).
Multiple logistic (for binary dependent variables), multiple linear (for numerical traits), and multiple Poisson (for count data) regression models were fitted in order to test statistical co-dependencies. When dealing with non-normally distributed variables, robust standard errors (i.e. sandwich estimators) were used in the regression equations. All the regression models were controlled for the studied patients’ characteristics such as sex, gender, place of residence, birth weight, APGAR and also for crucial infections (PA, MRSA) before their 5th year of age. Missing data were case-wise deleted.
A level of P < 0.05 was deemed statistically significant. All the computations were performed by using of Stata/Special Edition, release 14.2 (StataCorp LP, College Station, Texas, USA).
Results
Evaluation of patients participated in the screening program (CF NBS positive infants)
One hundred fifty one infants were referred to our CF center as a part of NBS for CF due to CF suspicion: 84 females and 67 males. The CFTR gene analysis for each positive IRT, and neonates with MI regardless of IRT levels, allowed to identify mutations in one allele in 145 patients and in both alleles in 44 patients (96.03% of screened CF patients). Among 44 cases, after biochemical, genetic and clinical evaluations, in 37 children the diagnosis of CF was established (24.5%) during the first verifying visit (CF NBS Group) — in 76% the diagnosis was establish up to 35 days after birth, in 9 patients the first verifying visit took place later in life due to hospitalization connected with their MI. The mean birth weight in CF NBS patients was 3226.34 g, In this group, 9 patients had MI (24.32%). In the remaining 7 (out of 44) cases (15.9%), despite detection of two CFTR mutations, a clinical evaluation did not confirm the CF diagnosis (CF SPID). These infants had the CFTR genotype as follows: 3 patients with [F508del]; [IVS8-5 T+(TG)11], [3849 + 10kbC > T];[R117H], [Y301C];[3271 + 18C > T], [V754M];[V562L], [F508del];[R117H]. The above mutations found at least in one allele causing unproven or uncertain clinical consequences. These patients remain under the observation of our clinic. The most common mutation was F508 del, detected in 104 patients in one or both alleles (68.88%).
Six patients (3.97%) who were directed to the Cystic Fibrosis Outpatient based on the IRT elevations, had DNA analysis for CF mutations negative and they sweat chloride test was correct (false positive NBS). After further observations and examinations, the CF was excluded. So far (until December 2019) we also have information about two cases of false-negative results in CF NBS in our region (false negative NBS).
Comparison of group CF NBS and group CF
At the time of data collection 27 of CF NBS patients were at least 8 years old, remain under the medical care in our CF Outpatient Center and were included into compared analysis. The Group CF NBS with positive result of newborn CF screening included: 59% females, mean birth weight 3168.52 g and mean Apgar 8.78. Mutation F508 del was detected in both alleles in 29.63% patients.
Fifty two patients belonging to the Group CF, were born between 1996 and 2009 (before the start of newborn screening in Poland) – 24 females and 28 males. They were included into compared analysis with Group CF NBS. Their mean birth weight was 3195.6 g, Apgar 8.54, F508 del mutation in both alleles was detected in 50% cases.
Group CF NBS and Group CF demographic and clinical characteristics are shown in Table 1.
Full size table
The average time of the CF diagnosis was 45.25 months from birth in Group CF.
and 1.59 months in Group CF NBS.
The most significant difference between this two Groups was the number of exacerbations and hospitalizations between 5 and 8 years of life (p < 0.001). Pulmonary exacerbation in analysed period occurred on average 4.2 times in children in Group CF NBS and they were hospitalized on average 0.5 times. While in Group CF children mean of pulmonary exacerbations was 6.77 and mean number of hospitalization was 2.14.
Even though the average body weight and its percentile value was higher in the Group CF NBS, this difference was not significant. What is more weight gain between 5 and 8 years old was greater in the Group CF. No statistically significant predictors affecting weight gain in both groups were defined.
In spirometry measurements patients in both groups presented stable values of FEV1 during at least 3 years of observation, and the difference was not significant.
The number of PA infected patients increased significantly between the fifth and eighth year of age of the examined children (OR = 1.16 (95% CI: 1.04–19) (P = 0.007)) regardless of the study group (P = 0.984). It seems that patients with MRSA infection in the fifth year of life have a higher risk of PA infections in subsequent years of their life (OR = 1.45 (95% CI: 1.03–2.03) (P = 0.032)). The number of patients with PA or MRSA infection in the fifth year of life and PA infection in the age of 8 was greater in the CF Group, but these differences were not statistically significant.
Descriptive characteristics of all CF patients by screening status are shown in Table 2.
Full size table
Discussion
According to the Neonatal Screening Working Group new-born screening for CF provides an immediate diagnosis, before the onset of clinical symptoms [11,12,13]. In the beginning CF NBS raised doubts about ethical aspects with regard to possible benefits and risks. After many years of experience CF NBS has been widely implemented and accepted. Ten years of CF NBS programme in Lodz Voivodship leads to diagnosis of CF in 37 neonates among 151 children directed after their birth with CF suspicion to our Outpatient Center. The incidence of CF in Poland based on neonatal screening is currently 1:4394–1:5000 [3, 6].
CF NBS has been based on the assumption that pre-symptomatic detection permits early access to specialised medical care, and thus results in less morbidity and longer life expectancy. In our region CF NBS screened patients were diagnosed and treated in multidisciplinary CF centre between first and second month of their life. For comparison the median age of the diagnosis of patients, who were born before the start of CF NBS in Poland due to typical CF symptoms – 45.25 months from their birth. According to the literature, the most benefits associated with early identification of CF including include better growth and lung function, less intensive therapeutic burden and reduced cost of care [11,12,13,14]. Our observations show that early diagnosis and the introduction of appropriate treatment for asymptomatic CF patients resulted in a lower frequency of the pulmonary exacerbation and lower number of hospitalizations. It is very beneficial observation due to reports which emphasise that the repeated mild-to-moderate pulmonary exacerbations, especially in the first years of life result in airway remodelling. While more severe hospitalised episodes could increase structural airway injury risk [13,14,15,16]. Data from Australia showed improved survival in future in patients with lower number of hospitalisations in the first 3 years of life [17]. The occurrence of respiratory exacerbations are associated with an accelerated decline in lung function and reduced quality of life and survival [15,16,17]. On the other hand mean values of FEV1 in the analysed patients, presented stable results during at least 3 years of observation; there was no difference between Groups. This may be due to the age — below 8 — too early to identify significant differences in FEV1 secondary to clinical outcome (such as pulmonary exacerbations, bacterial colonisations), which likely takes longer to cause impairment of lung function that is identifiable with spirometry [16].
Children with CF are highly susceptible to chronic respiratory tract colonization and subsequent recurrent infection. It is know that once chronic PA infection is established, the risk of mortality and morbidity increases [18, 19]. In our study the mean number of patients with PA or MRSA colonization in the 5 years old and PA chronic infection in the age of 8 was lower among children screened in NBS, but there were no significant differences between both groups. The number of PA infected persons increased significantly between the fifth and eighth year of age regardless of belonging to the study group. Although the increasing number of SA and PA colonized patients were observed with age in both CF NBS and CF group, the CF NBS children had fewer exacerbations and hospitalisations due to intensively treatment from the very first PA sputum detection. The important observation was that patients in both groups with SA infection in the fifth year of life have a higher risk of PA infections in subsequent years of their life. Persistent presence of MRSA in the respiratory tract is associated with increased rates of PA through mediation of PA biofilm formation [18, 19]. In practice, we suggest to employ intermittent, symptom-based treatment of SA especially MRSA to delay initial PA colonization. The colonization with PA remains the most ordinary airway pathogen contributing to shortened survival in CF patients. For over a two decades antibiotic effective for PA (for example tobramycin inhalation solution (TIS)) is recommended for the treatment and early introduction with TIS has resulted in improved lung function and reduced risk of airway exacerbations [20, 21]. In our study in CF group the diagnosis was established mean in 42.25 month of life, but even maximally in 180 months of life. In such situation at the time of CF recognition patients’ sputum were often positive for PA and we treated PA colonization not an initial infection. Patients from CF NBS group were treated intensively from the very first PA sputum detection. We believe this may have contributed to a reduction in the number of pulmonary exacerbations and associated hospitalizations. Moss et al. [21] proved that delay in initiation of TIS therapy is associated with reduced long-term improvement over baseline, suggesting an irreversible component to lung function decline. To be maximally effective, TIS treatment should begin early after first detection of PA. In agreement to this study, although the incidence of PA found in the airways became similar over the years in both study groups (CF and CF NBS) the number of exacerbations and hospitalizations in CF NBS group was significant lower.
CF NBS allows the affected infants to receive immediate treatments including not only physiotherapy and preventing of pulmonary manifestations of the disease, but also great emphasis is pleased on assessment of nutritional status, and pancreatic enzyme replacement therapy. The Wisconsin randomised trial on newborn screening for CF showed that screened neonates exhibit better nutritional status in the first years of life [22], but no output is available from this cohort on long-term survival. We observed trend that body weight were higher in the CF NBS Group and they presented systematic and stable weight gain but this results were not statistically significant.
According to data published by Bobadilla et al., the complete CFTR gene analysis by sequencing of selected regions should identify mutations in one or both alleles in nearly 95% of screened children [23] and IRT/DNA strategy to achieve sensitivity close to 100% (despite children with MI, whose IRT level is not elevated). Due to Fritz formula the predicted false-negative rate for the Polish population is 6–7 cases per year, which gives 1–2 omitted CF cases per 100,000 live births [24]. It shows that despite the high sensitivity and specificity of IRT/DNA protocol it is important to follow patients with CF suggestive symptoms even when CF NBS was negative. We had two cases of false-negative results in CF NBS in our region to this day. According to normal values of the IRT in new-borns with MI they are in risk group of a false-negative first step of CF NBS protocol. Each case of MI should be reported to the NBS center by appropriate note on sampling paper and neonates must to be verify in CF centers. In our study, the new-borns with MI represent 24% of CF diagnosis, while the literature data shows MI frequency about 10–20% [25].
The IRT/DNA strategy allows to detect not only CF disease but also carries of the CFTR gene mutations, as well as cases of unclear clinical consequences. This fact constitutes a definite psychological problem for patients and their parents and raised doubts about ethical aspects of the CF NBS. It may have negative influences on further procreation of such persons. We detected 101 patients with mutations only in one allele of CFTR gene (what was 66.89% of all neonates from CF NBS). They were defined as carriers and in all cases, a genetic consultations for their parents and siblings was recommended.
Some limitations of our current study include a single centre analysis, which limits its generalizability. What is more we made the comparison to historical data (a blinded controlled study with CF- newborns left untreated was unacceptable due to ethical reasons).
Over the years new therapies were approved, standards of care established therefore, the outcomes of same patients in subsequent years is expected to be improved, even without the advent of newborn screening. We have to choose the appropriate time interval to compere a historical cohort (CF Group) and CF NBS positive patients.
Conclusion
In conclusion, newborn screening contributes to early diagnosis of cystic fibrosis. The presented study showed that CF NBS has beneficial effects primarily on decrease of pulmonary exacerbations with hope for a longer life expectancy in these group.
Availability of data and materials
The datasets used and/or analysed during the current study are available from the corresponding author on reasonable request.
Abbreviations
- CF:
-
Cystic fibrosis
- CFNBS:
-
Cystic Fibrosis newborn screening
- CFTR:
-
CF transmembrane conductance regulator
- FEV1:
-
The forced expiratory volume in 1 s
- IRT:
-
Immunoreactive trypsinogen
- MI:
-
Meconium ileus
- NSWG:
-
Neonatal Screening Working Group
- PA:
-
Pseudomonas aeruginosa
- MRSA:
-
Methicillin-resistant Staphylococcus aureus
- TIS:
-
Tobramycin inhalation solution
References
-
Farrell PM. The prevalence of cystic fibrosis in the European Union. J Cyst Fibros. 2008;7(5):450–3. https://doi.org/10.1016/j.jcf.2008.03.007.
Article
PubMedGoogle Scholar
-
Paranjapye A, Ruffin M, Harris A, Corvol H. Genetic variation in CFTR and modifier loci may modulate cystic fibrosis disease severity. J Cyst Fibros. 2019;13(19):30963–4.
Google Scholar
-
Sobczyńska-Tomaszewska A, Ołtarzewski M, Czerska K, Wertheim-Tysarowska K, Sands D, Walkowiak J, et al. Newborn screening for cystic fibrosis: polish 4 years experience with CFTR sequencing strategy. European J Human Genet. 2013;21(4):391–6. https://doi.org/10.1038/ejhg.2012.180.
Article
CASGoogle Scholar
-
Barben J, Castellani C, Dankert-Roelse J, Gartner S, Kashirskaya N, Linnane B, et al. The expansion and performance of national newborn screening programmes for cystic fibrosis in Europe. J Cyst Fibros. 2017;16(2):207–13. https://doi.org/10.1016/j.jcf.2016.12.012.
Article
PubMedGoogle Scholar
-
Loeber JG, Burgard P, Cornel MC, Rigter T, Weinreich SS, Rupp K, et al. Newborn screening programmes in Europe; arguments and efforts regarding harmonization. Part 1. From blood spot to screening result. J Inherit Metab Dis. 2012;35(4):603–11. https://doi.org/10.1007/s10545-012-9483-0.
Article
PubMedGoogle Scholar
-
Sands D, Zybert K, Mierzejewska E, Ołtarzewski M. Diagnosing cystic fibrosis in newborn screening in Poland — 15 years of experience. Dev Period Med. 2015;19(1):16–24.
PubMed
Google Scholar
-
Zietkiewicz E, Rutkiewicz E, Pogorzelski A, Klimek B, Voelkel K, Witt M. CFTR mutations spectrum and the efficiency of molecular diagnostics in polish cystic fibrosis patients. PLoS One. 2014;26(2):8909.
Google Scholar
-
Levy H, Nugent M, Schneck K, Stachiw-Hietpas D, Laxova A, Lakser O, et al. Refining the continuum of CFTR-associated disorders in the era of newborn screening. Clin Genet. 2016;89(5):539–49. https://doi.org/10.1111/cge.12711.
Article
CAS
PubMed
PubMed CentralGoogle Scholar
-
Ren C, Borowitz D, Gonska T, Howenstine M, Levy H, Massie J, et al. Cystic fibrosis transmembrane conductance regulator-related metabolic syndrome and cystic fibrosis screen positive, inconclusive diagnosis. J Pediatr. 2017;181:45–51.
Article
Google Scholar
-
Miller MR, Hankinson J, Brusasco V, Burgos F, Casaburi A, Coates A, et al. Standardisation of spirometry. Eur Respir J. 2005;26(2):319–38. https://doi.org/10.1183/09031936.05.00034805.
Article
CASGoogle Scholar
-
Castellani C, Massie J, Sontag M, Southern KW. Newborn screening for cystic fibrosis. Lancet Respir Med. 2016;4(8):653–61. https://doi.org/10.1016/S2213-2600(16)00053-9.
Article
PubMedGoogle Scholar
-
Tridello G, Castellani C, Meneghelli I, Tamanini A, Assael BM. Early diagnosis from newborn screening maximises survival in severe cystic fibrosis. ERJ Open Res. 2018;4:2.
Article
Google Scholar
-
Castellani C, Linnane B, Pranke I, Cresta F, Sermet-Gaudelus I, Peckham D. Cystic fibrosis diagnosis in newborns, children, and adults. Semin Respir Crit Care Med. 2019;40(6):701–14. https://doi.org/10.1055/s-0039-1697961.
Article
PubMedGoogle Scholar
-
Barben J, Castellani C, Dankert-Roelse J, Gartner S, Kashirskaya N, Sands D. Et all. The expansion and performance of national newborn screening programmes for cystic fibrosis in Europe. J Cyst Fibros. 2017;16(2):207–13. https://doi.org/10.1016/j.jcf.2016.12.012.
Article
PubMedGoogle Scholar
-
Byrnes C, Vidmar S, Cheney J, Carlin J, Armstrong D, Cooper P, et al. Prospective evaluation of respiratory exacerbations in children with cystic fibrosis from newborn screening to 5 years of age. Thorax. 2013;68(7):643–51. https://doi.org/10.1136/thoraxjnl-2012-202342.
Article
PubMed
PubMed CentralGoogle Scholar
-
Goss C. Acute pulmonary exacerbations in cystic fibrosis. Semin Respir Crit Care Med. 2019;40(6):792–803. https://doi.org/10.1055/s-0039-1697975.
Article
PubMed
PubMed CentralGoogle Scholar
-
Reid DW, Blizzard CL, Shugg DM, Flowers C, Cash C, Greville HM. Changes in cystic fibrosis mortality in Australia, 1979-2005. Med J Aust. 2011;195(7):392–5. https://doi.org/10.5694/mja10.11229.
Article
PubMedGoogle Scholar
-
Mostofian F, Alkadri J, Tang K, Thampi N, Radhakrishnan D. A real world evaluation of the long-term efficacy of strategies to prevent chronic Pseudomonas aeruginosa pulmonary infection in children with cystic fibrosis. Int J Infect Dis. 2019;85:92–7. https://doi.org/10.1016/j.ijid.2019.05.026.
Article
PubMedGoogle Scholar
-
Armbruster CR, Wolter DJ, Mishra M, Hayden HS, Radey MC, Merrihew G, et al. Staphylococcus aureus protein A mediates interspecies interactions at the cell surface of Pseudomonas aeruginosa. MBio. 2016;7:3.
Article
Google Scholar
-
Sawicki GS, Signorovitch JE, Zhang J, Latremouille-Viau D, vonWartburg M, Wu EQ, et al. Reduced mortality in cystic fibrosis patients treated with tobramycin inhalation solution. Pediatr Pulmonol. 2012;47(1):44–52. https://doi.org/10.1002/ppul.21521.
Article
PubMedGoogle Scholar
-
Moss RB. Long-term benefits of inhaled tobramycin in adolescent patients with cystic fibrosis. Chest. 2002;121(1):55–63. https://doi.org/10.1378/chest.121.1.55.
Article
CAS
PubMedGoogle Scholar
-
Farrell PM, Kosorok MR, Rock MJ, Laxova A, Zeng L, Lai HC, et al. Early diagnosis of cystic fibrosis through neonatal screening prevents severe malnutrition and improves long-term growth. Wisconsin cystic fibrosis neonatal screening study group. Pediatrics. 2001;107(1):1–13. https://doi.org/10.1542/peds.107.1.1.
Article
CAS
PubMedGoogle Scholar
-
Bobadilla JL, Macek M, Fine JP, Farrell PM. Cystic fibrosis: a worldwide analysis of CFTR mutations – correlation with incidence data and application to screening. Hum Mutat. 2002;19(6):575–606. https://doi.org/10.1002/humu.10041.
Article
CAS
PubMedGoogle Scholar
-
Fritz A, Farrell P. Estimating the annual number of false negative cystic fibrosis newborn screening tests. Pediatr Pulmonol. 2011;47(2):207–8. https://doi.org/10.1002/ppul.21561.
Article
PubMedGoogle Scholar
-
Tan SMJ, Coffey MJ, Ooi CY. Differences in clinical outcomes of paediatric cystic fibrosis patients with and without meconium ileus. J Cyst Fibros. 2019;18(6):857–62. https://doi.org/10.1016/j.jcf.2019.09.008.
Article
PubMedGoogle Scholar
Download references
Acknowledgements
Not applicable.
Author information
Authors and Affiliations
-
Department of Pediatrics and Allergy, Medical University of Lodz, Copernicus Memorial Hospital, Korczak Paediatric Center, Piłsudskiego 71 Str, 90-329, Lodz, Poland
M. Olszowiec-Chlebna, E. Mospinek & J. Jerzynska
Authors
- M. Olszowiec-Chlebna
You can also search for this author in
PubMed Google Scholar - E. Mospinek
You can also search for this author in
PubMed Google Scholar - J. Jerzynska
You can also search for this author in
PubMed Google Scholar
Contributions
M. Olszowiec-Chlebna MD PhD (literature search, study design, analysis of data, manuscript preparation), E. Mospinek MD (literature search, analysis of data). J. Jerzynska MD, PhD, Prof (study design, manuscript preparation, review of manuscript). The author(s) read and approved the final manuscript.
Corresponding author
Correspondence to
J. Jerzynska.
Ethics declarations
Ethics approval and consent to participate
The study was approved by the Ethical Committee of the Medical University of Lodz, Poland (nr RNN/145/20/KE).
Consent for publication
Not applicable.
Competing interests
The authors declare that they have no competing interests.
Additional information
Publisher’s Note
Springer Nature remains neutral with regard to jurisdictional claims in published maps and institutional affiliations.
Rights and permissions
Open Access This article is licensed under a Creative Commons Attribution 4.0 International License, which permits use, sharing, adaptation, distribution and reproduction in any medium or format, as long as you give appropriate credit to the original author(s) and the source, provide a link to the Creative Commons licence, and indicate if changes were made. The images or other third party material in this article are included in the article’s Creative Commons licence, unless indicated otherwise in a credit line to the material. If material is not included in the article’s Creative Commons licence and your intended use is not permitted by statutory regulation or exceeds the permitted use, you will need to obtain permission directly from the copyright holder. To view a copy of this licence, visit http://creativecommons.org/licenses/by/4.0/. The Creative Commons Public Domain Dedication waiver (http://creativecommons.org/publicdomain/zero/1.0/) applies to the data made available in this article, unless otherwise stated in a credit line to the data.
Reprints and Permissions
About this article
Cite this article
Olszowiec-Chlebna, M., Mospinek, E. & Jerzynska, J. Impact of newborn screening for cystic fibrosis on clinical outcomes of pediatric patients: 10 years’ experience in Lodz Voivodship.
Ital J Pediatr 47, 87 (2021). https://doi.org/10.1186/s13052-021-01040-5
Download citation
-
Received: 03 November 2020
-
Accepted: 26 March 2021
-
Published: 09 April 2021
-
DOI: https://doi.org/10.1186/s13052-021-01040-5
Keywords
- Cystic fibrosis
- New born screening
- Diagnosis
- IRT/DNA protocol
- Children
- Research
- Open Access
- Published: 09 April 2021
Italian Journal of Pediatrics
volume 47, Article number: 87 (2021)
Cite this article
-
2016 Accesses
-
1 Citations
-
1 Altmetric
-
Metrics details
Abstract
Background
Cystic Fibrosis newborn screening (CFNBS) is the optimal method to diagnose the disease during the asymptomatic period. The aim of the study was to determine how CFNBS affects long term clinical outcomes.
Methods
Data from infants who were born in Lodz Voivodship, referred to CF center as a part of CFNBS according to IRT/DNA protocol were compared to the data of children with established CF diagnosis before the start of NBS in Poland (Group CF, n = 52).
Results
In 37 children (during 151 referred infants) the diagnosis of CF was established due to CF NBS (CF NBS Group, n = 37). The average time of diagnosis was 1.59 month in Group CF NBS and 45.25 months in 52 children from Group CF.
Pulmonary exacerbations occurred on average 4.2 times in Group CFNBS and they were hospitalized on average 0.5 times compared to Group CF – respectively 6.77 and 2.14 (p < 0.001).
The number of PA infected patients increased between the fifth and eighth year of age (OR = 1.16 (95% CI: 1.04–19) (P = 0.007)) regardless of the study group (P = 0.984). Patients with MRSA infection have a higher risk of PA infections in subsequent years of their life (OR = 1.45 (95% CI: 1.03–2.03) (P = 0.032)).
Conclusions
CF NBS has beneficial effects primarily on decrease of pulmonary withhope for a longer life expectancy and better and centralised treatment in multidisciplinary CF focused centres.
Introduction
Cystic fibrosis (CF) is the most common fatal autosomal recessive disease in Caucasians [1]. It is widely recognized that CF is a variable condition, that may affect the respiratory tract, pancreas, intestine, male genital tract, hepatobiliary system and exocrine sweat glands, resulting in complex multisystem disease. The severity of clinical symptoms results due to pathogenic mutations in both alleles of the CF transmembrane conductance regulator (CFTR) gene. More than 1950 mutations have been described so far in the CFTR gene, grouped in 5 classes based on the impact on protein synthesis or activity [2, 3].
Over the last 50 years, European countries have introduced newborn bloodspot screening (NBS) for a range of inherited diseases as an important public health program. In 2004, the European CF Society established the Neonatal Screening Working Group (NSWG) to support the implementation of CF NBS program across Europe [4, 5]. CF NBS is the optimal method to diagnose the disease during the asymptomatic period. The primary goal of newborn screening is to decrease morbidity, mortality and associated disabilities. The early diagnosis is associated with improved physical development and slower lung deterioration due to the lower frequency of infections.
All CF NBS programs begin with detection of an elevated immunoreactive trypsinogen (IRT) level in a dried blood specimen from the newborn [3, 5, 6]. A positive IRTscreen is triaged to second-tier testing, which is DNA mutation testing in many national screening programs, including Poland (IRT/DNA protocol) [3,4,5,6,7]. Despite the advent of NBS and improved knowledge about CFTR genetics, CF diagnosis remains incomplete for many reasons, such as inconclusive sweat chloride values, CFTR mutations of uncertain pathogenicity, and differential expression of CFTR or modifier effects [8]. Also CF NBS introduced a new complexity and diagnostic dilemma, namely infants with abnormal screening tests, because of elevated immunoreactive IRT levels but inconclusive sweat tests and/or DNA results. The term for infants with an inconclusive diagnosis have been proposed: CF screen positive, inconclusive diagnosis (CFSPID) in Europe [9].
The first pilot NBS CF study was performed in Poland from 1999 to 2002 and included about 25% of the Polish population. The current program was implemented in 2006 and was expanded to the whole country in the summer of 2009. In Lodz Voivodeship, CF NBS was introduced on 1st June 2009 [3, 6, 7].
The research presents 10 years of experience of our CF center with the national newborn CF screening program in Lodz Voivodship and including the analyzis of diagnostic dilemma occurred during the program. The aim of the study was to determine how early diagnosis of CF, using neonatal screening with IRT/DNA protocol, affects long term clinical outcomes in comparison to CF patients with disease diagnosed before CF NBS?
Material and methods
Patients
Patients participated in the screening program
The study population comprised of infants who were born between 01.07.2009 and 31.12.2019 in Lodz Voivodship and were referred to our CF center as a part of NBS for CF and performed CFTR gene analysis according to IRT/DNA protocol described below. The infants had been evaluated at least once per 3 months. They were divided to three groups according to laboratory tests and further clinical evaluation as CF NBS Group, CF SPID and false positive NBS. Cystic fibrosis (CF NBS Group) was diagnosed in infants based on the level of sweat chloride in addition to evidence of CFTR dysfunction. The designation CF SPID was established to asymptomatic infants if they presented a positive CF NBS test plus: sweat chloride < 59 mmol/L and 2 CFTR mutations with 0–1 CF-causing CFTR mutations. The asymptomatic CF NBS positive infant with presence of no CFTR mutation or mutation in one allele plus a negative sweat test, referred as false positive NBS (including carriers).
Patients diagnosed with CF before introduction of screening program
We also analyzed data of 52 patients (24 females and 28 males) with established CF diagnosis born between 1996 and 2009 (before the newborn screening in Poland) attending our Cystic Fibrosis Outpatient Center in Copernicus Hospital in Lodz, Poland. Patients in this group had been referred to the Center due to occurrence of symptoms suggesting CF (CF Group).
Next, we compared both groups CF NBS and CF. We have chosen the interval — between 5 and 8 years of age to compare both groups, because at that time the most data were available.
Data assessment
In both groups the data were obtained retrospectively after a review of patient charts. The socio-economic data were analysed. These included a place of living defined as a large city above 100,000 inhabitants, a small city 10,000–100,000 inhabitants, and a village below 10,000 inhabitants. The perinatal period contained data: delivery data and weight, Apgar score and presence of meconium ileus (MI), time of CF diagnosis. We also analysed body weight and percentile of body weight at 5 and 8 years of age.
Clinical evaluation
Respiratory status was assessed by the forced expiratory volume in 1 s (FEV1) in spirometry, expressed as percentages of predicted values for height, weight, age, and gender. All analyzed measurements were done in fifth and 8 year of life, only in stable periods (using a Jaeger MasterScreen Body spirometer; E Jaeger GmbH; Wurzburg, Germany). The tests were performed according to American Thoracic Society standards [10].
The number of bronchopulmonary exacerbations and number of hospitalizations (due to pulmonary disease, longer than 3 days) between five and 8 years of life were evaluated. Pulmonary exacerbation was defined as excessive sputum expectoration, general malaise, and need for antibiotics. Chronic bacteria colonization Pseudomonas aeruginosa (PA) or methicillin-resistant Staphylococcus aureus (MRSA) were also collected, and defined as three positive consecutive sputum cultures over a period of 6 months in fifth and 8 year of life.
CF NBS protocol
IRT was measured in dried blood samples from 3 to 5 days old neonates. The IRT concentration cut-off was established as > 99.4 percentile (according to the pilot CF NBS program [6]). The elevated IRT caused further genetic testing from the same dried blood samples. In neonates with meconium ileus (MI), the DNA analysis was performed regardless of IRT level. The measurements of IRT (by using IRT Neonatal Screening ELISA colorimetric assay — IBL International) and DNA analysis from sampling paper (processing with the Extract Blood PCR Kit) were performed in the Genetic Department, Institute of Mother and Child, Warsaw, Poland. Since September 2011, the extended DNA analysis panel has been used and comprised 95% of mutated alleles in the Polish population.
Neonates with one or two mutations in CFTR detected due to NBS examinations were directed to CF Centres for clinical assessment and sweat tests (measured by the quantitative pilocarpine iontophoresis method and Nanoduct method parallel) [6]. CF NBS was conducted as a pilot programme in four Polish districts in the period 1999–2003. In 2006 CF NBS started again in the same regions and was gradually extended across the country. In June 2009 covered all of newborn population in Poland. In the 1980s, the prevalence of CF for Caucasians was estimated at 1: 2500 live births. The disease incidence was more accurately calculated to 1: 4000–5000 thanks to the extensive implementation of CF NBS in the world. In Poland due to data from CF NBS in the years 2006–2010 it is believed that one child every 4394 live births is born with CF.
The study was approved by the Ethical Committee of the Medical University of Lodz, Poland (nr RNN/145/20/KE).
Statistical analysis
Numerical traits were described by way of the arithmetic mean, standard deviation (SD), standard error (SE), when applicable, and their minimum-to-maximum values. Categorical variables were depicted by using counts (n) and percentages (%).
Multiple logistic (for binary dependent variables), multiple linear (for numerical traits), and multiple Poisson (for count data) regression models were fitted in order to test statistical co-dependencies. When dealing with non-normally distributed variables, robust standard errors (i.e. sandwich estimators) were used in the regression equations. All the regression models were controlled for the studied patients’ characteristics such as sex, gender, place of residence, birth weight, APGAR and also for crucial infections (PA, MRSA) before their 5th year of age. Missing data were case-wise deleted.
A level of P < 0.05 was deemed statistically significant. All the computations were performed by using of Stata/Special Edition, release 14.2 (StataCorp LP, College Station, Texas, USA).
Results
Evaluation of patients participated in the screening program (CF NBS positive infants)
One hundred fifty one infants were referred to our CF center as a part of NBS for CF due to CF suspicion: 84 females and 67 males. The CFTR gene analysis for each positive IRT, and neonates with MI regardless of IRT levels, allowed to identify mutations in one allele in 145 patients and in both alleles in 44 patients (96.03% of screened CF patients). Among 44 cases, after biochemical, genetic and clinical evaluations, in 37 children the diagnosis of CF was established (24.5%) during the first verifying visit (CF NBS Group) — in 76% the diagnosis was establish up to 35 days after birth, in 9 patients the first verifying visit took place later in life due to hospitalization connected with their MI. The mean birth weight in CF NBS patients was 3226.34 g, In this group, 9 patients had MI (24.32%). In the remaining 7 (out of 44) cases (15.9%), despite detection of two CFTR mutations, a clinical evaluation did not confirm the CF diagnosis (CF SPID). These infants had the CFTR genotype as follows: 3 patients with [F508del]; [IVS8-5 T+(TG)11], [3849 + 10kbC > T];[R117H], [Y301C];[3271 + 18C > T], [V754M];[V562L], [F508del];[R117H]. The above mutations found at least in one allele causing unproven or uncertain clinical consequences. These patients remain under the observation of our clinic. The most common mutation was F508 del, detected in 104 patients in one or both alleles (68.88%).
Six patients (3.97%) who were directed to the Cystic Fibrosis Outpatient based on the IRT elevations, had DNA analysis for CF mutations negative and they sweat chloride test was correct (false positive NBS). After further observations and examinations, the CF was excluded. So far (until December 2019) we also have information about two cases of false-negative results in CF NBS in our region (false negative NBS).
Comparison of group CF NBS and group CF
At the time of data collection 27 of CF NBS patients were at least 8 years old, remain under the medical care in our CF Outpatient Center and were included into compared analysis. The Group CF NBS with positive result of newborn CF screening included: 59% females, mean birth weight 3168.52 g and mean Apgar 8.78. Mutation F508 del was detected in both alleles in 29.63% patients.
Fifty two patients belonging to the Group CF, were born between 1996 and 2009 (before the start of newborn screening in Poland) – 24 females and 28 males. They were included into compared analysis with Group CF NBS. Their mean birth weight was 3195.6 g, Apgar 8.54, F508 del mutation in both alleles was detected in 50% cases.
Group CF NBS and Group CF demographic and clinical characteristics are shown in Table 1.
Full size table
The average time of the CF diagnosis was 45.25 months from birth in Group CF.
and 1.59 months in Group CF NBS.
The most significant difference between this two Groups was the number of exacerbations and hospitalizations between 5 and 8 years of life (p < 0.001). Pulmonary exacerbation in analysed period occurred on average 4.2 times in children in Group CF NBS and they were hospitalized on average 0.5 times. While in Group CF children mean of pulmonary exacerbations was 6.77 and mean number of hospitalization was 2.14.
Even though the average body weight and its percentile value was higher in the Group CF NBS, this difference was not significant. What is more weight gain between 5 and 8 years old was greater in the Group CF. No statistically significant predictors affecting weight gain in both groups were defined.
In spirometry measurements patients in both groups presented stable values of FEV1 during at least 3 years of observation, and the difference was not significant.
The number of PA infected patients increased significantly between the fifth and eighth year of age of the examined children (OR = 1.16 (95% CI: 1.04–19) (P = 0.007)) regardless of the study group (P = 0.984). It seems that patients with MRSA infection in the fifth year of life have a higher risk of PA infections in subsequent years of their life (OR = 1.45 (95% CI: 1.03–2.03) (P = 0.032)). The number of patients with PA or MRSA infection in the fifth year of life and PA infection in the age of 8 was greater in the CF Group, but these differences were not statistically significant.
Descriptive characteristics of all CF patients by screening status are shown in Table 2.
Full size table
Discussion
According to the Neonatal Screening Working Group new-born screening for CF provides an immediate diagnosis, before the onset of clinical symptoms [11,12,13]. In the beginning CF NBS raised doubts about ethical aspects with regard to possible benefits and risks. After many years of experience CF NBS has been widely implemented and accepted. Ten years of CF NBS programme in Lodz Voivodship leads to diagnosis of CF in 37 neonates among 151 children directed after their birth with CF suspicion to our Outpatient Center. The incidence of CF in Poland based on neonatal screening is currently 1:4394–1:5000 [3, 6].
CF NBS has been based on the assumption that pre-symptomatic detection permits early access to specialised medical care, and thus results in less morbidity and longer life expectancy. In our region CF NBS screened patients were diagnosed and treated in multidisciplinary CF centre between first and second month of their life. For comparison the median age of the diagnosis of patients, who were born before the start of CF NBS in Poland due to typical CF symptoms – 45.25 months from their birth. According to the literature, the most benefits associated with early identification of CF including include better growth and lung function, less intensive therapeutic burden and reduced cost of care [11,12,13,14]. Our observations show that early diagnosis and the introduction of appropriate treatment for asymptomatic CF patients resulted in a lower frequency of the pulmonary exacerbation and lower number of hospitalizations. It is very beneficial observation due to reports which emphasise that the repeated mild-to-moderate pulmonary exacerbations, especially in the first years of life result in airway remodelling. While more severe hospitalised episodes could increase structural airway injury risk [13,14,15,16]. Data from Australia showed improved survival in future in patients with lower number of hospitalisations in the first 3 years of life [17]. The occurrence of respiratory exacerbations are associated with an accelerated decline in lung function and reduced quality of life and survival [15,16,17]. On the other hand mean values of FEV1 in the analysed patients, presented stable results during at least 3 years of observation; there was no difference between Groups. This may be due to the age — below 8 — too early to identify significant differences in FEV1 secondary to clinical outcome (such as pulmonary exacerbations, bacterial colonisations), which likely takes longer to cause impairment of lung function that is identifiable with spirometry [16].
Children with CF are highly susceptible to chronic respiratory tract colonization and subsequent recurrent infection. It is know that once chronic PA infection is established, the risk of mortality and morbidity increases [18, 19]. In our study the mean number of patients with PA or MRSA colonization in the 5 years old and PA chronic infection in the age of 8 was lower among children screened in NBS, but there were no significant differences between both groups. The number of PA infected persons increased significantly between the fifth and eighth year of age regardless of belonging to the study group. Although the increasing number of SA and PA colonized patients were observed with age in both CF NBS and CF group, the CF NBS children had fewer exacerbations and hospitalisations due to intensively treatment from the very first PA sputum detection. The important observation was that patients in both groups with SA infection in the fifth year of life have a higher risk of PA infections in subsequent years of their life. Persistent presence of MRSA in the respiratory tract is associated with increased rates of PA through mediation of PA biofilm formation [18, 19]. In practice, we suggest to employ intermittent, symptom-based treatment of SA especially MRSA to delay initial PA colonization. The colonization with PA remains the most ordinary airway pathogen contributing to shortened survival in CF patients. For over a two decades antibiotic effective for PA (for example tobramycin inhalation solution (TIS)) is recommended for the treatment and early introduction with TIS has resulted in improved lung function and reduced risk of airway exacerbations [20, 21]. In our study in CF group the diagnosis was established mean in 42.25 month of life, but even maximally in 180 months of life. In such situation at the time of CF recognition patients’ sputum were often positive for PA and we treated PA colonization not an initial infection. Patients from CF NBS group were treated intensively from the very first PA sputum detection. We believe this may have contributed to a reduction in the number of pulmonary exacerbations and associated hospitalizations. Moss et al. [21] proved that delay in initiation of TIS therapy is associated with reduced long-term improvement over baseline, suggesting an irreversible component to lung function decline. To be maximally effective, TIS treatment should begin early after first detection of PA. In agreement to this study, although the incidence of PA found in the airways became similar over the years in both study groups (CF and CF NBS) the number of exacerbations and hospitalizations in CF NBS group was significant lower.
CF NBS allows the affected infants to receive immediate treatments including not only physiotherapy and preventing of pulmonary manifestations of the disease, but also great emphasis is pleased on assessment of nutritional status, and pancreatic enzyme replacement therapy. The Wisconsin randomised trial on newborn screening for CF showed that screened neonates exhibit better nutritional status in the first years of life [22], but no output is available from this cohort on long-term survival. We observed trend that body weight were higher in the CF NBS Group and they presented systematic and stable weight gain but this results were not statistically significant.
According to data published by Bobadilla et al., the complete CFTR gene analysis by sequencing of selected regions should identify mutations in one or both alleles in nearly 95% of screened children [23] and IRT/DNA strategy to achieve sensitivity close to 100% (despite children with MI, whose IRT level is not elevated). Due to Fritz formula the predicted false-negative rate for the Polish population is 6–7 cases per year, which gives 1–2 omitted CF cases per 100,000 live births [24]. It shows that despite the high sensitivity and specificity of IRT/DNA protocol it is important to follow patients with CF suggestive symptoms even when CF NBS was negative. We had two cases of false-negative results in CF NBS in our region to this day. According to normal values of the IRT in new-borns with MI they are in risk group of a false-negative first step of CF NBS protocol. Each case of MI should be reported to the NBS center by appropriate note on sampling paper and neonates must to be verify in CF centers. In our study, the new-borns with MI represent 24% of CF diagnosis, while the literature data shows MI frequency about 10–20% [25].
The IRT/DNA strategy allows to detect not only CF disease but also carries of the CFTR gene mutations, as well as cases of unclear clinical consequences. This fact constitutes a definite psychological problem for patients and their parents and raised doubts about ethical aspects of the CF NBS. It may have negative influences on further procreation of such persons. We detected 101 patients with mutations only in one allele of CFTR gene (what was 66.89% of all neonates from CF NBS). They were defined as carriers and in all cases, a genetic consultations for their parents and siblings was recommended.
Some limitations of our current study include a single centre analysis, which limits its generalizability. What is more we made the comparison to historical data (a blinded controlled study with CF- newborns left untreated was unacceptable due to ethical reasons).
Over the years new therapies were approved, standards of care established therefore, the outcomes of same patients in subsequent years is expected to be improved, even without the advent of newborn screening. We have to choose the appropriate time interval to compere a historical cohort (CF Group) and CF NBS positive patients.
Conclusion
In conclusion, newborn screening contributes to early diagnosis of cystic fibrosis. The presented study showed that CF NBS has beneficial effects primarily on decrease of pulmonary exacerbations with hope for a longer life expectancy in these group.
Availability of data and materials
The datasets used and/or analysed during the current study are available from the corresponding author on reasonable request.
Abbreviations
- CF:
-
Cystic fibrosis
- CFNBS:
-
Cystic Fibrosis newborn screening
- CFTR:
-
CF transmembrane conductance regulator
- FEV1:
-
The forced expiratory volume in 1 s
- IRT:
-
Immunoreactive trypsinogen
- MI:
-
Meconium ileus
- NSWG:
-
Neonatal Screening Working Group
- PA:
-
Pseudomonas aeruginosa
- MRSA:
-
Methicillin-resistant Staphylococcus aureus
- TIS:
-
Tobramycin inhalation solution
References
-
Farrell PM. The prevalence of cystic fibrosis in the European Union. J Cyst Fibros. 2008;7(5):450–3. https://doi.org/10.1016/j.jcf.2008.03.007.
Article
PubMedGoogle Scholar
-
Paranjapye A, Ruffin M, Harris A, Corvol H. Genetic variation in CFTR and modifier loci may modulate cystic fibrosis disease severity. J Cyst Fibros. 2019;13(19):30963–4.
Google Scholar
-
Sobczyńska-Tomaszewska A, Ołtarzewski M, Czerska K, Wertheim-Tysarowska K, Sands D, Walkowiak J, et al. Newborn screening for cystic fibrosis: polish 4 years experience with CFTR sequencing strategy. European J Human Genet. 2013;21(4):391–6. https://doi.org/10.1038/ejhg.2012.180.
Article
CASGoogle Scholar
-
Barben J, Castellani C, Dankert-Roelse J, Gartner S, Kashirskaya N, Linnane B, et al. The expansion and performance of national newborn screening programmes for cystic fibrosis in Europe. J Cyst Fibros. 2017;16(2):207–13. https://doi.org/10.1016/j.jcf.2016.12.012.
Article
PubMedGoogle Scholar
-
Loeber JG, Burgard P, Cornel MC, Rigter T, Weinreich SS, Rupp K, et al. Newborn screening programmes in Europe; arguments and efforts regarding harmonization. Part 1. From blood spot to screening result. J Inherit Metab Dis. 2012;35(4):603–11. https://doi.org/10.1007/s10545-012-9483-0.
Article
PubMedGoogle Scholar
-
Sands D, Zybert K, Mierzejewska E, Ołtarzewski M. Diagnosing cystic fibrosis in newborn screening in Poland — 15 years of experience. Dev Period Med. 2015;19(1):16–24.
PubMed
Google Scholar
-
Zietkiewicz E, Rutkiewicz E, Pogorzelski A, Klimek B, Voelkel K, Witt M. CFTR mutations spectrum and the efficiency of molecular diagnostics in polish cystic fibrosis patients. PLoS One. 2014;26(2):8909.
Google Scholar
-
Levy H, Nugent M, Schneck K, Stachiw-Hietpas D, Laxova A, Lakser O, et al. Refining the continuum of CFTR-associated disorders in the era of newborn screening. Clin Genet. 2016;89(5):539–49. https://doi.org/10.1111/cge.12711.
Article
CAS
PubMed
PubMed CentralGoogle Scholar
-
Ren C, Borowitz D, Gonska T, Howenstine M, Levy H, Massie J, et al. Cystic fibrosis transmembrane conductance regulator-related metabolic syndrome and cystic fibrosis screen positive, inconclusive diagnosis. J Pediatr. 2017;181:45–51.
Article
Google Scholar
-
Miller MR, Hankinson J, Brusasco V, Burgos F, Casaburi A, Coates A, et al. Standardisation of spirometry. Eur Respir J. 2005;26(2):319–38. https://doi.org/10.1183/09031936.05.00034805.
Article
CASGoogle Scholar
-
Castellani C, Massie J, Sontag M, Southern KW. Newborn screening for cystic fibrosis. Lancet Respir Med. 2016;4(8):653–61. https://doi.org/10.1016/S2213-2600(16)00053-9.
Article
PubMedGoogle Scholar
-
Tridello G, Castellani C, Meneghelli I, Tamanini A, Assael BM. Early diagnosis from newborn screening maximises survival in severe cystic fibrosis. ERJ Open Res. 2018;4:2.
Article
Google Scholar
-
Castellani C, Linnane B, Pranke I, Cresta F, Sermet-Gaudelus I, Peckham D. Cystic fibrosis diagnosis in newborns, children, and adults. Semin Respir Crit Care Med. 2019;40(6):701–14. https://doi.org/10.1055/s-0039-1697961.
Article
PubMedGoogle Scholar
-
Barben J, Castellani C, Dankert-Roelse J, Gartner S, Kashirskaya N, Sands D. Et all. The expansion and performance of national newborn screening programmes for cystic fibrosis in Europe. J Cyst Fibros. 2017;16(2):207–13. https://doi.org/10.1016/j.jcf.2016.12.012.
Article
PubMedGoogle Scholar
-
Byrnes C, Vidmar S, Cheney J, Carlin J, Armstrong D, Cooper P, et al. Prospective evaluation of respiratory exacerbations in children with cystic fibrosis from newborn screening to 5 years of age. Thorax. 2013;68(7):643–51. https://doi.org/10.1136/thoraxjnl-2012-202342.
Article
PubMed
PubMed CentralGoogle Scholar
-
Goss C. Acute pulmonary exacerbations in cystic fibrosis. Semin Respir Crit Care Med. 2019;40(6):792–803. https://doi.org/10.1055/s-0039-1697975.
Article
PubMed
PubMed CentralGoogle Scholar
-
Reid DW, Blizzard CL, Shugg DM, Flowers C, Cash C, Greville HM. Changes in cystic fibrosis mortality in Australia, 1979-2005. Med J Aust. 2011;195(7):392–5. https://doi.org/10.5694/mja10.11229.
Article
PubMedGoogle Scholar
-
Mostofian F, Alkadri J, Tang K, Thampi N, Radhakrishnan D. A real world evaluation of the long-term efficacy of strategies to prevent chronic Pseudomonas aeruginosa pulmonary infection in children with cystic fibrosis. Int J Infect Dis. 2019;85:92–7. https://doi.org/10.1016/j.ijid.2019.05.026.
Article
PubMedGoogle Scholar
-
Armbruster CR, Wolter DJ, Mishra M, Hayden HS, Radey MC, Merrihew G, et al. Staphylococcus aureus protein A mediates interspecies interactions at the cell surface of Pseudomonas aeruginosa. MBio. 2016;7:3.
Article
Google Scholar
-
Sawicki GS, Signorovitch JE, Zhang J, Latremouille-Viau D, vonWartburg M, Wu EQ, et al. Reduced mortality in cystic fibrosis patients treated with tobramycin inhalation solution. Pediatr Pulmonol. 2012;47(1):44–52. https://doi.org/10.1002/ppul.21521.
Article
PubMedGoogle Scholar
-
Moss RB. Long-term benefits of inhaled tobramycin in adolescent patients with cystic fibrosis. Chest. 2002;121(1):55–63. https://doi.org/10.1378/chest.121.1.55.
Article
CAS
PubMedGoogle Scholar
-
Farrell PM, Kosorok MR, Rock MJ, Laxova A, Zeng L, Lai HC, et al. Early diagnosis of cystic fibrosis through neonatal screening prevents severe malnutrition and improves long-term growth. Wisconsin cystic fibrosis neonatal screening study group. Pediatrics. 2001;107(1):1–13. https://doi.org/10.1542/peds.107.1.1.
Article
CAS
PubMedGoogle Scholar
-
Bobadilla JL, Macek M, Fine JP, Farrell PM. Cystic fibrosis: a worldwide analysis of CFTR mutations – correlation with incidence data and application to screening. Hum Mutat. 2002;19(6):575–606. https://doi.org/10.1002/humu.10041.
Article
CAS
PubMedGoogle Scholar
-
Fritz A, Farrell P. Estimating the annual number of false negative cystic fibrosis newborn screening tests. Pediatr Pulmonol. 2011;47(2):207–8. https://doi.org/10.1002/ppul.21561.
Article
PubMedGoogle Scholar
-
Tan SMJ, Coffey MJ, Ooi CY. Differences in clinical outcomes of paediatric cystic fibrosis patients with and without meconium ileus. J Cyst Fibros. 2019;18(6):857–62. https://doi.org/10.1016/j.jcf.2019.09.008.
Article
PubMedGoogle Scholar
Download references
Acknowledgements
Not applicable.
Author information
Authors and Affiliations
-
Department of Pediatrics and Allergy, Medical University of Lodz, Copernicus Memorial Hospital, Korczak Paediatric Center, Piłsudskiego 71 Str, 90-329, Lodz, Poland
M. Olszowiec-Chlebna, E. Mospinek & J. Jerzynska
Authors
- M. Olszowiec-Chlebna
You can also search for this author in
PubMed Google Scholar - E. Mospinek
You can also search for this author in
PubMed Google Scholar - J. Jerzynska
You can also search for this author in
PubMed Google Scholar
Contributions
M. Olszowiec-Chlebna MD PhD (literature search, study design, analysis of data, manuscript preparation), E. Mospinek MD (literature search, analysis of data). J. Jerzynska MD, PhD, Prof (study design, manuscript preparation, review of manuscript). The author(s) read and approved the final manuscript.
Corresponding author
Correspondence to
J. Jerzynska.
Ethics declarations
Ethics approval and consent to participate
The study was approved by the Ethical Committee of the Medical University of Lodz, Poland (nr RNN/145/20/KE).
Consent for publication
Not applicable.
Competing interests
The authors declare that they have no competing interests.
Additional information
Publisher’s Note
Springer Nature remains neutral with regard to jurisdictional claims in published maps and institutional affiliations.
Rights and permissions
Open Access This article is licensed under a Creative Commons Attribution 4.0 International License, which permits use, sharing, adaptation, distribution and reproduction in any medium or format, as long as you give appropriate credit to the original author(s) and the source, provide a link to the Creative Commons licence, and indicate if changes were made. The images or other third party material in this article are included in the article’s Creative Commons licence, unless indicated otherwise in a credit line to the material. If material is not included in the article’s Creative Commons licence and your intended use is not permitted by statutory regulation or exceeds the permitted use, you will need to obtain permission directly from the copyright holder. To view a copy of this licence, visit http://creativecommons.org/licenses/by/4.0/. The Creative Commons Public Domain Dedication waiver (http://creativecommons.org/publicdomain/zero/1.0/) applies to the data made available in this article, unless otherwise stated in a credit line to the data.
Reprints and Permissions
About this article
Cite this article
Olszowiec-Chlebna, M., Mospinek, E. & Jerzynska, J. Impact of newborn screening for cystic fibrosis on clinical outcomes of pediatric patients: 10 years’ experience in Lodz Voivodship.
Ital J Pediatr 47, 87 (2021). https://doi.org/10.1186/s13052-021-01040-5
Download citation
-
Received: 03 November 2020
-
Accepted: 26 March 2021
-
Published: 09 April 2021
-
DOI: https://doi.org/10.1186/s13052-021-01040-5
Keywords
- Cystic fibrosis
- New born screening
- Diagnosis
- IRT/DNA protocol
- Children
1858 просмотров
5 ноября 2021
ИРТ=173.64нг/мл (норма до 64,9). Нуждается в потовой пробе.
дозвониться до МОНИКов пока не могу, ни в оставленные телефоны ни в справку. Помогите, на обывательский глаз серьёзное превышение! Все глаза выплакала, ребёнку 2 месяца, поправились с 3140г до 6кг за два месяца, бодр и весел. Успокойте хоть немного, что всё не так плохо!!
Уважаемые посетители сайта СпросиВрача! Вы можете задать свой вопрос и получить медицинскую консультацию онлайн быстро, просто и без регистрации! Сервис работает круглосуточно и без выходных.
Врач КДЛ
Здравствуйте, Екатерина!
То, что у вас идет хороший набор веса, это прекрасно, особенно, если нет проблем с пищеварением. Но нужно набраться терпения, не реветь, а наслаждаться материнством здесь и сейчас! И важно пройти все этапы диагностики.
Обследование на муковисцидоз включает 4 этапа:
1. иммунореактивный трипсиноген (ИРТ) – на 4-5 день у доношенных детей,
2. повторный тест по ИРТ на 21-28 день жизни,
3. потовый тест
4. ДНК–диагностику.
При этом только первые три являются обязательными.
Пороговым является уровень ИРТ 70 нг/мл (в вашей тест системе — 64,9), показатели, превышающие его, считаются положительными. В вашем случае превышение существенное, но следует отметить, что повышение в первую неделю жизни в крови ИРТ является весьма чувствительным (85–90%), но НЕ специфичным признаком. Т.е. могут быть ложноположительные результаты ИРТ, они отмечаются при асфиксии в родах, глубокой недоношенности, заболеваниях кишечника и т.д. Поэтому необходим второй этап обследования повторный анализ на ИРТ (ре-тест) на 21–28-й день жизни, позволяющий исключить здоровых детей.
При концентрации маркера более 40 нг/мл, проводится потовая проба, которая является ключевым компонентом скрининга на муковисцидоз в России. При отрицательном результате потовой пробы (менее 40 ммоль/л) ребенок в течение первого года жизни наблюдается по месту жительства с диагнозом «неонатальная гипертрипсиногенемия» для исключения случаев гиподиагностики.
В случае пограничных результатов потового теста (40–60 ммоль/л) потовую пробу следует повторить, а также провести ДНК-диагностику.
ДНК диагностику вы можете уже сейчас сделать самостоятельно в лаборатории Инвитро, у них определяют 30 вариантов различных мутаций в гене CFTR, который отвечает за развитие муковисцидоза.
При положительном результате потовой пробы, а также при обнаружении мутаций гена CFTR (в случае пограничного результата потовой пробы) ребенку ставится диагноз муковисцидоз.
Важно: для постановки окончательного диагноза потовый тест должен быть положительным не менее трех раз. Следует отметить, что на всех этапах скрининга могут быть получены как ложноположительные, так и ложноотрицательные результаты. Потовая проба, признанная «золотым стандартом» в диагностике муковисцидоза, также не обеспечивает абсолютную точность в постановке диагноза.
В сомнительных случаях могут помочь дополнительные методы обследования (анализ кала на панкреатическую эластазу 1, микроскопическое копрологическое исследование, компьютерная томография или рентгенография органов грудной клетки).
Пусть у вас с ребенком будет все хорошо!
Екатерина, 5 ноября 2021
Клиент
Ольга, вторую сдачу крови мы уже пропустили, результат пришёл, когда ребенку уже почти 2 месяца.С таким превышением не должна ли уже появиться симптоматика заболевания? Из всех статей я таки не поняла, когда все начинается? Если ген поломан, значит и его работа должна быть сразу некорректной и это будет заметно.
И небольшое уточнение, ДНК-диагностика родителей делается в Инвитро или малышу?
Врач КДЛ
Екатерина, ДНК-диагностика осуществляется по крови ребенка. При этом может быть обнаружен гетерозиготный вариант мутации, который не приводит к развитию клинических проявлений, но на первом скрининге дает положительный результат.
Проявления муковисцидоза весьма индивидуальны и время начала клинических симптомов тоже варьирует. Зависит от варианта мутации. Поскольку есть так называемые «легкие мутации», когда клиника может начаться ближе к школьному возрасту и проявления будут в виде частых респираторных сиптомов, признаки недостаточности питания и расстройства стула.
В большинстве случаев клинические симптомы заболевания проявляются на первом году жизни. Чаще всего самым ранним признаком муковисцидоза служит сухой стойкий кашель, по мере присоединения воспалительного процесса появляется кашель с мокротой, развивается одышка и симптомы дыхательной недостаточности. Нередко в этом случае детям ставят диагноз бронхит или пневмония. Со стороны пищеварительной системы отмечаются нарушение усвоения пищи, что связано со снижением активности ферментов поджелудочной железы, частый стул или запоры, выпадение прямой кишки. У большинства детей грудного возраста дыхательные и кишечные симптомы сочетаются с задержкой физического развития, снижением роста и массы тела.
У вас сейчас в виду отсутствия клинических симптомов и хорошего набора массы прогноз весьма благоприятный.
Оцените, насколько были полезны ответы врачей
Проголосовало 3 человека,
средняя оценка 4
Анализ крови
18 ноября 2022
Дарья, Екатеринбург
Вопрос закрыт
Что делать, если я не нашел ответ на свой вопрос?
Если у Вас похожий или аналогичный вопрос, но Вы не нашли на него ответ — получите свою медицинскую консультацию онлайн.
Если Вы хотите получить более подробную консультацию врача и решить проблему быстро и индивидуально — задайте платный вопрос в приватном личном сообщении. Будьте здоровы!
Неонатальный скрининг новорожденных (НС) применяется для ранней диагностики муковисцидоза (МВ), позволяя начать лечение до появления очевидных симптомов. Как правило, этот скрининг включает в себя измерение уровня иммунореактивного трипсиногена (ИРТ) в первую неделю жизни.
После положительных результатов этого теста (ИРТ обычно повышается у пациентов с МВ) новорожденные направляются на подтверждающее тестирование, которое включает измерение количества хлоридов в потовой жидкости и генетическое тестирование на мутации в гене трансмембранного гена муковисцидоза (CFTR).
В некоторых случаях результаты НС недостаточны для подтверждения или опровержения диагноза, особенно в случаях нетипичной клинической картины в сочетании с наличием редких мутаций CFTR.
В новом докладе описывается случай 1-летнего ребенка в Польше, диагноз которого был поставлен с большим трудом.
В двухмесячном возрасте ребенок был госпитализирован с проявлениями инфекции верхних дыхательных путей. Через две недели мальчика снова госпитализировали из-за плохого набора веса и рвоты.
При рождении у ребенка отмечен положительный скрининг, выявлено повышение уровня ИРТ, свидетельствующие о возможном наличии МВ. Однако результаты потового теста у пациента не показало положительных результатов, так из четырех измерений только одно было положительным и указывало на наличие болезни. Первоначальный генетический тест на наличие более 700 мутаций, диагностируемых при МВ, не дал положительного результата.
Ребенок получал антибактериальные и противогрибковые препараты с целью купирования возможной легочной инфекции, хотя видимого клинического эффекта не отмечалось. Пациенту был установлен назогастральный зонд для обеспечения адекватного питания.
Дальнейшие исследования, включая анализ мочи пациента, свидетельствовали о нарушении обмена веществ, но окончательных результатов получено не было. У пациента также была обнаружена анемия и отеки.
Тесты на определение хлоридов в потовой жидкости были вновь повторены с использованием нескольких методик и результаты были положительными, что подтвердило наличие МВ. Дальнейшее метаболическое исследование также исключило ряд болезней со схожей клинической картиной.
Дополнительно к выполненным исследованиям был полностью секвенирован ген CFTR, обнаружены идентичные мутации (получившие название c.4035_4038dupCCTA) в обеих копиях гена (по одной унаследованной от каждого биологического родителя, ни у одного из которых не было симптомов болезни).
После нескольких месяцев комплексного лечения, включая высокобелковую диету и заместительную терапию панкреатическими ферментами, удалось добиться нормализации нутритивного статуса.
В целом, своевременная постановка диагноза была затруднена вследствие совокупности ряда факторов, пишут исследователи. Во-первых, неклассическое течение болезни, которое еще больше осложнилось неоднозначными результатами лабораторных исследований, включая и анализ хлорида в потовой жидкости.
Отрицательные генетические тесты также затрудняли постановку диагноза. Команда исследователей отметила, что первоначальное генетическое тестирование исключило 86% мутантных аллелей гена CFTR в польской популяции.
Более того, обнаруженная мутация является довольно редкой, поскольку ранее сообщалось, что она встречается только у поляков и только в сочетании с другими патогенными мутациями.
Группа пришла к выводу, что “описанный случай демонстрирует необычное течение заболевания”, и предположила, что “клинические симптомы пациента и лабораторные данные в сочетании с результатами молекулярных тестов дают полезную информацию для дальнейшего изучения генотип-фенотипических корреляций при муковисцидозе.”
Прочтите и возьмите себе на заметку, особенно если вы молодые люди
В России уже много лет проводится массовое обследование новорожденных для выявления у них нескольких наследственных заболеваний. Такое обследование проводится во многих странах и называется скринингом новорожденных или неонаталъным скринингом.
Целью скрининга новорожденных является, конечно, не само выявление новорожденных с еще не проявившимися наследственными заболеваниями, а их лечение, которое позволяет предотвратить появление клинических симптомов, во многих случаях весьма тяжелых, или даже фатальных. В результате рано начатого и аккуратно проводимого лечения вместо тяжело больных детей, а затем подростков и взрослых, получаются здоровые люди, полноценные члены общества, нередко являющиеся гордостью семьи.
Скрининг новорожденных в России ведется в отношении 5 наследственных и врожденных заболеваний: фенилкетонурии, гипотиреоза, галактоземии, адрено-гениталъного синдрома и муковисцидоза.
ЧТО ТАКОЕ МУКОВИСЦИДОЗ?
Муковисцидоз — это наследственное заболевание, обусловленное изменением (мутацией) в гене, который отвечает за синтез белка, осуществляющего в клетках функцию канала для ионов хлора. Из-за нарушения функции этого канала слизь и другие секреты становятся очень густыми и вязкими в легких, поджелудочной железе и других органах. Это приводит к развитию в легких хронической инфекции, повреждающей легочную ткань; нарушению переваривания пищи, поскольку ферменты поджелудочной железы не могут попасть в кишечник, и другим клиническим проявлениям.
КАК НАСЛЕДУЕТСЯ МУКОВИСЦИДОЗ?
Муковисцидоз наследуется по аутосомно-рецессивному типу, когда больные в семье появляются только в одном поколении. Схема такого наследования приведена на рисунке, на котором изображен фрагмент родословной семьи, в которой родился ребенок, больной муковисцидозом. На родословной мужчины обозначены квадратиком, а женщины — кружочком. Внутри этих квадратиков и кружочков нарисована только одна хромосома (из 23 пар, имеющихся у человека), несущая нормальный или мутантный ген муковисцидоза, который помечен черной точкой.
На рисунке для простоты изображена только хромосома, содержащая ген, мутации в котором вызывают муковисцидоз. У ребенка в обеих хромосомах содержится мутантный ген и поэтому он болен. У каждого из родителей мутантный ген содержится только в одной хромосоме, а вторая хромосома нормальная и поэтому они здоровы. Такие люди, которые имеют один нормальный и один дефектный ген называются носителями мутантного гена. У бабки по матери мутантный ген также имеется только в одной хромосоме, как и у деда со стороны отца. Они, как и родители ребенка, здоровы, но передали хромосомы, содержащие мутантный ген, своим детям. У вторых деда и бабки обе хромосомы содержат только нормальный ген. Таким образом, при рецессивном наследовании болен только тот член семьи, который получил от своих родителей обе хромосомы, несущие мутантный ген. Все остальные члены семьи здоровы, в том числе и те, кто является носителем мутантного гена. На схеме родословной видно, что у родителей больного ребенка могут еще появиться больные дети. Вероятность появления больного ребенка в семьях, в которых родители являются носителями мутантного гена, составляет 1/4 или 25%. Эта вероятность не меняется от числа больных или здоровых детей в семье: для каждого следующего ребенка риск, что он будет болен, составляет 25%. Вероятность рождения здорового ребенка, обе хромосомы которого содержат только нормальный ген, составляет также 25%. А 50% детей будут иметь один нормальный и один мутангный ген, как их родители. Это означает, что при каждой беременности родители-носители имеют шансы 3 из 4 (75%) родить здорового ребенка. Многие родители больных муковисцидозом детей и их родственники, первый раз встретившись с врачом-генетиком, настойчиво повторяют, что у их ребенка не наследственное заболевание, так как в их семье ни у кого из родственников никогда не было такого заболевания. Только объяснение, что правила наследования бывают разные, и не редко больной с наследственным заболеванием может быть единственным в семье, позволяют им понять с какой ситуацией они столкнулись.
КАКИЕ ПОРАЖЕНИЯ В ОРГАНИЗМЕ ВЫЗЫВАЕТ МУКОВИСЦИДОЗ?
Заболевание обычно начинается в раннем возрасте. Клиницисты различают три основные формы муковисцидоза: легочную, кишечную и смешанную. Самой частой из них является смешанная форма. Она встречается примерно у 80% больных муковисцидозом. Легочная форма муковисцидоза проявляется хроническим обструктивным бронхолегочным процессом. Из-за того, что мокрота у больных густая и вязкая, она не отхаркивается. Большое количество белка в мокроте делает ее хорошей средой для развития разных микробов, в том числе стафилококков и синегнойной палочки. Развивается хронический воспалительный процесс, приводящий к разрушению легочной ткани. Кровь больных плохо насыщается кислородом, из-за чего начинают страдать сердце, печень и другие . органы. Лечение больных с легочной формой муковисцидоза требует применения мощных антибиотиков в больших дозах. При кишечной форме муковисцидоза нарушается процесс переваривания пищи, так как ферменты поджелудочной железы, расщепляющие белки и жиры, не попадают в кишечник вследствие закупорки протоков железы. Больные отстают от своих родственников в росте и весе. Основное лечение кишечной формы заключается в приеме ферментов поджелудочной железы. Эффективность этого лечения легко контролируется по количеству жира в кале ребенка. Препараты поджелудочной железы должны даваться в таком количестве, чтобы жира в кале не было. При смешанной форме муковисцидоза кишечные проявления муковисцидоза усугубляют поражение легких. Лечение смешанной формы наиболее сложное. У больных муковисцидозом, не получающих необходимого лечения, продолжительность жизни, как правило, относительно короткая.
СУЩЕСТВУЮТ ЛИ ТЕСТЫ НА РАННЕЕ ВЫЯВЛЕНИЕ МУКОВИСЦИДОЗА?
Больные с муковисцидозом могут быть выявлены с помощью скрининга новорожденных. В отличие от других наследственных болезней, выявляемых при скрининге, при которых раннее выявление заболевания позволяет его настолько эффективно лечить, что можно вообще избежать каких-либо клинических проявлений заболеваний, скрининг новорожденных при муковисцидозе преследует несколько иную цель. Врачи считают, что если муковисцидоз выявляется у новорожденного, и его начинают сразу же лечить, то ребенок нормально развивается физически и умственно. У него в меньшей степени будут поражаться легкие и другие органы, увеличится продолжительность жизни, которая в настоящее время, благодаря адекватному лечению, составляет в развитых странах более 35 лет. Скрининг на муковисцидоз начинается с того, что у новорожденного в родильном доме перед выпиской берут из пятки несколько капель крови, которую наносят на специально для этой цели используемую фильтровальную бумагу. Кровь высушивается, и такой бланк, на котором указана фамилия новорожденного и ряд других сведений, необходимых для его идентификации, переправляется в лабораторию региональной медико-генетической консультации. В лаборатории проводят специальное исследование, которое позволяет выявить новорожденных, у которых есть подозрение на муковисцидоз. В этом случае ребенок через педиатра вызывается в лабораторию на повторноетестирование. Родителям педиатр сообщает, что первый тест на муковисцидоз у их ребенка оказался ненормальным. У них появляется повод для беспокойства. Поэтому повторное тестирование образца крови у младенца, которое является очень важным, нужно сделать как можно быстрее. В большинстве случаев при повторном исследовании тест на муковисцидоз оказывается нормальным. Это означает, что результат первого исследования был неверный (его называют ложноположительным). Причины этого могут быть разными и связанными как с состоянием младенца, так и с какой-то ошибкой лаборатории. Этот результат, свидетельствующий о том, что у ребенка нет муковисцидоза, сразу же сообщается родителям, чтобы снять с них чувство страха.
ЧТО ДЕЛАТЬ, ЕСЛИ И ПОВТОРНЫЙ ЛАБОРАТОРНЫЙ ТЕСТ НА МУКОВИСЦИДОЗ ОКАЗАЛСЯ ПОЛОЖИТЕЛЬНЫМ?
Если и второе лабораторное исследование для выявления муковисцидоза оказалось положительным, то, в отличие от других скринируемых наследственных болезней, это еще не означает, что у ребенка есть муковисцидоз, хотя вероятность такого диагноза является высокой. Семья, в которой у ребенка повторно подтвердился положительный тест на муковисцидоз, приглашается на прием к врачу-генетику в медико-генетическую консультацию. Здесь семье объясняют, что собой представляет муковисцидоз и организуют прием у клиницистов, являющихся специалистами в диагностике и лечении муковисцидоза. Теперь наблюдение за ребенком берет на себя группа клиницистов. Для подтверждения диагноза муковисцидоза младенцу проводят так называемый лотовый тест. Это совершенно безобидный и безболезненный тест можно провести младенцу, начиная с возраста 3-4 недели жизни. Если лотовый тест оказывается отрицательным, то ребенок считается здоровым, хотя за ним клиницисты еще будут наблюдать некоторое время. Если же потовый тест оказался положительным, то диагноз муковисцидоза считается установленным, даже до появления каких-либо клинических проявлений заболевания. В этом случае врачи назначат ребенку лечение, которое надо будет строго соблюдать. Ребенок будет периодически обследоваться группой специалистов для постоянного контроля за состоянием его здоровья.
МОЖНО ЛИ ПОМОЧЬ СЕМЬЕ, В КОТОРОЙ ПОЯВИЛСЯ БОЛЬНОЙ С МУКОВИСЦИДОЗОМ, ИМЕТЬ ЗДОРОВЫХ ДЕТЕЙ?
Да, и довольно успешно. Для муковисцидоза возможна дородовая диагностика. Первым шагом в этом направлении является обращение в медико-генетическую консультацию, где врач-генетик определяет показания и возможные методические подходы к дородовой диагностике в каждом конкретном случае. Сама процедура заключается в том, что во время беременности в сроке 9-11 недель или 16-18 недель врач акушер-гинеколог проводит забор очень небольшого количества клеток плода и направляет этот материал в специальную лабораторию пренатальной диагностики. В этой лаборатории врачи лаборанты-генетики проводят молекулярную диагностику, т.е. определяют наличие или отсутствие мутации в гене, отвечающем за муковисцидоз. В случае положительного результата семья решает вопрос о прерывании беременности больным плодом или настраивается на появление еще одного больного ребенка. Это право выбора остается за семьей.
Л. Грачева
L. Gracheva
Кистозный фиброз
(муковисцидоз) — тяжелое
аутосомно-рецессивное
генетическое заболевание, наиболее
распространенное среди населения
Кавказа, характеризующееся высокой
заболеваемостью и существенным
сокращением продолжительности
жизни больных. В отсутствие
эффективной терапии на первый план
выходит предупреждение рождения
больных детей. В антенатальной
клинике используются два варианта
дородового скрининга:
двухступенчатый и парный. В первом
случае сначала обследуют женщину, а
ее партнера — только в том случае,
если женщина оказывается
носительницей патологического
гена. Во втором варианте обследуют
обоих партнеров одновременно.
Однако в большинстве случаев в
обследовании нуждается только один
из партнеров, так как отрицательный
результат обследования одного
означает отсутствие высокого риска
для пары. Несмотря на широкое
применение скрининговых программ,
еще не совсем ясно, какова частота
выявления патологии и каковы
должны быть действия родителей,
имеющих высокий — 1 : 4 — риск рождения
больного ребенка. Анализ 5-летнего —
начиная с 1992 г. — опыта скрининга на
кистозный фиброз 25 000 пар показал,
что частота выявляемости была
сходной при обеих моделях
скрининга и составляла около 70%; она
не зависела от того, осуществлялся
ли скрининг в исследовательских
или же рутинных практических целях.
У 20 (91%) из 22 пар с установленным
риском 1 : 4 была проведена
пренатальная диагностика. 4 пары
возвращались для мониторирования
второй и 2 — третьей беременности. Во
всех 8 случаях, когда было
идентифицировано пораженние плода,
беременность была прервана.
Хотя оценивать успех скрининга
числом выявленных пораженных
кистозным фиброзом плодов
неэтично, не следует игнорироватьи
этот аспект. Программы, нацеленные
на выявление гетерозиготных по
кистозному фиброзу пациентов, дают
низкую выявляемость и прекращаются
после иссякания исследовательских
фондов. Возможно, это связано с
неправильной постановкой целей. У
всех здоровых людей имеются
мутантные гены в единичных копиях.
Большинство людей не хотят ничего
знать о своем генотипе, кроме как в
связи с реализацией репродуктивной
функции, когда состояние
носительства у партнеров
становится важным. С учетом этого
обстоятельства представляется
более правильным проводить
скрининг на аутосомно-рецессивные
заболевания парным методом, причем
разумнее и экономичнее всего
делать это во время беременности.
Литература:
Brock DJ. Prenatal screening for cystic fibrosis: 5
years’experience reviewed. Lancet 1996;347:148-50.
МУКОВИСЦИДОЗ: Проблемы и пути их решения.

Муковисцидоз (МВ) — моногенное, аутосомно-рецессивное генетическое заболевание, характеризующееся поражением экзокринных желез жизненно важных органов и имеющее обычно тяжелое течение и прогноз. Муковисцидоз является важной медико-социальной проблемой. Раньше это была проблема педиатров, в настоящее время все большее число специалистов разного профиля вовлекается в ее решение. Если в 50-годах более 60% больных МВ умирало в возрасте до 1 года, то в настоящее время более 50% наблюдаемых в США больных МВ старше 18 лет[1]. По данным J.Dodge [2] прогностичекая выживаемость больных, рожденных по неонатальному скринингу 50 лет и старше.
С 2011 года специалистами Российского детского (научно-клинического отдела муковисцидоза ФГБНУ Медико-генетического научного центра) и взрослого (лаборатория муковисцидоза ФГБНУ НИИ пульмонологии ФМБА России) центров муковисцидоза был создан и интегрирован в Европейский, регистр пациентов с муковисцидозом РФ. По данным анализа регистра за 2014 год, медина выживаемости московских пациентов составила 39,7 лет, что соответствует ведущим европейским и американским центрам. К сожалению, общие данные по выживаемости российских пациентов в стране низкие, что обусловлено рядом имеющихся проблем.
Распространенность МВ варьирует в зависимости от популяции. В большинстве стран Европы и Северной Америки МВ она колеблется от 1:2000 до 1:5000 новорожденных. Расчетные данные, полученные в Медико-генетическом научном центре и в Минздравсоцразвития РФ (неонатальный скрининг), свидетельствуют о более низкой частоте МВ в России — 1:8000-12000 новорожденных. Большую роль в улучшении помощи больным МВ внесли как организация в нашей стране специализированных Российского детского (дата организации — 1990г) , взрослого (организован в 1992г) и региональных центров по диагностике (в том числе пренатальной), лечению и реабилитации больных муковисцидозом, включение муковисцидоза с 2006-2007 г в программу неонатального скрининга (приказ Минздравсоцразвития России от 22 марта 2006 г. N 185 «О массовом обследовании новорожденных детей на наследственные заболевания»), так же действующие Приказы Минздравсоцразвития по ряду льгот для инвалидов детства, больных МВ. Разработаны стандарты лечения и наблюдения пациентов с МВ. Обеспечение больных МВ лекарственными препаратами осуществляется по программе «7 нозологий» по Распоряжению Правительства РФ (от 2 октября 2007г. № 1328-р), которая, в настоящее время предусматривает только один препарат – дорназа альфа и из средств региональных бюджетов (ферменты, ингаляционные препараты, антибактериальные лекарственные средства и др)[3].
На активном диспансерном наблюдении в Российском детском и взрослом центрах, выполняющих роль межрегиональных, находится около 900 больных МВ, из них 44% старше 18 лет.
В центре апробируются и успешно применяются новейшие медицинские препараты, современные лечебно-реабилитационные режимы и технологии, которые позволяют подавляющему большинству больных вести полноценный образ жизни. Однако существующие проблемы зачастую препятствуют эффективной диагностике, наблюдению и лечению таких пациентов. Все проблемы делятся на три большие группы – проблемы диагностики, лекарственного обеспечения и организации команды врачей и условий для оказания профессиональной медицинской помощи.
Проблемы в диагностике муковисцидоза
Неонатальный скрининг.
С 2006 г. в ряде регионов, а с первого января 2007 г. во всех субъектах Российской Федерации (РФ) МВ был включен в перечень наследственных заболеваний, подлежащих обязательному неонатальному скринингу в рамках национального приоритетного проекта «Здоровье». В настоящее время в нашей стране скрининг проводится в 4 этапа (табл.1).
Таблица 1. Этапы неонатального скрининга в РФ
| I ЭТАП | На 3-4 день у доношенного (7-8 – у недоношенного) определение ИРТ 1 в высушенной капле крови |
| II ЭТАП | При положительном результате (более 70 нг/мл) на 21-28 день — повторный тест — ИРТ 2 |
| III ЭТАП | При положительном результате ИРТ 2 (более 40 нг/мл) — потовая проба |
| IV ЭТАП | При пограничном результате потовой пробы — ДНК-диагностика |
I. Проблемы при диагностике МВ по неонатальному скринигну :
1. Отказ родителей от проведения дообследования ребенка, при положительных данных неонатального скрининга
В Москве за период с 2006 г. по октябрь 2010 г. по программе неонатального скрининга было обследовано 552 342 новорожденных. Из них гипертрипсиногенемия после 2 этапа скрининга (повышение ИРТ 2) сохранялась у 905 (16,9%). Все семьи, согласно протоколу скрининга, были приглашены в московский центр МВ для дальнейшего обследования. Однако, на проведение потовой пробы явилось только 645 (71%) семей. В 29% случаев родители по тем или иным причинам отказались от дальнейшего обследования.
2. Не соблюдение сроков проведения неонатального скринига и техники.
За период с 2006 г по 2010г в Москве было выявлено по программе скрининга 54 пациента и 4 пациента с «ложноотрицательными» данными ИРТ. Вывод: имеют место нарушение техники проведения скрининга и его сроков. Вероятно, недостаточная информированность медицинского персонала поликлиник могут влиять на качество проводимой диагностики муковисцидоза.
3. Отсутствие расходных материалов для скрининга и потового теста
Специалисты из региональных центров неонатального скрининга, на мероприятиях организуемых Российским центром МВ, отмечают нерегулярное обеспечение дорогостоящими расходными материалами для проведения скрининга и потовых проб.
4 . Не верная интерпретация данных скрининга, в связи с результатами ДНК диагностики.
Одна из наиболее частых причин гиподиагностики. Например, скрининг у пациента положительный, потовая проба положительная или пограничные значения, мутаций при ДНК диагностике гена CFTR не обнаружено или обнаружена только одна, диагноз не подтверждают, что в корне не верно. Пациенты с гипертрипсиногенемией не должны быть сняты с наблюдения в профильном центре до 1 года. Положительные данные скрининга (даже при отрицательном потовом тесте и отсутствии наиболее частых мутаций при ДНК-диагностике) являются показанием для диспансерного наблюдения в течение года жизни, повторной консультации и потовой пробы в возрасте 1 года. В настоящее время, благодаря совершенствованию генетической диагностики и расширению знаний о муковисцидозе, выявлены мутации, частично сохраняющие работу хлорного канала и соответственно приводящие к отрицательным результатам потового теста, как например 3849+10kbC>T
Не обнаружение мутаций при стандартной ДНК-диагностике не дает право исключить у пациента муковисцидоз. В настоящий момент известно более 2000 мутаций в гене CFTR. Стандартная панель ДНК диагностики для поиска мутаций гена CFTR в различных региональных центрах охватывает от 8 до 35 наиболее частых мутаций, составляющих около 75% встречающихся в данной популяции, что не позволяет ориентироваться на данный метод, как на основной в постановке диагноза. В то же время, обнаружение 2 мутантных аллелей достоверно подтверждает муковисицидоз, даже при отсутствии или отрицательных данных скрининга и потового теста. В сомнительных случаях в диагностике муковисицидоза используют полногеномное секвенирование гена CFTR.
Проведение ДНК-диагностики за счет средств семьи пациента
ДНК-диагностика является очень важной в анализе возможных рисков и осложнений у пациента, применении у больных с определенными кассами мутаций разработанной в настоящее время патогенетической терапии заболевания. Вместе с тем, ДНК-диагностика является дорогостоящим обследованием и не каждая семья или пациент может оплатить его стоимость. Проведение дорогостоящего секвенирования гена при отсутствии мутаций у пациента с сомнительной клинической картиной заболевания, позволит правильно поставить диагноз или снять его при отрицательных данных полногеномного генетического секвенирования. Важность ДНК диагностики также определяется необходимостью проведения пренатальной диагностики в семье, где есть уже ребенок с муковисицидозом у родителей-носителей дефектного гена для определения наличия мутаций у плода и принятия решения о вынашивании беременности родителями.
II. Нарушение техники проведения потовой пробы
Ложные результаты потового теста выполненного как классическим методом по Гиббсону-Куку, так и анализе проводимости на аппаратах Нанодакт, Макродакт возможны при нарушении техники проведения обследования и недостаточном опыте лаборатории. Перед исследованием необходимо тщательно очистить и обезжирить кожу пациента в месте забора потовой жидкости. Помнить, что при ряде состояний потовый тест может давать ложноположительные или ложноотрицательные значения, поэтому приоритетно проводить данные исследования в профильных центрах, а при сомнительных данных отправлять на консультацию к специалистам Российского центра муковисицидоза, имеющих многолетний опыт в диагностике заболевания.
III. Диагностика групп риска
В связи с расширением знаний о муковисицидозе, специалисты центров муковисцидоза стали выявлять пациентов с мягким или моносимптомным течением заболевания, а также диагносцировать заболевание у взрослых больных. Поскольку проявления муковисицидоза многогранны, такие пациенты могут длительное время наблюдаться врачами различных специальностей с другими диагнозами. Крайне важна информированность специалистов «на местах» о группах риска для диагностики на муковисицидоз (синдром мальабсорбции, полипоз, мекониальный илеус, бронхоэктазы, сахарный диабет у пациентов с бронхолегочными заболеваниями, цирроз печени, и тд).
Пути решения проблем с диагностикой муковисцидоза.
1. Информирование о заболевании врачей и специалистов среднего звена поликлиник, пульмонологов, гастроэнтерологов, репродуктологов, гепатологов, трансплантологов, оториноларингологов о возможных группах риска и алгоритме диагностики заболевания.
2. Обучение врачей центров МВ или оказывающих помощь больным МВ на специализированных циклах (например, цикл ТУ, проводимый сотрудниками ФГБНУ «МГНЦ» и ФГБОУ «Сиб ГМУ»).
3. Введение в обязательную программу аккредитации врачей специализированных центров неонатальной диагностики сертификации по неонатальному скринингу и диагностике муковисицидоза на базе ФГБНУ «МГНЦ».
4. Необходимость раннего выявления МВ возможно при соблюдении протоколов неонатального скрининга, техники проведения потовых тестов, своевременной диагностики пациентов из групп риска.
5. Необходимо финансирование из федерального бюджета закупки оборудования и расходных материалов для проведения потовых тестов детям с гипертрипсиногенемией, выявленным по программе неонатального скрининга, а так же организация своевременной закупки расходных материалов для неонатального скрининга.
6. Информирование населения о необходимости проведения неонатального скрининга новорожденным детям и при положительных результатах, важности своевременного дообследования в условиях специализированных центров.
7. Специалисты, занимающиеся диагностикой МВ должны учитывать, что не выявление мутаций при стандартной ДНК-диагностике не может являться основанием для исключения заболевания у пациента.
8. Проведение ДНК-диагностики у выявленных по скринингу или клинической картине пациентов за счет средств регионального бюджета, та как своевременная ДНК диагностика позволит более эффективно проводить патогенетическое лечение пациентов, информирование родителей и родственников пациента о риске повторного рождения ребенка с МВ позволяет профилактировать заболевание.
Проблемы перекрестного инфицирования пациентов
За последние 20 лет теория перекрестного инфицирования среди больных МВ была доказана [4] Наиболее распространенными возбудителями заболеваний дыхательного тракта при МВ являются: Staphilococcus aureus, Haemophilus influenzae, Pseudomonas aeruginosa. Все большее значение, в последнее время, приобретают Burkholderia cepacia, Stenotrophomonas maltophilia, Achromobacter xylosoxidans, Aspergillus spp., нетуберкулезные микобактерии, грибы, MRSA. Ряд патогенов, не представляющих опасности для здоровых людей, для пациентов с МВ могут быть фатальными и способствовать быстрому регрессу функции легких. Так, например, мерам строгой контактной изоляции подлежат пациенты, имеющие в мокроте Burkholderia cepacia, MRSA, полирезистентные штаммы Pseudomonas aeruginosa, нетуберкулезные микобактерии. Из-за экономической составляющей и существующих тарифов ОМС, распространенные в мировой практике стандарты амбулаторного наблюдения и домашнего стационара для пациентов с МВ в России не выполняются, хотя являются более экономически целесообразными. Пациенты, выявленные по неонатальному скринингу зачастую госпитализируются в стационар для дообследования и назначения лечения. Такая практика подвергает высокому риску перекрестного инфицирования новорожденного серьезной патогенной микрофлорой, к которой пациенты предрасположены. Пациенты госпитализируются для планового обследования, проведения ингаляционной антибактериальной терапии. Причем, только единичные стационары имеют одноместные палаты с необходимым санузлом и раковиной для больных с МВ. Существует распространенная ошибка, что пациенты с однородной инфекцией, например синегнойной, могут госпитализироваться в одну палату. В то время, как фенотипы Pseudomonas aeruginosa могут быть разными, и пациенты заражают друг друга.
Более 20-ти лет существования Российского центра МВ (московского отделения) происходило переориентирование его работы на амбулаторное наблюдение, обследование и лечение пациентов [5]. Все это привело к значительному изменению состояния больных, минимализации рисков инфицирования пациентов фатальной микрофлорой и соответственно к значительному увеличению медианы и качества жизни таких больных [6]. Тем не менее, правила жесткого контроля за эпидемиологической обстановкой в центрах муковисицидоза, отказа от необоснованных госпитализаций и переориентирования на амбулаторное наблюдение не исключают строгого соблюдения правил по профилактике перекресного инфицирования в условиях поликлиники, а также информирования родителей о возможных рисках вне медицинских учреждений. Работа зарубежных центров МВ ориентирована на амбулаторную помощь и организацию профилактики перекрестного инфицирования, в том числе по времени посещения пациентов с различной инфекцией и четкой организации обработки помещения, оборудования, рук персонала и пациентов, использования масок.
Адекватный контроль за микробной флорой и профилактика перекрестного инфицирования не возможны без регулярного микробиологического мониторинга пациентов, который проводится 1 раз в 1 —3 месяца . К сожалению, возникает ряд проблем в идентификации микроорганизмов и организации работы лабораторий:
- Микроорганизмы (S.aureus, P.aeruginosa и др.) при хронической персистенции могут менять свой фенотип. Их становится сложно распознать в лабораториях, не специализирующихся на микробиологических анализах при МВ.
- Местные условия среды могут приводить к образованию гипермутабельных штаммов с высокой вариабельностью генотипических и фенотипических черт, включая резистентность к а/б препаратам. У одного пациента могут высеваться до 4-5 микроорганизмов.
- Отсутствие необходимых для идентификации специфических микроорганизмов дорогостоящих питательных сред и реактивов для широкого спектра антибиотиков при определении чувствительности, а так же короткое время посева (например, 3 дня) в региональных лабораториях, делает данную диагностику бесполезной.
- Ранняя диагностика инфекции бронхиального дерева затрудняется трудностью забора мокроты у новорожденных и детей раннего возраста.
Пути решения проблем, связанных с перекрестным инфицированием пациентов.
1. Госпитализации в стационар пациентов с муковисцидозом должна осуществляться только по жизненным показаниям.
2. Внедрение в практику региональных центров активного амбулаторного наблюдения и практики домашнего стационара.
3. Внесение поправки в Федеральный закон Российской Федерации от 21 ноября 2011 г. N 323-ФЗ статью 34 п.2 «Специализированная медицинская помощь оказывается в стационарных условиях и в условиях дневного стационара» специализированной помощи в амбулаторных условиях.
4. Перераспределение объемов медицинской помощи с ресурсоемкой и дорогостоящей стационарной на догоспитальные стационарозамещающие технологии, оптимизация медицинской помощи в домашних условиях, которые являются более экономически целесообразными и позволяют значительно снизить возможности перекрестного инфицирования данной категории больных.
5. Строгий микробиологический мониторинг, с учетом особенностей диагностики инфекций у больных муковисцидозом
6. Обучение специалистов и оснащение профильных микробиологических лабораторий, поскольку не идентифицированные патогены могут представлять опасность не только для пацеинтов с муковисицидозом, но и для иммуносупрессивных больных, а также для пациентов с тяжелой патологией.
7. Строгое соблюдение во всех специализированных центрах и стационарах правил по профилактике перекресного инфицирования пациентов
8. Разделение амбулаторного приема пациентов по высеваемой флоре (начало недели — S.aureus, H.influenzae, с условно-патогенной микрофлорой, конец недели — P.aeruginosa, пациентов с B.cepacia, MRSA, НТМБ принимать в отдельных помещениях и принимать меры по контактной изоляции при госпитализации в стационар).
9. Использовать в специализированных центрах одноразовые маски для пациентов, бесконтактные диспенсеры с антибактериальным средством перед кабинетами для приема, одноразовые халаты и пеленки для осмотра.
10. Обрабатывать руки, пульсоксиметр, фонендоскоп, другое оборудование антибактериальным раствором после осмотра пациента, проводить влажную дезинфекцию поверхностей и проветривать кабинет после каждого пациента.
11. Использовать современные системы обеззараживания воздуха в помещении
12. При исследовании функции внешнего дыхания обязательным является использование одноразовых антибактриальных фильтров для спирометра.
13. Госпитализировать пациентов в индивидуальные боксы, больным с МВ не разрешается посещать игровые комнаты, туалеты, ванную и столовую в отделении.
14. Ингаляционное оборудование и дыхательные тренажеры могут быть только индивидуального пользования.
Проблемы лекарственного обеспечения
1. Необходимо изменить тактику обеспечения лекарственными средствами только после госпитализации в стационар или оформления инвалидности на практику раннего назначения стандартной терапии заболевания
В ряде регионов лекарственное обеспечение новорожденных пациентов, выявленных по программе скрининга, начинают только после госпитализации в стационар или оформления инвалидности. Если состояние ребенка не является жизнеугрожающим (мекониальный илеус, дыхательная недостаточность, синдром псевдо-Барттера или др), необходимое обследование рекомендуется проводить в амбулаторных условиях. Лекарственное обеспечение, особенно ферментную терапию, необходимо назначать как можно скорее, с учетом данных копрологии и клинической картины, степени выраженности панкреатической недостаточности, поскольку нутритивный статус пациентов напрямую коррелирует с проводимой заместительной терапией панкреатическими ферментами и определяет состояние бронхолегочной системы. А не своевременное назначение ингаляционной муколитической терапии при респираторных проявлениях, может приводить к ранней манифестации поражения дыхательной системы.
2. Отсутствие своевременного и адекватного лечения жизнеугрожающих инфекций
При первичном инфицировании пациента такими фатальными микробами, как P.aeruginosa, B.cepacia, MRSA, НТМБ и проведении своевременной высокоэффективной терапии возможно добиться эффективной эрадикации патогена. В то же время, при длительном отсутствии жизненно важного лекарственного препарата( более 2 недель) риск хронической колонизации и необходимости постоянного применения дорогостоящих лекарственных средств возрастает в разы. Например, лечение пациента с хронической колонизацией золотистого стафилококка ограничивается, как правило, пероральным применением антибактериальных препаратов во время обострения заболевания и по приблизительным рассчетам затраты на антибиотики составляют около 5 тыс рублей в год. Больному с хронической колонизацией синегнойной палочки требуется постоянная ингаляционная противосинегнойная терапия и ежеквартальные профилактические курсы внутривенной антибактериальной терапии 2-3 противосинегнойными препаратами, что при рассчете в год составляет около 1,5 млн рублей на пациента. Препараты для эрадикации первичного инфицирования синегнойной палочкой (ингалиционные антибиотики – тобрамицин и колиместат натрия) применяются в течение 1 – 3 месяцев. Так, затраты на терапи. Брамитобом (Chiesi, Италия) составляют не более 100 тыс рублей. Таким образом, своевременная терапия первого высева синегнойной палочки экономически более выгодна. Для лечения B.cepacia может применяться неприрывная антибактериальная терапия 3-4 дорогостоящими антибиотиками, что увеличивает стоимость лечения в разы, даже по сравнению с пациентами с хронической синегнойной инфекцией. Замена антибактериальных препаратов дженериками, которые по стоимости от оригинальных отличаются незначительно, но,к сожалению, часто не эффективны и дают большое количество побочных эффектов.
Замена жизненно важных препаратов на дженерики, не проходившие клинические исследования и на препараты, доказавшие свою неэффективность у пациентов с муковисцидозом
Пациенты с МВ получают лекарственную политерапию в течение всей жизни, что обуславливает необходимость назначения препаратов только с доказанной клинической эффективностью и безопасностью. К сожалению, часто биодоступность и эффективность закупаемых дженериков не соответствует должной. Например, препарат для пожизненой заместительной терапии панкреатичесой недостаточности Микразим, представляющий собой микрогранулированный панкреатин, был исследован еще в 2007-2008гг в Российском центре муковисицидоза (Москва) совместно с 6 региональными центрами (Саранск, Оренбург, Казань, Саратов, Волгоград, Астрахань)[7]. Полученные результаты показали, что препарат Микразим обладает высокой частотой (26%) серьезных побочных явлений со стороны желудочно-кишечного тракта, потребовавших его отмены, и отсутствием эффективности еще у 14% пациентов. Учитывая выше изложенные данные препарат не может быть рекомендован пациентам с муковисицидозом. Тем не менее, в рамках программы бесплатного лекарственного обеспечения, препарат централизовано закупается в регинах РФ, в том числе и для московских больных. Ежемесячно врачи центра регистрируют нежелательные побочные явления (НПЯ) при использовании Микрозима.
Пример эффективного и безопасного дженерика представляет ингаляционный раствор тобрамицина — Брамитоб (Италия), являющийся копией препарата Тоби (Швейцария). Раствор Брамитоба участвовал в многочисленных международных мультицентровых плацебо-контролируемых клинических исследованиях у данного контингента больных, подтвердивших его эффективность и безопасность [8]. Эти исследования позволяют рекомендовать данный дженерик пациентам с муковисицидозом, в отличие от часто закупаемого раствора тобрамицина для ингаляций «Тобрамицин-Гобби». В настоящий момент говорить о клинической эффективности и безопасности препарата не представляется возможным. Упоминания о его безопасности и эффективности у больных муковисцидозом нет ни в одном научном зарубежном источнике. Препарат «Тобрамицин – Гобби» не получал одобрение регуляторных органов США и Европейского Союза и не прошел необходимых клинических исследований по оценке его безопасности и эффективности при МВ. Имеются данные об отсутствии эффекта данного препарата и НПЯ у пациентов с муковисцидозом в ряде регионов России.
Пути решения проблем, связанных с лекарственным обеспечением
1. Информирование профильных специалистов о необходимости назначения лекарственной терапии в максимально короткие после постановки диагноза сроки.
2. Назначение терапии согласно протоколам и стандартам ведения больных муковисцидозом
3. Исключить госпитализацию пациентов для проведения курсов ингаляционной антибактериальной терапии.
4. Своевременное обеспечение эффективными антибактериальными препаратами , доказавшими свою терапевтическую активность и безопасность у пациентов с муковисцидозом с первичным инфицированием P.aeruginosa, B.cepacia, MRSA, НТМБ
5. Возможность назначения препаратов по торговому наименованию пациентам с муковисицидозом, с учетом отсутствия у большинства дженериков данных о доказанной терапевтической эквивалентности и биодоступности (ФЗ от 12.04.2010 N 61-ФЗ (ред. от 29.12.2015) «Об обращении лекарственных средств»12.3)
6. При наличии медицинских показаний (индивидуальная непереносимость, по жизненным показаниям) по решению врачебной комиссии медицинской организации осуществляется назначение и выписывание лекарственных препаратов по торговым наименованиям (пункт 3 приложения N1 к приказу Минздрава России от 20 декабря 2012 г. N 1175н). Упростить процедуру принятия решений, которая составляет от 3-6 месяцев.
7. Соблюдение права пациента на получение качественных, безопасных и доступных лекарственных препаратов согласно статье 18 п.2 ФЗ от 21.11.2011 N 323-ФЗ (ред. от 29.12.2015) «Об основах охраны здоровья граждан в Российской Федерации».
Проблемы со подготовкой специалистов для оказания помощи больным МВ
Согласно международным согласительным документам [9] при организации специализированных центров муковисицидоза и протоколам ведения больных, в каждом центре штат сотрудников, должен включать кинезитерапевта, диетолога, психолога. Кинезитерапия является основополагающим методом лечения заболевания, не возможно обеспечить пациенту эффективную эрадикацию патогенов и сохранить легочную функцию без адекватного выведения мокроты. На практике, во многих центрах муковисцидоза специалисты, обладающие достаточными знаниями по данной патологии отсутствуют. Такая же проблема возникает и с врачами диетологами. Энергетическая потребность у пациентов с муковисцидозом составляет 150% от возрастной нормы, имеются особенности по введению прикорма, количеству потребляемой белковой нагрузки, пищевому поведению при развитии сахарного диабета (в отличие от остальных пациентов, у пациентов с МВ-зависимым сахарным диабетом углеводы не ограничиваются). Психологическая поддержка крайне важна для семей при постановке и принятии диагноза, в подростковом возрасте, в сложные для пациентов и их родителей периоды.
Пути решения организации помощи больным муковисицидозом в специализированных центрах
1. Организовывая специализированные центры муковисцидоза как самостоятельную единицу или на базе отделения стационара или КДЦ, необходимо исходить из рекомендаций Европейского общества [9]. Для 50 больных и более необходимо создание специализированного центра. Акцент делать на организации амбулаторной помощи. Подразделения стационара выполняют консультативно – диагностическую и лечебную помощь.
2. Штат сотрудников центра включает: пульмонолога, врача функциональной диагностики, кинезитерапевта, диетолога, психолога, должны быть организованы консультации гастроэнтеролога, лор – врача, эндокринолога, вакцинолога, аллерголога, трансплантолога и др.
3. Должна быть организована школа для пациентов и их семей.
Пути решения проблем, связанных с отсутствием центра МВ
1.При отсутствии центра МВ должны быть назначены пульмонолог, гастроэнтеролог и диетолог, осуществляющие помощь больным МВ, которые направляются на специализированное обучение.
2. Каждый пациент должен быть информирован о необходимости ежедневного дренажа мокроты после ингаляции муколитиков методами кинезитерапии (включая применение дыхательных тренажеров и аппаратных методик), особенностях диеты и ферментной терапии, питьевого режима, приема соли для профилактики синдрома Псевдо – Баттера.
3. Семьи больных должны быть проинформированы о сайтах с достоверной информацией, должны быть организованы горячие линии для получения ответа на многочисленные вопросы.
Остановимся на двух общих актуальных проблемах оказания помощи больным МВ. Общей проблемой для пациентов РФ является обеспечение жизненно важными медицинскими изделиями (ингалятор, дыхательные тренажеры, аппараты для бронхолегочного дренажа) и лечебным питанием, не входящих в стандарт медицинской помощи. Решение данной проблемы возможно при наличии медицинских показаний по решению врачебной комиссии (статья 37 п.5 ФЗ от 21.11.2011 N 323-ФЗ (ред. от 29.12.2015) «Об основах охраны здоровья граждан в Российской Федерации»).
Не организована психологическая поддержка пациентов с МВ, их семей. Решить эту проблему частично может создание возможности контакта между пациентами и их семьями за счет создания и развития интернет-площадки для общения с привлечением профильных специалистов медиков и психологов, а так же посредством «горячей линии».
Спектр существующих в настоящее время проблем у пациентов с муковисицидозом многогранен, но при своевременном их решении, возможно значительно увеличить продолжительность и качество жизни пациентов, осуществлять методы профилактики заболеваемости в стране и значительно сократить затраты на лечение и реабилитацию данной категории больных.
Список литературы:
1. Cystic Fibrosis Foundation Patient Registry 2014 Annual Data Report
2. Dodge, J.A., Lewis, P.A., Stanton, M., and Wilsher, J. «Cystic fibrosis mortality and survival in the UK: 1947–2003». Eur Respir. 2007; 29: 522–526
3. Капранов Н.И., Каширская Н.Ю. Монография «Муковисцидоз» Медпрактика 2014г
4. Infection Control Guidance for Patients with Cystic Fibrosis Ratified by Infection Control & Decontamination Assurance Group: 8th April 2014
5. Блистинова З.А. «Клиническое значение стационарозамещающих технологий при лечении реабилитации и медико-социальной адаптации больных муковисцидозом» диссертация кандидата медицинских наук,Москва, 2002г
6. «Регистр больных муковисицидозом в Российской Федерации.2013г» ИД «Медпрактика-М»,2015,64с
7.Данные о результатах исследования http://mukoviscidoz.org/docs.html
8. Chuchalin A, Kapranov N et al, Pediatr Drugs 2007; 9 Suppl. 1: 21
9. Smyth AR1, Bell SC2, Bojcin S3, Bryon M4, Duff A5, Flume P6, Kashirskaya N7, Munck A8, Ratjen F9, Schwarzenberg SJ10, Sermet-Gaudelus I11, Southern KW12, Taccetti G13, Ullrich G14, Wolfe S15; «European Cystic Fibrosis Society. European Cystic Fibrosis Society Standards of Care: Best Practice guidelines», J Cyst Fibros. 2014 May;13 Suppl 1:S23-42. doi: 10.1016/j.jcf.2014.03.010.
10.21518/2079-701X-2017-18-124-128
В.Д. ШЕРМАН 1 2, к.м.н., Е.И. КОНДРАТЬЕВА 1 2, д.м.н., профессор, А.Ю. ВОРОНКОВА 1 2, к.м.н., Н.Ю. КАШИРСКАЯ 1 д.м.н., профессор, Л.А. ШАБАЛОВА 1 2, к.м.н., В.С. НИКОНОВА 1 2, к.м.н., Е.К.ЖЕКАЙТЕ 1 2, С.И. КУЦЕВ 1 д.м.н., профессор, чл.-корр. РАН
1 Медико-генетический научный центр, Москва
2 Московский областной консультативно-диагностический научный центр для детей, Москва
ВЛИЯНИЕ НЕОНАТАЛЬНОГО СКРИНИНГА НА ТЕЧЕНИЕ МУКОВИСЦИДОЗА
НА ПРИМЕРЕ ГРУППЫ ПАЦИЕНТОВ МОСКОВСКОГО РЕГИОНА
Цель исследования: сравнительная оценка клинического статуса пациентов с муковисцидозом (МВ) 6-9 лет диагноз которым был установлен до начала неонатального скрининга (НС) на МВ в Московском регионе и в аналогичной возрастной группе с момента начала НС по данным регистра 2012 и 2015 гг.
Пациенты и методы. Пациенты были разделены на 2 группы: I — 45 детей 6-9 лет диагностированных до начала НС II — 86 детей 6-9 лет выявленных после начала НС.
Результаты. При сравнительной оценке возраста установки диагноза получено достоверное различие между I и II группами. Средний возраст установления диагноза в группе I составил 2^29 (±2^29) года^ в группе II средний возраст установления диагноза — 0^66 (± 1Д3) года (p = 0^0000). По данным микробиологического статуса группа пациентов^ диагностированных по программе НС (группа !!)• достоверно реже имела хроническое инфицирование дыхательных путей Ps. aeruginosa (37J8% пациентов в группе I против 14Д0% в группе II) (р = 0^0026). В группе больных^ выявленных по программе скрининга новорожденных (группа !!)• отмечено статистически значимое уменьшение объема проводимой внутривенной (р = 0^0000) и ингаляционной антибактериальной терапии (р = 0^0139) и снижение по сравнению с группой I числа пациентов^ принимающих бронхолитики (р = 0^0322).
Заключение. Продемонстрировано положительное влияние неонатального скрининга на МВ на возраст установки диагноза и ряд важных показателей течения заболевания. Ключевые слова: муковисцидоз, неонатальный скрининг, потовая проба.
V.D. SHERMAN4 PhD in medicine^ E.I. ^DRAT^A1^ MD^ Prof.^ A^^ON^A1^ PhD in medicine^
N.Y. KASHIRSKAYA1 MD^ ProfM L.A. SHABALOVA1^ PhD in medicine^ V.S. ^^NOVA1^ PhD in medicine^ E.K. ZHEKAITE12.
S.I. KUTSEV1 MD^ ProfM Corresponding Member of RAS
1 Medico-Genetic Scientific Center Moscow
2 Moscow Regional Consultative Diagnostic Scientific Center for Children Moscow
INFLUENCE OF NEONATAL SCREENING FOR CYSTIC FIBROSIS BY THE EXAMPLE OF PATIENTS OF THE MOSCOW REGION Study objective: comparative evaluation of clinical status of patients with cystic fibrosis (CF) 6-9 years^ the diagnosis of which was established before the start of neonatal screening (NS) for MV in the Moscow region and in same age group since the start of the NS according to the register 2012 and 2015.
Patients and methods. The patients were divided into 2 groups: I — 45 children aged 6-9 years^ diagnosed before the beginning of the NS^ II — 86 children aged 6-9 years^ identified after the start of the NS.
Results. A comparative assessment of the age of diagnosis had a significant difference between groups I and II. The average age of diagnosis in group I was 2.29 (±2.29) years^ in group II the average age of diagnosis — 0.66 (± 1.13) years (p = 0.0000). According to the microbiological status diagnosed according to the NS program (group !!)• chronic infection of the respiratory tract by Ps. aeruginosa was less frequent in this group (37.78% of patients in group I vs. 14Д0 % in group II) (p = 0.0026). In the group of patients identified by the newborns screening program directed at newborns (group II) a statistically significant decrease of the ongoing intravenous (p = 0.0000) and inhaled antibiotic therapy (p = 0.0139) and reduced compared with group I patients receiving bronchodilators (p = 0.0322). Conclusion. A positive impact of neonatal screening for MV at the age of diagnosis and a number of important indicators of the disease was demonstrated.
Keywords: cystic fibrosis, neonatal screening, sweat test.
С июня 2006 г. в ряде регионов Российской Федерации (РФ), в т. ч. в Московском, расширен список наследственных заболеваний, подлежащих обязательному неонатальному скринингу. С января 2007 г. массовое обследование новорожденных на фенилкетонурию, гипотиреоз, галактоземию, адреногени-тальный синдром и муковисцидоз (МВ) проводится во всей РФ. Протокол скрининга на МВ включает в себя 3 этапа: двукратное определение иммунореактивного трипсиногена (ИРТ) в крови новорожденных и потовую пробу у младенцев с превышением ИРТ пороговых пока-
зателей первого и второго этапов [1-4] (рис. 1). Для проведения потовой пробы используется система «Нанодакт» (Вескор, США), специально разработанная для обследования новорожденных. Этот экспресс-метод диагностики позволяет быстро получить точный результат, практически без вмешательства в жизнь ребенка [4-7].
За время существования неонатального скрининга на МВ существенно изменился не только подход к диагностике этого заболевания, но и клиническая характеристика пациентов, особенно детского возраста. Благодаря существованию регистров больных МВ в ряде стран, а
Рисунок 1. Схема неонатального скрининга на
муковисцидоз в Московском регионе
Отрицательная
I
Наблюдение по м/ж Консультация в 1 год
I
Пограничная
Нет мутаций
ДНК-анализ
I
Наблюдение в центре МВ
Эластаза 1, повторные потовые пробы, сиквенс,
дополнительные методы обследования
Положительная
2 мутации 1 мутация
чМВ/
также ежегодным отчетам европейского и североамериканского регистров, можно оценить, какой существенный вклад неонатальный скрининг вносит в диагностику этого тяжелого заболевания. По данным регистра больных МВ РФ 2015 г., 40% больных, сведения о которых представлены в регистре, диагноз был установлен по результатам неонатального скрининга [8].
Муковисцидоз (mucus — слизь, viscidus — вязкий), или кистозный фиброз, — наследственное моногенное заболевание с аутосомно-рецессивным типом наследования, распространенное в основном среди европейцев и жителей Северной Америки. В результате мутаций гена CFTR (cystic fibrosis transmembrane conductance regulator — регулятор трансмембранной проводимости при МВ) белок, выполняющий в организме функцию хлорного канала, не функционирует или функция его нарушена таким образом, что существенно повышается вязкость всех вырабатываемых экзокринными железами секретов, в первую очередь бронхиальной слизи, секрета придаточных пазух, поджелудочной железы и печени. Отсюда многообразие клинической картины, так называемый полиорганный характер поражения [1, 4]. Степень нарушения функции белка в некоторой степени определяется типом мутации гена. В настоящее время около 2 тыс. мутаций условно подразделяются на 5 или даже на 6 классов в зависимости от характера
нарушений [4] (рис. 2). Мутации первых 3 классов ассоциированы с классическим МВ, условно считаются «тяжелыми», т. к. приводят к существенным нарушениям внешнесе-креторной функции поджелудочной железы. Мутации I и V классов, при которых функция хлорного канала частично сохранена, относятся к «мягким» [4].
До начала эры неонатального скрининга диагноз МВ устанавливался в основном на основании клинических симптомов. Это было, как правило, сочетание респираторного и кишечного синдромов в сочетании с отставанием физического развития. Благодаря внедрению неонатального скрининга диагноз МВ может и должен быть установлен в первые месяцы жизни [3, 4, 9, 10]. При этом у ребенка могут полностью отсутствовать признаки заболевания. Выявление МВ на доклиническом этапе является основной целью программы неонатального скрининга, поскольку позволяет после комплексной оценки состояния ребенка, назначить адекватную базисную терапию, предотвратив или отсрочив, таким образом, развитие осложнений.
Для оценки эффективности неонатального скрининга проведено множество исследований. Их результаты свидетельствуют о том, что неонатальный скрининг на муковисцидоз положительно влияет на выживаемость больных [11, 12], позволяет предупредить развитие тяжелых осложнений [13, 14], улучшает показатели физического развития [15-20], способствует улучшению функции легких [14, 16, 20-22], снижает потребность в госпитализации [14, 16], а также способствует сокращению числа больных в популяции. Кроме того, скрининг новорожденных является одним из тех редких вмешательств, осуществляемых органами здравоохранения, которые выгодны не только пациентам, но и с экономических позиций обществу в целом [23, 24].
В России также проводилась оценка эффективности неонатального скрининга на МВ. Так, в 2012 г. Кусова З.А. в своем исследовании, проведенном на базе Медико-генетического научного центра (МГНЦ), показала на груп-
Рисунок 2. Классы мутаций гена CFTR
пе московских пациентов с МВ раннего возраста, что клиническое состояние больных, выявленных в первые месяцы жизни по программе неонатального скрининга, при сравнении с детьми, диагностированными в более старшем возрасте, лучше по показателям физического развития, состоянию бронхолегочной системы, микробиологическому статусу, числу обострений кишечного и респираторного синдромов и тяжести течения заболевания [20].
Целью нашего исследования явилась сравнительная оценка клинического статуса и анализ ряда показателей в 4 возрастных группах пациентов с МВ (6; 7; 8; 9 лет), диагноз которым был установлен до начала неонатального скрининга на МВ в Московском регионе и в аналогичных возрастных группах с момента начала неонатального скрининга.
ПАЦИЕНТЫ И МЕТОДЫ
Нами были проанализированы данные регистров 2012 (дети 6-9 лет, диагностированные до начала скрининга) и 2015 гг. (дети 6-9 лет после начала скрининга) пациентов с МВ, проживающих в Московском регионе, находившихся под наблюдением сотрудников научно-клинического отдела (НКО) муковисцидоза МГНЦ.
Сотрудниками НКО муковисцидоза МГНЦ под руководством профессора Н.И. Капранова впервые в РФ внедрено активное диспансерное наблюдение больных МВ, а также отработана схема ведения новорожденных, выявленных по программе неонатального скрининга. Независимо от наличия жалоб, комплексная оценка состояния пациентов осуществляется специалистами центра муковисцидоза не реже одного раза в квартал после 1 года жизни, в 2-3 раза чаще на первом году. Все новорожденные с установленным диагнозом наблюдаются и обследуются исключительно в амбулаторных условиях, госпитализация проводится только по жизненным показаниям.
Все изученные нами пациенты были условно разделены на 2 группы: 1-я — пациенты, диагноз которым был установлен до начала программы скрининга, — 45 человек; 2-я — пациенты, диагностированные по неонатально-му скринингу, — 86 человек. Каждая группа включала 4 возрастные подгруппы: 6; 7; 8 и 9 лет (табл. 1).
Таблица 1. Характеристика групп пациентов
Возраст I (до скрининга) II (после скрининга)
девочки мальчики девочки мальчики
6 лет 4 (66,67%) 2 (33,33%) 8 (27,59%) 21 (72,41%)
7 лет 8 (61,54°%) 5 (38,46%) 15 (68,18%) 7 (31,82%)
8 лет 7 (53,85%) 6 (46,15%) 14 (56,00%) 11 (44,00%)
9 лет 6 (46,15%) 7 (53,85%) 7 (70,00%) 3 (30,00%)
Всего 25 (55,56%) 20 (44,44%) 44 (51,16%) 42 (48,84%)
45 86
В исследуемых группах проводился анализ и сравнение следующих показателей национального регистра: пол, возраст установки диагноза, генотип, число пациентов с нормальным уровнем панкреатической эластазы 1 (>200 мкг/г), наличие стафилококковой и синегнойной инфекции в посевах из верхних дыхательных путей, диабета, поражения печени, легочного кровотечения, остеопо-роза, полипоза верхних дыхательных путей, амилоидоза, показателей функции внешнего дыхания (ФЖЕЛ, ОФВ1), показателей нутритивного статуса (рост, вес, ИМТ в системе перцентилей), а также объем проводимой терапии (заместительная ферментная терапия, муколитическая, антибактериальная, противовоспалительная терапия). Формат регистра соответствовал Европейскому регистру больных МВ.
Две группы больных сравнивались между собой по указанным выше показателям в возрастном диапазоне с 6 до 9 лет включительно.
Обработка полученных данных проводилась с помощью пакета прикладных программ STATISTICA. В качестве мер для описания исходной выборки использовались критерии среднего арифметического (М) и стандартного отклонения (SD), в то время как интерпретация полученных результатов (не имеющих нормального распределения) проводилась с использованием медианы (Ме), а также нижнего и верхнего квартилей: Q1 (25%) и Q3 (75%). В целях сопоставления полученных выборок по количественному признаку использовался U-критерий Манна — Уитни (Mann — Whitney U-test). Различия считались статистически значимыми при p < 0,05.
РЕЗУЛЬТАТЫ
Исследуемые группы существенно различались по количеству пациентов. Так, в 1-й группе (до скрининга) насчитывалось всего 45 человек, тогда как в 2-й (скрининг) — уже 86 детей. Это говорит о том, что за определенный интервал времени, благодаря скринингу новорожденных на МВ, было выявлено почти в два раза больше пациентов, чем за аналогичный период до начала программы скрининга. Группы 1 и 2 не различались между собой по полу, в каждой группе было примерно равное количество мальчиков и девочек (табл. 1).
При сравнительной оценке возраста установки диагноза получено достоверное различие между I и II группами. Средний возраст установления диагноза в группе I составил 2,29 (±2,29) года, а медиана — 1,17 (0,5-4,08) года, в группе II средний возраст установления диагноза — 0,66 (± 1,13) года (p = 0,0000), медиана — 0,19 (0,110,48) года (p = 0,0000) (табл. 2). До начала скрининга диагноз в основном устанавливался по клиническим проявлениям, поэтому в группе I преобладали пациенты с «тяжелыми» мутациями. Гомозиготное носительство наиболее часто встречающейся «тяжелой» мутации второго класса — F508del в этой группе составило 44,4% (20 больных из 45), аллельная частота F508del — 62,25%. В группе II (после скрининга) генотип F508del/F508del встречался у 24,4 % больных (21 из 86), а аллельная частота F508del составила 40,7%.
Таблица 2. Клиническая характеристика пациентов
групп I и II в возрастном диапазоне с 6 до 9 лет
Группы (п) I (до скрининга) (45) II (после скрининга) (86) р
Возраст установки диагноза, годы Ме (025-075) 1,17 (0,50-4,08) 0,19 (0,11-0,48) 0,0000
Панкреатическая эластаза > 200 мкг/г, чел. * 4 (8,89%) 19 (22,09%)
Хроническая стафилококковая инфекция, чел. 38 (84,44°%) 69 (80,23%) 0,5252
Хроническая синегнойная инфекция, чел. 17 (37,78%) 11 (12,79%) 0,0026
Интермиттирую-щая синегнойная инфекция, чел. 6 (13,33%) 12 (13,95%) 0,6662
Диабет, чел. 1 (2,22%) — 0,1797
Поражение печени, чел. 3 (6,67%) 7 (8,14%) 0,6954
Полипоз верхних дыхательных путей,чел. 12 (26,67%) 15 (17,44%) 0,2579
ФЖЕЛ, % Ме (01-03) 86,00 (74,00-98,00) 88,00 (79,00-100,00) 0,4311
ОФВ., % Ме (011-03) 87,00 (65,00-93,00) 89,00 (78,00-108,00) 0,2667
Рост, перцентиль Ме (01-03) 49,75 (17,80-74,00) 52,80(30,70-79,10) 0,2377
Вес, перцентиль Ме (01-03) 24,00 (20,00-29,00) 23,50 (20,95-25,85) 0,3952
ИМТ, перцентиль Ме (01-03) 43,15 (11,50-65,00) 37,30 (17,30-68,10) 0,6749
* Достоверность не рассчитывалась в связи с малочисленностью группы.
По показателям нутритивного статуса (масса, рост, ИМТ) между группами I и II в целом и между детьми из аналогичных возрастных подгрупп никаких различий установлено не было. Данный факт можно объяснить изначально большим количеством пациентов с «мягкими» мутациями и сохранной функцией поджелудочной железы во II группе. Панкреатическая эластаза 1 более 200 мкг/г кала (норма) была обнаружена у 4 (8,89%) детей в группе до скрининга и у 19 (22,09%) больных после скрининга (табл. 2).
Особое внимание было уделено изучению различий показателей функции внешнего дыхания (ФВД) как одной из важнейших характеристик течения заболевания и его прогноза у больных МВ. Пациенты, диагноз которым был установлен по программе скрининга, не отличались по показателям ФЖЕЛ (форсированная жизненная емкость
легких) и ОФВг (объем форсированного выдоха за первую секунду) от своих сверстников, выявленных по клинически симптомам. Средний показатель ФЖЕЛ в группе I составил 82,96 % (± 17,99), в группе II — 87,71% (± 19,47) (р = 0,4311), средний уровень ОФВ1 в группе I — 77,95% (± 22,20), в группе II — 87,13 % (± 23,03) (р = 0,2669) {табл. 2). Дальнейшие исследования на однородных по классу мутаций группах могут внести коррективы в полученные результаты.
Хроническая инфекция нижних дыхательных путей (НДП) — ключевой признак у больных МВ [4]. Она является ведущим фактором, определяющим тяжесть клинического течения и прогноз заболевания. При изучении микрофлоры НДП в различных возрастных группах детей, больных МВ, исследователями различных стран установлено, что основными возбудителями инфекции легких у больных МВ являются Р. aeruginosa, S. aureus и H. influenzae. В первые годы жизни у больных МВ доминирует золотистый стафилококк, а затем основным возбудителем становится синегнойная палочка [8]. По результатам оценки и сравнения микробиологического статуса (наличие хронической колонизации верхних дыхательных путей золотистым стафилококком, хронической или интермиттирующей синегнойной инфекции) группа пациентов, диагностированных по программе скрининга (группа II), достоверно реже имела в посевах отделяемого из верхних дыхательных путей и мокроты хроническую инфекцию Ps. aeruginosa (37,78% инфицированных синегнойной палочкой в группе I против 14,10 % в группе II) (р = 0,0026) (табл. 2). Эти данные совпадают с полученными ранее у детей первых 3 лет жизни [20]. При анализе ситуации с хронической синегнойной инфекцией в возрастных подгруппах, зарегистрировано наиболее значимое различие в группах детей 9 лет. Так, частота хронического инфицирования синегнойной палочкой в группе II (после скрининга) составила 10% против 61,54% в группе I (до скрининга) (р = 0,0208). В этой же возрастной подгруппе пациенты, выявленные по программе скрининга, достоверно реже получали внутривенную антибактериальную терапию (10% в группе II против 76,92% в группе I) (р = 0,0030).
В общей группе больных, выявленных по программе скрининга новорожденных (группа II), отмечено статистически значимое уменьшение объема всей проводимой внутривенной (р = 0,0000) и ингаляционной антибактериальной терапии (р = 0,0139) и снижение по сравнению с группой I числа пациентов, принимающих бронхолитики (р = 0,0322) (табл. 3). Это можно объяснить, как снижением числа больных с синегнойной инфекцией, так и соответственно меньшим числом обострений хронического бронхолегочного процесса. В группе II пациентам реже назначались системные стероиды, что может указывать на меньшую тяжесть течения заболевания.
Нами не было получено никаких достоверных различий между пациентами групп I и II по частоте полипоза носа и поражения печени. В обеих группах больных практически не было отмечено случаев развития осложнений МВ (муковисцидоз-ассоциированного сахарного
больных
Таблица 3. Объем терапии в исследуемых группах
Группы (n) I (до скрининга) (45) II (после скрининга) (86) р
Ингаляции гипертонического раствора ЫаС1 17 (37,78%) 62 (72,09%) 0,0000
Ингаляционные антибиотики 26 (57,78%) 28 (32,56%) 0,0139
Внутривенные антибиотики 17 (37,78%) 5 (5,81%) 0,0000
Таблетированные антибиотики 40 (88,89%) 67 (77,91%) 0,2693
Бронхолитики 35 (77,78%) 47 (54,65%) 0,0322
Ингаляционные стероиды 2 (4,44%) 4 (4,65%) 0,8895
Системные стероиды * 4 (8,89%) 1 (1,16%) —
Панкреатические ферменты 44 (97,78%) 71 (82,56%) 0,0546
диабета, легочного кровотечения, пневмоторакса, ами-лоидоза, остеопороза) (табл. 2), что вполне объясняется возрастом пациентов. Большинство из указанных осложнений развивается, как правило, у подростков и взрослых больных [8].
iНе можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
ЗАКЛЮЧЕНИЕ
Таким образом, с 2006 г. в Московском регионе основной группой поиска/риска больных муковисцидозом являются новорожденные с повышенным уровнем ИРТ (дважды на первом месяце жизни). Неонатальный скрининг на сегодняшний день — важнейший и единственный метод выявления максимального числа больных МВ на раннем доклиническом этапе. Как показало наше исследование, скрининг позволяет выявить практически в 2 раза больше больных, чем диагностика по клиническим признакам за тот же промежуток времени. При этом установить заболевание можно и у носителей «мягких» мутаций, у которых МВ может протекать легче за счет сохранной функции поджелудочной железы, но при этом они будут нуждаться в комплексной терапии и профилактике развития осложнений. Методика наблюдения новорожденных, выявленных по программе скрининга, разработанная сотрудниками НКО муковисцидоза МГНЦ, продемонстрировала свою эффективность. Так, раннее выявление больных, амбулаторная система диспансерного наблюдения, регулярный контроль микробиологического статуса позволяют добиться в группе пациентов, выявленных по скринингу, снижения частоты хронического инфицирования синегнойной палочкой и, как следствие, потребности в антибактериальной терапии. Показатели ФВД и нутритивного статуса не продемонстрировали достоверных различий в группах, что может быть обусловлено генетической разнородностью групп больных и требует дальнейших исследований и наблюдений. ©
ЛИТЕРАТУРА
1. Муковисцидоз. Монография. Под ред. Н.И. Капранова, Н.Ю. Каширской. М., 2014.
2 Шерман В.Д., Каширская Н.Ю., Кондратьева Е.И., Воронкова А.Ю., Капранов Н.И., Амелина Е.Л. и др. Национальный консенсус. Муковисцидоз: определение, диагностические критерии, терапия, раздел «диагностика муковисцидоза». Педиатрия, 2017, 2: 90-98.
3 Castellani C, Southern KW, Brownlee K, Dankert Roelse J, Duff A, Farrell M, et al. European best practice guidelines for cystic fibrosis neonatal screening. J Cyst Fibros, 2009, 8: 153-73.
4. Кондратьева Е.И., Каширская Н.Ю., Капранов Н.И. Национальный консенсус «Муковисцидоз: определение, диагностические критерии, терапия». М.: «Компания Боргес», 205 с.
5 Sezer RG, Aydemir G, Akcan AB et al. Nanoduct sweat conductivity measurements in 2664 patients: relationship to age, arterial blood gas, serum electrolyte profiles and clinical diagnosis. J Clin Med Res, 2013 Feb, 5(1): 34-41
6 Langen AV, Dompeling E, Yntema JB et al. Clinical evaluation of the Nanoduct sweat test system in the diagnosis of cystic fibrosis after newborn screening. Eur J Pediatr, 2015 Aug, 174(8): 1025-34.
7 Barben J, Ammann RA, Metlagel A, Schoni MH. Conductivity determined by a new sweat analyzer compared with chloride concentrations for the diagnosis of cystic fibrosis. J Pediatr, 2005, 146: 183-8.
8 Регистр больных муковисцидозом в Российской Федерации. 2015 год. Под ред. Е.И. Кондратьевой, С.А. Красовского, А.Ю. Воронковой, Е.Л. Амелиной, А.В. Черняка, Н.Ю. Каширской. М.: ИД «Медпрактика-М», 2016, 72 с.
9 Farell PM, Rosenstein BJ, White TB et al. Cystic fibrosis foundation. Guidelines for diagnosis of cystic fibrosis in newborns through older
adults: Cystic Fibrosis Foundation consensus report. J Pediatr, 2008, 153(2): S4-S14.
10 European cystic fibrosis society standarts of care working group. Best practice guidelines. В редакции Alan R Smith и Scott Bell (http//www. ecfs.eu/ecfs-standarts-care/introduction), 2014.
11 Grosse SD, Rosenfeld M, Devine OJ, et al. Potential impact of newborn screening for cystic fibrosis on child survival: a systematic review and analysis. J Pediatr, 2006, 149: 362-366.
12 Dankert-Roelse JE, Merelle ME. Newborn screening for CF: published evidence from Europe. J Pediatrics, 2005, 147(3Suppl): S15-20.
13 Koscik RL, Lai HJ, Laxova A, et al. Preventing early, prolonged vitamin E deficiency: an opportunity for better cognitive outcomes via early diagnosis through neonatal screening. J Pediatr, 2005, 147: S51-6.
14 Accurso FJ, Sontag MK, Wagener JS. Complications associated with symptomatic diagnosis in infants with cystic fibrosis. Journal of Pediatrics, 2005, 147(3 suppl.): S37-S41.
15 Farrell PM, Lai HJ, Li Z, Kosorok MR, Laxova A, Green CG, et al. Evidence on improved outcomes with early diagnosis of cystic fibrosis through neonatal screening: Enough is enough! Journal of Pediatrics, 2005, 147(3 suppl.): S30-S6.
16 Sims EJ, Clark A, McCormick J, Mehta G, Connett G, Mehta A, et al. Cystic fibrosis diagnosed after 2 months of age leads to worse outcomes and requires more therapy. Pediatrics, 2007, 119(1): 19-28.
17 Sims EJ, McCormick J, Mehta G, Mehta A. Neonatal screening for cystic fibrosis is beneficial even in the context of modern treatment. Journal of Pediatrics, 2005, 147(3 suppl.): S42-S6.
18 Wang SS, Fitzsimmons SC, O’Leary LA, Rock MJ, Gwinn ML, Khoury MJ. Early diagnosis of cystic fibrosis in the newborn period and risk of Pseudomonas aeruginosa acquisition in the
first 10 years of life: A registry-based longitudinal study. Pediatrics, 2001, 107(2): 274-9.
19 Siret D, Bretaudeau G, Branger B, et al. Comparing the clinical evolution of cystic fibrosis screened neonatally to that of cystic fibrosis diagnosed from clinical symptoms: a 10-year retrospective study in a French region (Brittany). Pediatr Pulmonol, 2003, 35: 342-9.
20 Кусова З.А. Эффективность программы массового обследования новорожденных на муковисцидоз. Автореферат дис. … канд. мед. наук. М., 2011. 23 с.
21 Merelle ME, Schouten JP, Gerritsen J, Dankert-Roel-se JE. Influence of neonatal screening and centralized treatment on long-term clinical outcome and survival of CF patients. Eur Respir J, 2001, 18: 306-15.
22 Lai HJ, Cheng Y, Cho H, Kosorok MR, Farrell PM. Association between initial disease presentation, lung disease outcomes, and survival in patients with cystic fibrosis. Am J Epidemiol, 2004, 159: 537-46.
23 Carroll A.E, Downs SM. Comprehensive cost-utility analysis of newborn screening strategies. Pediatrics, 2006 May, 117(5 Pt 2): S287-95.
24 Grosse SD, Thompson JD, Ding Y, Glass M. The Use of Economic Evaluation to Inform Newborn Screening Policy Decisions: The Washington State Experience. Milbank O, 2016, 94: 366-91.
25 Report of the UK Cystic Fibrosis Trust Bone Mineralisation Working Group. Bone mineralization in cystic fibrosis. Cystic Fibrosis. 2007.
26 Sermet-Gaudelus I, Bianchi ML, Garabedian M, Aris RM, Morton A, Hardin DS, Elkin SL et al. European cystic fibrosis bone mineralisation guidelines. Journal of Cystic Fibrosis, 2011, 10(suppl 2): S16-S23.
27 Красовский С.А. Остеопороз у взрослых больных муковисцидозом. Автореферат дис. … канд. мед. наук. М., 2012
28 Kelly А, Moran A. Update on cystic fibrosis-related diabetes. Journal of Cystic Fibrosis, 2013, 12: 318-331