Ошибки в антибактериальной терапии инфекций дыхательных путей в амбулаторной практике
Статьи
Опубликовано в журнале:
Лечащий врач, 2003, №8 Л. И. Дворецкий, доктор медицинских наук, профессор
С. В. Яковлев, доктор медицинских наук, профессор
ММА им. И. М. Сеченова, Москва
Проблема рациональной антибактериальной терапии инфекций дыхательных путей не теряет актуальности и в настоящее время. Наличие большого арсенала антибактериальных препаратов, с одной стороны, расширяет возможности лечения различных инфекций, а с другой — требует от врача-клинициста осведомленности о многочисленных антибиотиках и их свойствах (спектр действия, фармакокинетика, побочные эффекты и т. д.), умения ориентироваться в вопросах микробиологии, клинической фармакологии и других смежных дисциплинах.
Согласно И. В. Давыдовскому, «врачебные ошибки — род добросовестных заблуждений врача в его суждениях и действиях при исполнении им тех или иных специальных врачебных обязанностей». Ошибки в антибактериальной терапии инфекций дыхательных путей имеют наибольший удельный вес в структуре всех лечебно-тактических ошибок, совершаемых в пульмонологической практике, и оказывают существенное влияние на исход заболевания. Кроме того, неправильное назначение антибактериальной терапии может иметь не только медицинские, но и различные социальные, деонтологические, экономические и другие последствия.
При выборе способа антибактериальной терапии в амбулаторной практике необходимо учитывать и решать как тактические, так и стратегические задачи. К тактическим задачам антибиотикотерапии относится рациональный выбор антибактериального препарата, обладающего наибольшим терапевтическим и наименьшим токсическим воздействием.
Стратегическая задача антибиотикотерапии в амбулаторной практике может быть сформулирована как уменьшение селекции и распространения резистентных штаммов микроорганизмов в популяции.
В соответствии с этими положениями следует выделять тактические и стратегические ошибки при проведении антибактериальной терапии инфекций дыхательных путей в амбулаторной практике (см. таблицу 1).
Таблица 1. Ошибки антибактериальной терапии в амбулаторной практике.
| Тактические ошибки | Стратегические ошибки |
|
|
|
Тактические ошибки антибактериальной терапии
1. Необоснованное назначение антибактериальных средств
Особую категорию ошибок представляет неоправданное применение антибактериальных препаратов (АП) в тех ситуациях, когда их назначение не показано.
Показанием для назначения антибактериального препарата является диагностированная или предполагаемая бактериальная инфекция.
Наиболее распространенная ошибка в амбулаторной практике — назначение антибактериальных препаратов при острых респираторных вирусных инфекциях (ОРВИ), имеющее место как в терапевтической, так и в педиатрической практике. При этом ошибки могут быть обусловлены как неправильной трактовкой симптоматики (врач принимает ОРВИ за бактериальную бронхолегочную инфекцию в виде пневмонии или бронхита), так и стремлением предотвратить бактериальные осложнения ОРВИ.
При всех трудностях принятия решения в подобных ситуациях необходимо отдавать себе отчет в том, что антибактериальные препараты не оказывают влияния на течение вирусной инфекции и, следовательно, их назначение при ОРВИ не оправдано (см. таблицу 2). В то же время предполагаемая возможность предотвращения бактериальных осложнений вирусных инфекций с помощью назначения антибактериальных препаратов не находит себе подтверждения в клинической практике. Кроме того, очевидно, что широкое неоправданное применение антибактериальных препаратов при ОРВИ чревато формированием лекарственной устойчивости и повышением риска возникновения нежелательных реакций у пациента.
Таблица 2. Инфекционные заболевания дыхательных путей преимущественно вирусной этиологии
и не требующие антибактериальной терапии.
|
Инфекции верхних дыхательных путей |
Инфекции нижних дыхательных путей |
|
|
|
Одной из распространенных ошибок при проведении антибактериальной терапии является назначение одновременно с антибиотиком противогрибковых средств с целью профилактики грибковых осложнений и дисбактериоза. Следует подчеркнуть, что при применении современных антибактериальных средств у иммунокомпетентных пациентов риск развития грибковой суперинфекции минимален, поэтому одновременное назначение антимикотиков в этом случае не оправдано. Комбинация антибиотика с противогрибковым средством целесообразна только у больных, получающих цитостатическую или противоопухолевую терапию или у ВИЧ-инфицированных пациентов. В этих случаях оправдано профилактическое назначение антимикотиков системного действия (кетоконазол, миконазол, флуконазол), но не нистатина. Последний практически не всасывается в желудочно-кишечном тракте и не способен предотвратить грибковую суперинфекцию иной локализации — полости рта, дыхательных или мочевыводящих путей, половых органов. Часто практикующееся назначение нистатина с целью профилактики дисбактериоза кишечника вообще не находит логического объяснения.
Часто врач назначает нистатин или другой антимикотик в случае обнаружения в полости рта или в моче грибов рода Candida. При этом он ориентируется лишь на данные микробиологического исследования и не учитывает наличие или отсутствие симптомов кандидоза, а также факторов риска развития грибковой инфекции (тяжелый иммунодефицит и др.).
Выделение грибов рода Candida из полости рта или мочевых путей пациентов в большинстве случаев служит свидетельством бессимптомной колонизации, не требующей коррегирующей противогрибковой терапии.
II. Ошибки в выборе антибактериального препарата
Пожалуй, наибольшее число ошибок, возникающих в амбулаторной практике, связано с выбором антибактериального средства. Выбор антибиотика должен производиться с учетом следующих основных критериев:
| Тонзиллофарингит | Острый средний отит | Синусит | Обострение хронического бронхита | Пневмония |
| Streptococcus pyogenes | Streptococcus pneumoniae Haemophilus influenzae |
Streptococcus pneumoniae Haemophilus influenzae Moraxella catarrhalis в ассоциации с анаэробами |
Haemophilus influenzae Streptococcus pneumoniae Moraxella catarrhalis; У пожилых: + Staphylococcus aureus |
Streptococcus pneumoniae Haemophilus influenzae Mycoplasma pneumoniae Chlamydia pneumoniae, реже — Enterobacteriaceae Staphylococcus aureus Klebsiella pneumoniae Legionella pneumophila |
Кроме того, при выборе препарата следует учитывать уровень приобретенной резистентности возбудителей в популяции. Основные тенденции, касающиеся резистентности возбудителей, отмеченной в последние годы, отражены в таблице 4. Таблица 4. Современные проблемы резистентности наиболее частых возбудителей внебольничных инфекций дыхательных путей.
| Микроорганизмы | Современные проблемы лечения |
| Streptococcus pneumoniae | Снижение чувствительности к бета-лактамам; устойчивость в пенициллину в России не превышает 2%, но штаммы с умеренной чувствительностью составляют 10 — 20%. b-лактамы (амоксициллин, ампициллин, цефалоспорины III-IV поколения, карбапенемы) сохраняют полную клиническую эффективность в отношении пенициллинрезистентных пневмококков, в то же время эффективность цефалоспоринов I-II поколения может быть снижена. Низкая природная активность пероральных цефалоспоринов III поколения, прежде всего цефтибутена. Рост устойчивости к макролидам: в Европе от 8 до 35%, в России — около 12%; устойчивость ассоциируется с клиническим неуспехом терапии. Высокая частота резистентности в России к ко-тримоксазолу и тетрациклинам (>50%). Низкая природная активность ранних фторхинолонов, в последние годы отмечено увеличение частоты резистентных штаммов; высокая активность новых фторхинолонов — резистентность минимальная. |
| Streptococcus pyogenes | Возрастание устойчивости к макролидам: в Европе до 50%, в России 10-20%. Рост устойчивости прямо связан с увеличением частоты потребления макролидов, главным образом пролонгированных препаратов (азитромицин, кларитромицин). Высокая устойчивость к тетрациклинам (>50%). Низкая природная активность ранних фторхинолоно в. Устойчивость к пенициллину и другим b-лактамам не описана. |
| Haemophilus influenzae | Продукция b-лактамаз в 1 — 40%, в России не превышает 10%; клинически амоксициллин не уступает защищенным пенициллинам. Практически не наблюдается устойчивости к амоксициллину/клавуланату, цефалоспоринам II-IV поколений, фторхинолонам. Цефалоспорины I поколения не активны. Природная активность макролидов низкая, риск бактериологического неуспеха лечения высокий. Устойчивость к ко-тримоксазолу в России около 20%. |
Наиболее значимые проблемы, связанные с применением основных антибактериальных средств при инфекциях дыхательных путей, могут быть сформулированы следующим образом. b-лактамы:
| Рекомендуются | Не рекомендуются |
|
Пенициллины Амоксициллин Амоксициллин/клавуланат Пероральные цефалослорины II поколения Цефуроксим аксетил Новые фторхинолоны Левофлоксацин Моксифлоксацин Макролиды (только при атипичной пневмонии) Доксициклин (только при атипичной пневмонии) |
Ко-тримоксазол Ампиокс Аминогликозиды Гентамицин Ранние фторхинолоны Ципрофлоксацин Офлоксацин Пефлоксацин Ломефлоксацин Цефалоспорины I поколения Цефазолин Цефалексин Цефрадин Цефаклор Пероральные цефалоспорины III поколения Цефтибутен |
Следует подчеркнуть, что назначение некоторых антибактериальных препаратов, применяемое в амбулаторной практике при респираторных инфекциях, нельзя признать рациональным. К таким препаратам прежде всего относятся:
| Тонзиллофарингит | Острый средний отит | Синусит | Хронический бронхит | Пневмония |
| Амоксициллин Амоксициллин/клавуланат1 Феноксиметилпенициллин Бензатин пенициллин Цефадроксил Цефуроксим аксетил1 Линкомицин1 Клиндамицин1 |
Амоксициллин Амоксициллин/клавуланат Цефуроксим аксетил Цефтриаксон |
Амоксициллин/клавуланат Цефуроксим аксетил Левофлоксацин Моксифлоксацин Клиндамицин |
Амоксициллин/клавуланат Амоксициллин Цефуроксим аксетил Левофлоксацин Моксифлоксацин |
Амоксициллин Амоксициллин/клавуланат Макролиды2 Доксициклин2 Левофлоксацин Моксифлоксацин |
1 Преимущественно при рецидивирующем течении
2При атипичной этиологии (Mycoplasma pneumoniae, Chlamydia pneumoniae, Legionella pneumopriila) Представленные рекомендации имеют наиболее общий характер. В то же время с практических позиций выбор оптимального антибактериального препарата также должен осуществляться с учетом особенностей пациента и заболевания. Так, например, у больных пневмонией молодого и среднего возраста без отягощающих факторов терапевтический эффект оказывают амоксициллин, макролиды, защищенные пенициллины и новые фторхинолоны. Однако у больных пожилого возраста в этиологии заболевания большее значение приобретают S. aureus и грамотрицательные бактерии, что объясняет снижение эффективности амоксициллина и макролидов у этой категории больных. Также распространенной во врачебной практике ошибкой является отказ от назначения антибактериальной терапии при пневмонии беременным женщинам из-за опасения негативного влияния препаратов на плод. Следует отметить, что перечень антибактериальных препаратов, прием которых нежелателен во время беременности из-за риска эмбриотоксического действия, ограничен — тетрациклины, хлорамфеникол, сульфаниламиды, ко-тримоксазол, фторхинолоны, аминогликозиды. Другие антибиотики, в частности b-лактамы, макролиды, могут применяться у беременных женщин. Другие возможные факторы, влияющие на выбор антибактериального препарата, представлены в таблице 7. Таблица 7. Особые клинические ситуации при внебольничных инфекциях нижних дыхательных путей.
| Ситуация | Возбудители | Наиболее надежные препараты |
| Алкоголизм, сахарный диабет | Enterobacteriaceae S. aureus S. pneumoniae |
Амоксициллин/клавуланат Левофлоксацин Моксифлоксацин |
| Деструкция, абсцедирование | S. aureus Анаэробы К. pneumoniae |
Амоксициллин/клавуланат Клиндамицин + цефалоспорин I II поколения Фторхинолон + метронидазол Имипенем Меропенем |
| Бронхоэктазы, муковисцидоз | P. aeruginosa S. aureus |
Ципрофлоксацин Цефтазидим Меропенем |
| ВИЧ | P. carinii Enterobacteriaceae |
Ко-тримоксазол + фторхинолон |
Нередки ошибки при выборе антибактериального препарата в случае неэффективности первоначального. Здесь необходимо также остановиться на ошибках антибактериальной терапии, которые касаются несвоевременной оценки неэффективности первоначального антибиотика. Общепринятым критическим сроком оценки эффективности (или неэффективности) антибактериальной терапии считаются 48-72 ч с момента его назначения. К сожалению, приходится нередко сталкиваться с такими случаями, когда больной продолжает получать назначенный антибиотик в течение недели и более, несмотря на отсутствие очевидного клинического эффекта. Обычно критерием эффективности антибактериальной терапии является снижение или нормализация температуры тела больного, уменьшение признаков интоксикации. В тех случаях (не столь частых), когда лихорадка с самого начала заболевания отсутствует, приходится ориентироваться на другие признаки интоксикации (головная боль, анорексия, общемозговая симптоматика и т. д.), а также на отсутствие прогрессирования заболевания за период проводимого лечения. Продолжение антибактериальной терапии, невзирая на ее неэффективность, имеет немало негативных последствий. При этом затягивается назначение другого, более адекватного антибиотика, что ведет к прогрессированию воспаления (особенно важно при тяжелых пневмониях, у больных с сопутствующей патологией) и развитию осложнений, а также удлиняет сроки лечения. Кроме того, повышается риск возникновения побочных (токсических) эффектов препаратов, а также развития и усиления антибиотикорезистентности. Продолжение лечения, несмотря на неэффективность проводимой терапии, подрывает доверие больного и его родственников к лечащему врачу. Очевидна и неэкономичность такой ошибочной тактики антибактериальной терапии (напрасный расход неэффективного АП, дополнительные затраты на лечение токсических эффектов и др.). Кроме того, ошибки встречаются при замене неэффективного антибиотика на другой, т. е. при смене препарата. При этом врач забывает, что принцип выбора антибактериального препарата остается прежним, т. е. ориентироваться следует на клиническую ситуацию с учетом, однако, неэффективности первоначального препарата и ряда других дополнительных признаков. Отсутствие эффекта от первоначально назначенного антибиотика в известной степени должно служить дополнительным ориентиром, позволяющим обосновать выбор второго препарата. Так, например, отсутствие эффекта от применения b-лактамных антибиотиков (пенициллины, цефалоспорины) у больного с внебольничной пневмонией позволяет предполагать атипичную этиологию пневмонии (микоплазменной, хламидийной или легионеллезной) с учетом, разумеется, других клинических признаков. Клинические признаки атипичной пневмонии, вызванной Mycoplasma pneumoniae или Chlamydia pneumonias:
| Примеры | Целесообразно |
| Амоксициллин внутрь 0,75-1 г в сутки | 0,5-1 г три раза в сутки |
| Ампициллин в/в 2 г в сутки | 1 г четыре раза в сутки |
| Амоксициллин/клавуланат внутрь 0,375 г три раза в сутки |
0,625 г три раза в сутки или 1 г два раза в сутки |
| Цефуроксим аксетил внутрь 0,5 г в сутки | 0,5 г два раза в сутки |
| Эритромицин внутрь 1 г в сутки | 0,5 г четыре раза в сутки |
| Кларитромицин внутрь 0,5 г в сутки | 0,5 г два раза в сутки |
| Ципрофлоксацин внутрь 0,5 г в сутки | 0,5-0,75 г два раза в сутки |
| Оксациллин внутрь 1-1,5 г в сутки | Не рекомендуется |
| Ампиокс внутрь 0,25-0,5 г три раза в сутки | Не рекомендуется |
Неправильный выбор интервалов между введениями антибактериальных препаратов обычно обусловлен не столько сложностями парентерального введения препаратов в амбулаторных условиях или негативным настроем больных, сколько неосведомленностью практикующих врачей о некоторых фармакодинамических и фармакокинетических особенностях препаратов, которые должны определять режим их дозирования. Типичной ошибкой является назначение в амбулаторной педиатрической практике при пневмонии бензилпенициллина с кратностью введения два раза в сутки, так как более частое его введение неудобно для пациента. Следует отметить, что при нетяжелом течении пневмонии вряд ли оправдано стремление некоторых врачей к обязательному назначению парентеральных антибиотиков. Современные антибактериальные препараты характеризуются хорошей биодоступностью при приеме внутрь, а также одинаковой клинической эффективностью с парентеральными препаратами, поэтому в подавляющем большинстве случаев оправдано лечение пероральными препаратами. Если назначение парентеральных антибиотиков действительно необходимо, следует выбрать препарат с длительным периодом полувыведения (например, цефтриаксон), что позволяет назначать его один раз в сутки. IV. Ошибки при комбинированном назначении антибиотиков Одной из ошибок антибактериальной терапии внебольничных респираторных инфекций является необоснованное назначение комбинации антибиотиков. Врачи старших поколений помнят то время (50-70-е гг. прошлого столетия), когда при лечении пневмонии обязательным считалось назначение пенициллина и стрептомицина, о чем свидетельствовали многие учебные пособия и руководства. Это был своеобразный стандарт лечения пневмоний для того времени. Несколько позднее одновременно с антибиотиками рекомендовалось назначение сульфаниламидов, с учетом полученных в свое время 3.В.Ермольевой данных о химиотерапевтическом синергизме сульфаниламидов и пенициллина. В современной ситуации, при наличии большого арсенала высокоэффективных антибактериальных препаратов широкого спектра, показания к комбинированной антибактериальной терапии значительно сужены, и приоритет в лечении респираторных инфекций остается за монотерапией. В многочисленных контролируемых исследованиях показана высокая клиническая и бактериологическая эффективность адекватных антибактериальных средств при лечении респираторных инфекций в режиме монотерапии (амоксициллин, амоксициллин/клавуланат, цефалоспорины II — III поколений, новые фторхинолоны). Комбинированная антибактериальная терапия не имеет реальных преимуществ ни в выраженности эффекта, ни в предотвращении развития резистентных штаммов. Основными показаниями к комбинированной антибактериальной терапии являются тяжелое течение пневмонии — в этом случае общепринятым стандартом лечения становится комбинированное назначение парентерального цефалоспорина III поколения (цефотаксим или цефтриаксон) и парентерального макролидного антибиотика (эритромицин, или кларитромицин, или спирамицин); последние включаются в комбинацию для воздействия на вероятных атипичных микроорганизмов (легионелла или микоплазма). Следует отметить, что в настоящее время в клинической практике появились новые антибактериальные препараты (левофлоксацин, моксифлоксацин) с высокой активностью в отношении как типичных, так и атипичных возбудителей, что позволяет назначать их в режиме монотерапии даже при тяжелой пневмонии. Другой клинической ситуацией, оправдывающей комбинированное назначение антибиотиков, является пневмония у иммунокомпрометированных пациентов (лечение цитостатиками, СПИД), при которой имеется высокая вероятность ассоциации возбудителей (см. таблицу 7). К сожалению, часто в амбулаторной практике приходится сталкиваться с ситуациями, при которых больным с нетяжелым течением пневмонии, при отсутствии осложнений, тяжелой фоновой патологии назначается два антибиотика. Логичного обоснования этой тактики лечения нет, при этом следует учитывать возможный антагонизм препаратов, более высокий риск нежелательных реакций и увеличение стоимости лечения. Следует отметить, что нерациональные комбинации антибактериальных препаратов имеют и официальные лекарственные формы, которые выпускаются отечественной фармацевтической промышленностью, например ампиокс, олететрин. Разумеется, применение таких препаратов недопустимо. V. Ошибки, связанные с длительностью антибактериальной терапии и критериями клинической эффективности В некоторых случаях проводится необоснованно длительная антибактериальная терапия. Такая ошибочная тактика обусловлена, прежде всего, недостаточным пониманием цели самой антибактериальной терапии, которая сводится прежде всего к эрадикации возбудителя или подавлению его дальнейшего роста, т. е. направлена на подавление микробной агрессии. Собственно воспалительная реакция легочной ткани, которая проявляется различными клинико-рентгенологическими признаками (аускультативная картина, сохраняющаяся рентгенологическая инфильтрация, ускорение СОЭ) регрессирует медленнее и не требует продолжения антибактериальной терапии (см. таблицу 9). В связи с этим следует считать ошибочной тактику, согласно которой у больного с сохраняющимися рентгенологическими признаками легочной инфильтрации, крепитирующими хрипами (crepitacio redux), увеличением СОЭ при нормализации температуры тела и исчезновении (или уменьшении) признаков интоксикации продолжают проводить антибактериальную терапию. Таблица 9. Сроки исчезновения симптомов при эффективной антибактериальной терапии внебольничной пневмонии.
| Симптомы и признаки | Сроки исчезновения |
| Интоксикация | 24-48 ч |
| Отрицательная гемокультура | 24-72 ч |
| Лихорадка | 2 — 5 дней |
| Лейкоцитоз | 5- 10 дней |
| Хрипы в легких | 1 — 3 недели |
| Сухой кашель | 2 — 8 недель |
| Инфильтрация на рентгенограмме | 2 — 8 недель |
Еще более ошибочна тактика замены одного антибиотика на другой в подобных ситуациях, расцениваемых врачом как неэффективность назначенной антибактериальной терапии. У некоторых больных после исчезновения признаков интоксикации и даже регрессии воспалительных изменений в легких в течение длительного времени может сохраняться слабость, потливость, субфебрильная температура. Последняя расценивается врачом как проявление не полностью купированной бронхолегочной инфекции, что «подтверждается» рентгенологическими данными в виде изменения легочного рисунка или «остаточными явлениями пневмонии» и обычно влечет за собой назначение антибактериального препарата, несмотря на отсутствие изменений со стороны крови. Между тем подобная клиническая ситуация часто обусловлена вегетативной дисфункцией после легочной инфекции (постинфекционная астения) и не требует антибактериальной терапии, хотя, разумеется, в каждом конкретном случае необходимы тщательное обследование больного и расшифровка всей имеющейся симптоматики. Рекомендованная длительность применения антибактериальных препаратов при бронхолегочных инфекциях приведена в таблице 10. Таблица 10. Длительность антибактериальной терапии бактериальных респираторных инфекций в амбулаторной практике.
| Заболевания | Рекомендованная длительность терапии (дни) |
| Стрептококковый тонзиллофарингит | 10* |
| Острый средний отит | 5-7** |
| Острый синусит | 10-14 |
| Обострение хронического бронхита | 7-10*** |
| Пневмония | 5-7**** |
| * | Показана эффективность цефуроксим аксетила, телитромицина и азитромицина при пятидневных курсах; бензатинпенициллин вводится однократно внутримышечно |
| ** | Показана эффективность цефтриаксона (50 мг/кг в сутки) в течение трех дней |
| *** | Показана эффективность новых фторхинолонов (левофлоксацин, моксифлоксацин) при пятидневных курсах |
| **** | Обычно рекомендуемые сроки леченая составляют три-четыре дня после нормализации температуры; средние сроки лечения — пять-десять дней. При стафилококковой этиологии пневмонии рекомендуется более длительный курс антибактериальной терапии — две-три недели; при атипичной пневмонии (микоплазменная, хламидийная, легионеллезная) предполагаемая длительность антибактериальной терапии составляет 10-14 дней. |
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
© ХРИСТОЛЮБОВА Е.И., Л И. ВОЛКОВА
ОШИБКИ АНТИБАКТЕРИАЛЬНОЙ ТЕРАПИИ ВНЕБОЛЬНИЧНЫХ ПНЕВМОНИЙ
Е.И. Христолюбова, Л.И. Волкова
Сибирский государственный медицинский институт, г. Томск, ректор — д.м.н., проф.
В.В. Новицкий
Резюме. Проведён ретроспективный анализ медицинской документации: амбулаторные карты 438 больных, обратившихся в поликлиническое отделение, и 104 истории болезни, госпитализированных в пульмонологическое отделение с диагнозом «Внебольничная пневмония» (ВП). Проанализированы ошибки антибактериальной терапии (АБТ): выбор стартовой, определение её длительности, сроков коррекции, назначение режима дозирования антибактериального препарата (АБП). Внедрение в практику врачей стандартов лечения ВП приводит к улучшению качества лечения и уменьшению количества ошибок (АБТ).
Ключевые слова: внебольничная пневмония, ошибка антибактериальной терапия.
Внебольничная пневмония (ВП) является распространённым заболеванием, встречающимся в практике врачей-терапевтов и требующим лечения на разных этапах оказания медицинской помощи — как в поликлинике, так и в стационаре [8]. По данным литературы, внедрение в практику врачей стандартов лечения внебольничных пневмоний приводит к улучшению качества лечения и уменьшению количества ошибок антибактериальной терапии (АБТ) [3, 4, 9].
Однако, несмотря на имеющиеся рекомендации по лечению больных ВП, представленные в «Стандартах (протоколах) диагностики и лечения больных с неспецифическими заболеваниями лёгких» [5], в Федеральной программе по диагностике и лечению внебольничной пневмонии у взрослых в России [7], врачи допускают существенные и многочисленные ошибки в лечении этого заболевания [4, 10]. Это относится как к выбору стартовой антибактериальной терапии (АБТ), так и к определению её длительности, сроков коррекции, назначению режима дозирования антибактериального препарата (АБП). В литературе представлены единичные работы, посвящённые анализу
ошибок АБТ пневмоний после введения в действие «Стандартов (протоколов) диагностики и лечения больных с неспецифическими заболеваниями лёгких» [5].
Материалы и методы С целью оценки качества АБТ и ее ошибок, совершаемых врачами при лечении больных ВП, нами проведён ретроспективный анализ медицинской документации, которая ведётся врачами в поликлиническом и пульмонологическом отделениях МКЛПМУ «Городская больница №3» г. Томска. Были изучены амбулаторные карты 438 больных, обратившихся в поликлиническое отделение, и 104 истории болезни госпитализированных в пульмонологическое отделение с ВП. Для того, чтобы определить результативность внедрения рекомендаций по лечению ВП, представленных в Стандартах [5], мы проанализировали ошибки АБТ за периоды 1999-2000 гг. (333 больных) и 2005 г. (105 больных).
Возраст больных, получивших лечение в условиях поликлиники, составил от 16 до 84 лет (средний возраст 43,03±17,75 лет), из них мужчин было 60%. По возрасту больные распределились следующим образом: 16-19 лет — 9%; 20-29 — 21,7%; 30-39 — 16%; 40-49 -17,4%; 50-59 — 15,4%; 60-69 — 13%; 70 и старше — 7,5%. Итак большинство больных было трудоспособного возраста. Работающие больные составили 58,3%; учащиеся и студенты — 12,7%; пенсионеры — 13,4%; инвалиды — 2,6%; неработающие
трудоспособного возраста — 13%. Сопутствующая патология (ИБС, гипертоническая болезнь, хронический пиелонефрит, сахарный диабет, хронический бронхит, бронхиальная астма и др.) имела место в 39,4% у больных в возрасте 29 лет и старше. Наиболее частой была патология сердечно-сосудистой системы.
Возраст больных, госпитализированных в стационар, составил от 16 до 87 (средний возраст 54,95±19,12) лет, из них мужчин было 51,6%. По возрасту больные распределились следующим образом: 16-19 лет — 8%; 20-29 — 9,7%; 30-39 — 9,7%; 40-59 -17,7%; 60-69 — 15,3%; 70 и старше — 29,1%, из них больные трудоспособного возраста составили 55,6%. Работающие больные составили 26,6%, пенсионеры — 46%, инвалиды -4%, неработающие трудоспособного возраста — 14,5%, учащиеся и студенты — 6,5%, лица без определённого места жительства — 2,4%. Таким образом, большую часть госпитализированных больных составили неработающие лица (73,4%).
Результаты и обсуждение Ошибки антибактериальной терапии внебольничной пневмонии в условиях поликлиники. Выбор стартовой антибактериальной терапии является одним из важных вопросов, определяющих исход пневмонии [1, 6]. В качестве ошибок АБТ мы расценивали факты несоблюдения протоколов АБТ, изложенных в Стандартах [5].
Как в 1999-2000 гг., так и в 2005 г. назначение АБП выполнялось в большинстве случаев согласно протоколу, изложенному в Стандартах диагностики и лечения больных с неспецифическими заболеваниями лёгких. Процентное соотношение препаратов выбора стартовой АБТ в обоих периодах времени было одинаковым: «по Стандартам» — 77,2% и 78% и «не по Стандартам» — 22,8% и 22% соответственно (р>0,05). Среди препаратов стартовой АБТ «по Стандартам» в обоих анализируемых периодах преобладали препараты группы пенициллинов (75,9% и 60,9%). Однако в 2005 году достоверно чаще стали назначаться препараты группы макролидов: 37,8 % в 2005 году против 24,1% в предыдущих анализируемых годах (р=0,03). Имелись и качественные различия в выборе АБП. Так в 1999-2000 гг. из препаратов группы пенициллинов чаще назначался ампициллин внутрь и парентерально. Ни в одном случае не был назначен амоксициллин. Из препаратов группы макролидов чаще назначался эритромицин в таблетках. В 2005 г. применялись более эффективные АБП: основным назначаемым препаратом группы пенициллинов стал амоксициллин, из группы макролидов — мидекамицин, спирамицин. Эритромицин не был назначен ни в одном случае. В тех случаях, когда АБ назначались не по протоколу, в обоих анализируемых периодах чаще назначался ципрофлоксацин (ципролет) в таблетированном виде, что было ошибочным, так как он обладает низкой активностью в отношении пневмококковой инфекции [6]. Обращает на себя внимание то, что в 2005 г. уменьшилось назначение гентамицина по сравнению с таковым в 1999-2000 годах: (0,9% против 3,3%), применение которого в амбулаторных условиях считается распространённой грубой ошибкой [7] (рис. 1).
При выборе стартовой АБТ при ВП в амбулаторных условиях рекомендуется пероральное назначение одного АБП [7]. Анализ показал, что в 2005 г. стала формироваться тенденция к более редкому парентеральному назначению антибактериальных препаратов: 11,4% в 2005 против 21,2% в предыдущих
рассматриваемых в аналитическом аспекте годах (р=0,05). Одновременное назначение двух антибиотиков в 1999-2000 гг. наблюдалось крайне редко, а в 2005г. этого не наблюдалось.
Одним из основных критериев оценки адекватного выбора стартового АБП является положительная динамика клинических симптомов и, в первую очередь, нормализация температуры тела. Показателем неадекватного выбора стартовой АБТ является факт изменения ее из-за отсутствия положительной клинической симптоматики. Оценка эффективности стартовой АБТ была проведена по факту смены АБТ. В период 1999-2000 гг. анализировались 224 наблюдения, в 2005г. — 84 (исключены госпитализированные больные).
В 1999 — 2000 гг. смена стартовой АБТ из-за её неэффективности проведена у 67 (29,9%) больных. Большинству — 170 (75,9%) больных первоначальная АБТ была назначена согласно Протоколу, у остальных — 54 (24,1%) она не соответствовала Стандартам. В тех случаях, когда АБ был назначен согласно Стандартам, необходимость в смене первоначального антибиотика из-за его неэффективности возникла у 44 (25,8%) больных. Практически у всех этих больных АБ первого выбора были ампициллин в таблетках, низкая эффективность которого в настоящее время доказана, и эритромицин в таблетках, причём последний — в недостаточной суточной дозе. У тех больных, которым была назначена АБТ, не соответствующая Стандартам, необходимость смены АБ возникла достоверно чаще — в 23 (42,6%) наблюдениях, (р=0,01). У больных этой группы препаратом выбора в большинстве случаев был ципролет. У больных ВП, получавших лечение в 2005 году, смена первоначальной АБТ производилась достоверно реже, чем в предшествующие годы — только у 8 (9,5%, р<0,001) больных, причём в большинстве случаев стартовым АБП был также ципролет.
При смене АБП, так же как и при назначении стартовой терапии, допускались ошибки в выборе: у 20 (29,8%) больных выбирался антибиотик, не соответствующий Стандартам: ципролет, доксициклин, гентамицин, цефазолин. Смена АБ проводилась дважды к 5 (7,5 % больных), при этом во всех случаях выбирался АБП, не соответствующий рекомендациям.
Ошибки дозирования АБП — это назначение неправильных доз и неправильный режим назначения (кратность приёма) препаратов. Недостаточная доза АБ не только является одной из причин неэффективности терапии, но и создаёт предпосылки для формирования резистентности микроорганизмов [10]. Дозирование АБП анализировалось у 400 больных ВП (в 333 — первоначальное назначение и в 67 — повторное) в 1999-2000 гг. и у 113 (в 105 -первоначальное назначение и в 8 — повторное) в 2005 г. При определении адекватной дозы АБ, назначаемых при ВП, мы руководствовались рекомендациями Л.И. Дворецкого и С.В. Яковлева [2]. В 1999-2000 гг. ошибки в выборе адекватной дозы АБП имели место у 64 (16%) больных, а в 2005г. — только у 4-х (3,6%), что было достоверно реже (р <0,001) (табл.1). Ошибочный выбор дозы АБП заключался в следующем: назначение в таблетках ципролета в дозе 500 мг в сутки; эритромицина — 1,0 г в сутки; ампициллина в таблетках в дозе 1 — 1,5 г в сутки; мидекамицина в дозе 0,8 г в сутки. В 2005 г. наблюдались аналогичные ошибки дозирования при назначении ципролета и мидекамицина.
Неправильный режим назначения (кратность приёма) антибактериального препарата в 1999-2000 гг имел место в 15 (3,7%) наблюдениях. В основном это было двух- и
трёхкратное назначение ампициллина и пенициллина. В 2005 г. таких ошибок не наблюдалось.
Таблица 1
Ошибки в выборе адекватной дозы антибиотика
Антибиотик Рекомендуемая доза, в сут. Ошибочная доза, в сут. Количество случаев
1999-2000 2005
1 2
п % п %
Ципролет 1,0 0,5 35 8,8 1 0,95
Эритромицин 2,0 1,0 24 6,0 0
Ампициллин 2,0 — 3,0 1,0 — 1,5 4 1 0
Мидекамицин ,4 2, — ,2 0,8 1 0,25 3 2,8
Всего ошибок дозирования 64 16,0 4 3,6*
Примечание: *р<0,001
Назначение нистатина, являющееся, согласно данным литературы, одной из распространённых ошибок при проведении АБТ [7], наблюдалось всего в 6 (1,5%) наблюдениях, а в 2005 г. таких назначений не было.
Одной из ошибок АБТ является её необоснованно длительные сроки из-за сохранения аускультативных данных, изменённых лабораторных показателей, рентгенологических признаков лёгочной инфильтрации при отсутствии температурной реакции [6]. Этот показатель был проанализирован у 224 больных ВП, которые получали курс АБТ в условиях поликлиники в 1999-2000 гг. В анализируемой группе необоснованно длительное назначение АБП имело место у 17 (7,6%) больных. У 13 из них основанием для продолжения АБТ послужила сохраняющаяся после контрольного рентгенологического исследования инфильтрация в лёгочной ткани, у 2 — отсутствие динамики аускультативной картины (наличие влажных хрипов), у 2 — сохранение изменённых лабораторных показателей (ускорение СОЭ).
Ошибки антибактериальной терапии внебольничных пневмоний на госпитальном этапе. У больных, получавших лечение в стационаре, выбор стартового АБП согласно Стандартам имел место у 101 (97,1%) больного и не соответствовал им — лишь у 3 (2,9%). В большинстве случаев (96%) препаратами выбора были АБП группы пенициллинов (инъекционные формы ампициллина). То есть у госпитализированных больных выбор
стартовой антибактериальной терапии в основном соответствовал Стандартам. Тем не менее, у 44 (42,3%) больных стартовая АБТ была неэффективной, в связи с чем проводилась смена АБП. Из-за отсутствия клинического эффекта у 26 больных была проведена однократная смена АБ, при этом сохранялась монотерапия, либо назначались два АБП. У 18 больных выполнялась двухкратная смена АБ, и назначалось последовательно 3-4 АБП. Одновременно назначались не более двух АБП. При смене стартовой АБТ у 67 больных имело место назначение второго и третьего АБП, из них у 51 (76%) назначались неадекватные АБП (в 46,2% — ципролет в таблетках).
Для выяснения причин неэффективности была проанализирована вся группа больных (44) ВП, которым осуществлялась смена стартового АБП. Анализ показал, что во всех случаях имела место недооценка тяжести ВП при первичном осмотре лечащим врачом. Установлено, что у 35 (79,5%) больных отмечались факторы, отягощавшие течение пневмонии, которые не были учтены врачом при выборе стартового антибиотика. У 23 (52,3%) из них имелась сопутствующая патология: хронический бронхит, бронхиальная астма; у 16 (36,4%) уже имелись осложнения: у 7 (15,9%) — двустороннее поражение, у 9 (20,4%) — абсцедирование, у 7 (15,9%) — экссудативный плеврит. Лейкоцитоз у этих больных составил в среднем (10,3±1,2 -109/л, причём у 14 из них он равнялся 11,0-109/л и более). У двух больных отмечалась выраженная лейкопения с количеством клеток белой крови менее 2,0-109/л.
Важным критерием адекватности стартовой АБТ является нормализация температуры тела. Оценка эффективности первоначальной АБТ по этому показателю проведена у 64 больных. У большей части из них (56,2%) наблюдалась нормализация температуры в течение первых четырёх суток АБТ. Позднее 4-го дня снижение температуры
наблюдалось в 43,8% случаев. Сохранение повышенной температуры тела более 4-х дней после назначения АБП у значительной части больных свидетельствовало о формальном подходе к выбору стартовой АБТ, без должной оценки сопутствующей патологии, развития осложнений и оценки тяжести заболевания. Несмотря на тот факт, что в большинстве случаев выбор АБ соответствовал Стандартам, чаще всего препаратом выбора был ампициллин, который не действует на атипичные микробы.
Средняя продолжительность АБТ в стационаре составила 12,7 ± 4,4 дня.
Необоснованно избыточная АБТ, которая продолжалась от 3 до 8 (в среднем 4,7 ±1,5) дней, обнаружена у 8 (7,7%) больных. В 2 наблюдениях в качестве причины этого указаны сохраняющиеся изменённые лабораторные показатели (ускорение СОЭ), в одном -наличие остаточных явлений, выявленных при контрольном рентгенологическом
исследовании, в остальных — аргументации не было. В условиях стационара преобладал парентеральный способ введения АБП, ошибок дозирования их выявлено не было.
Таким образом наиболее частой ошибкой АБТ при лечении больных ВП на этапе поликлиники был неадекватный выбор АБП при назначении стартовой АБТ и при смене АБ. Ошибки дозирования, профилактическое назначение противогрибковой терапии (нистатина) в поликлинике отмечены редко. В условиях стационара таких ошибок не было. В ряде случаев врачи поликлиники и стационара допускали необоснованно длительное назначение АБТ. Основной ошибкой АБТ при лечении больных ВП в стационаре является недооценка тяжести течения ВП и влияния сопутствующей патологии, и в связи с этим был сделан неадекватный выбор стартового АБП.
Все эти ошибки относятся к субъективным, их причиной является недостаточное знание врачей. После введения Стандартов наблюдается уменьшение количества ошибок, допускаемых врачами в лечении ВП в условиях поликлиники. Использование врачами поликлиник и стационаров современных стандартов по ведению больных с ВП позволяет уменьшить количество ошибок в лечении этого заболевания, а также оптимизировать выбор АБП.
Таким образом при проведении экспертизы качества лечения больных с внебольничными пневмониями экспертами страховых компаний следует учитывать соблюдение врачами современных стандартов по диагностике и лечению этого заболевания.
ERRORS OF ANTIBACTERIAL THERAPY OF OUT-PATIENT PNEUMONIA
E.I. Hristolyubova, L.I. Volkova Siberian state medical university
Retrospective analysis of medical documentation was made: 438 case histories of out-patients and 104 case histories of patients were admitted to the pulmonology department with diagnosis community-acquired pneumonia. The errors of antibacterial therapy were analyzed: the choice of initial therapy, its duration, correction term, the dose of antibacterial drug. Inculcation in practice of treatment standards leads to improvement of treatment quality and decrease of quantity of errors.
Литература
1. Внебольничная пневмония у взрослых: практические рекомендации по диагностике, лечению и профилактике: пособие для врачей / А.Г. Чучалин, А.И. Синопальномков,
Яковлев С.В. и др. // Клинич. микробиол. и антимикроб. Химиотерапия. — 2003. — №5. —
С. 198-224.
2. Дворецкий Л.И., Яковлев С.В. Ошибки антибактериальной терапии инфекций дыхательных путей в амбулаторной практике //Леч. врач. — 2003. — №8. — С.48-54.
3. Назаренко Г.И., Антипин А.Н., Новиков Ю.К. Антибактериальная терапия внебольничных пневмоний (анализ литературы и собственных данных, клиническая эффективность рекомендаций) // Пульмонология. — 2004. — №4. — С. 60-66.
4. Представления врачей поликлиник об этиологии и тактике лечения внебольничной пневмонии в амбулаторных условиях / С.А. Рачина, С.Н. Козлов, Е.А. Иделевич и др. // Пульмонология. — 2004. — №2. — С. 6-12.
5. Стандарты (протоколы) диагностики и лечения больных с неспецифическими заболеваниями лёгких (взрослое население). — М., 1998. — С. 33-47.
6. Страчунский Л. С. Антибактериальная терапия внебольничной пневмонии в амбулаторных условиях // Consil. Medicum. — 2002. — Т.4, №4. — С.180-185.
7. Федеральная программа по диагностике и лечению внебольничной пневмонии у взрослых в России / Consil. medicum. — Экстра-выпуск. — 21c. — // www. consilium medicum.com
8. Чучалин А.Г., Синопальников А.И., Страчунский Л.С. Пневмония. — М.: ООО «Мед. информац. агентство», 2006. — С. 17-49.
9. Barlow G., Nathwani D., Davey P. The effect of implementing the British Thoracic Society community-acquired pneumonia guidelines on antibiotic prescribing and costs in a UK teaching hospital // Clin. Microbiol. Infect. — 2006. — Vol. 12, N 5. — P. 498-500.
10. Management of patients with community-acquired pneumonia in a primary care hospital: a critical evaluation / S. Ewig, K. Seifert, T. Kleinfeld et al. // Respir. Med. — 2000. — Vol. 94, N6. — P. 556-563.
%
20
18
16
14
12
10
8
6
4
2
0
18,3
4
16,2
Т2 34
6,8
3,8
0,9
0 0
у— 2,3
0 0 0,6 1 т 1,1 г. и
0
0,6 а
0
1999 2000 2005 1999 2000 2005.1999 2000 2005 1999 2000 2005 1999 2000 2005 1999 2000 2005
^——————‘ 4———у———‘ <——-^’ «Ч________________________■> V—————-‘ V——————V
Ципрофлоксацин/
ципролет
Гентамицин
Цефазолин
V
Ампиокс
V
Канамицин
«V»
iНе можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
Доксициклин
Рис. 1. Препараты стартовой антибактериальной терапии, назначенные терапевтами поликлиники для лечения внебольничной пневмонии, но не соответствующие стандартам.
Термин антибиотик в переводе с греческого означает «против жизни». Действительно, этот тип препаратов уничтожает бактерии. Первый антибиотик, пенициллин, открытый в 1928 году, стал настоящим прорывом в медицине. Благодаря антибиотикотерапии стали излечимыми тяжелейшие инфекционные заболевания, например, туберкулез и чума, которые ранее часто приводили к смерти.
Многим кажется, что антибиотики излечивают все. Поэтому всякий раз, когда в организме появляется инфекция, такие люди бегут не к врачу, а в аптеку за антибиотиками. Действительно, правильно подобранные таблетки быстро уменьшают симптомы заболевания, но этот тип препаратов следует применять только в строго определенных случаях. Например, они не подходят для лечения вирусов.
Не секрет, что россияне злоупотребляют антибиотиками – мы находимся на переднем крае европейских стран, где антибиотики прописывают, когда надо и не надо.
Когда использовать антибиотики?
Антибиотики могут быть бактериостатическими или бактерицидными. В первом случае они препятствуют размножению бактерий, во втором – они уничтожают живые клетки. При этом антибиотики эффективны только тогда, когда инфекция вызвана бактериями. Поэтому назначение антибиотика должно происходить только тогда, когда врач уверен, что инфекция бактериальная.
К сожалению, тесты, подтверждающие этиологию инфекции, проводятся редко. При назначении антибиотика врачи обычно полагаются на конкретные симптомы бактериальной инфекции и место возникновения инфекции, зная, что определенные группы бактерий вызывают определенные симптомы.
Если у врача есть сомнения относительно происхождения заболевания, он обязан назначить анализ, подразумевающий посев биологической жидкости, например, мокроты, на специальную питательную среду. На таких средах бактерии быстро разрастаются, образуя колонии, хорошо различимые под микроскопом.
Затем можно воздействовать на выявленные бактерии разными антибиотиками, чтобы понять, какой из них будет уничтожать обнаруженный вид бактерий. Такой же анализ необходимо провести, если лечение уже назначенным антибиотиком остается неэффективным.
Ошибки при антибиотикотерапии
Успех лечения антибиотиками зависит как от правильного типа препарата, так и от способа его приема. Наиболее распространенные ошибки, допускаемые пациентами во время лечения антибиотиками, включают в себя:
Ошибка 1. Несоблюдение сроков приема препарата
Антибиотики следует принимать через регулярные промежутки времени – каждые 24, 12 или 8 часов в зависимости от типа. Благодаря регулярной дозе препарата их концентрация в организме постоянна, и бактерии не могут размножаться.
Делая слишком много перерывов, пациент дает им время для дальнейшего развития, что задерживает процесс выздоровления.
Ошибка 2. Несоблюдение полного курса лечения
Антибиотики всегда следует принимать до конца, то есть столько, сколько предписано врачом. Обычно лечение антибиотиками длится 8-10 дней, хотя лечение инфекции мочевого пузыря может быть ограничено 3 днями. Пациенты часто бросают лечение антибиотиками в середине курса, как только почувствуют себя лучше.
Это неправильно, так как значительно увеличивает вероятность того, что бактерии вызовут рецидив заболевания.
Ошибка 3. Отсутствие защиты пищеварительной системы
Антибиотики смертельны не только для болезнетворных бактерий, но и для бактерий, которые колонизируют в пищеварительной системе и полезны для нашего здоровья. Результатом стерилизации организма является постантибиотическая диарея.
В рамках защиты полезных бактерий следует принимать защитные препараты – пробиотики как в виде лекарственных препаратов, так и натуральные – йогурт, кефир. Пробиотические препараты следует принимать примерно через час после введения антибиотика. Они также могут быть использованы после окончания антибиотикотерапии для ускорения восстановления бактериальной флоры в пищеварительной системе.
Устойчивость к антибиотикам – почему не проходит болезнь
В последние годы специалисты бьют тревогу по поводу злоупотребления антибиотиками, из-за чего патогенные бактерии становиться устойчивыми к антибиотикотерапии. Чаще всего пациенты принимают таблетки, путая бактериальную инфекцию с вирусной.
Пример, когда антибиотики не помогут – очень распространенные болезни: бронхит, фарингит, синусит, отит. Подавляющее большинство случаев острого бронхита – около 95% – вызвано вирусами. То же самое относится к острому синуситу и острому фарингиту – в этих случаях вирусы вызывают около 80% случаев. Также нет смысла вводить антибиотик при среднем отите, по крайней мере, на первом этапе, который вызван вирусами. Только со временем могут развиться осложнения, для лечения которых необходим антибиотик.
На практике, однако, такие заболевания, особенно если они касаются детей, часто лечат антибиотиком, хотя для этого нет причины – антибиотики не предотвратят бактериальную инфекцию. Они только научат бактерии бороться. И в следующий раз, когда действительно потребуется антибиотикотерапия, она не поможет! Это еще одна причина, по которой этот класс препаратов следует применять только тогда, когда это действительно необходимо.
13 июня, 2019 г. 19:23
Осенне-зимний период относится к не к самым лёгким для специалистов имеющих дело с заболеваниями дыхательных органов. 
Инфекции дыхательных путей являются самыми частыми инфекционными заболеваниями у человека.
Этиология внебольничных респираторных инфекций непосредственно связана с нормальной микрофлорой «не стерильных» верхних отделов дыхательных путей (полости рта, носа, рото- и носоглотки). Из множества видов микроорганизмов, колонизующих верхние отделы дыхательных путей, лишь некоторые, обладающие повышенной вирулентностью, способны при проникновении в нижние дыхательные пути вызвать воспалительную реакцию даже при минимальных нарушениях защитных механизмов. Такими типичными бактериальными возбудителями внебольничных инфекций нижних дыхательных путей (пневмонии и бронхита) являются Streptococcus pneumoniae, Haemophilus influenzae, реже встречаются Staphylococcus aureus, Klebsiella pneumoniae. Определенное значение в этиологии имеют атипичные возбудители – Mycoplasma pneumoniae, Chlamydophila pneumoniae, Legionella pneumophila. Ведущим бактериальным возбудителем тонзиллофарингита является бета-гемолитический стрептококк группы А ***
Проблема рациональной антибактериальной терапии инфекций дыхательных путей продолжает оставаться актуальной в настоящее время. Наличие большого арсенала антибактериальных препаратов (АП), с одной стороны, расширяет возможности различных инфекций, а с другой – требует от врача-клинициста осведомленности о многочисленных антибиотиках и их свойствах (спектр действия, фармакокинетика, побочные эффекты и т.д.), ориентировки в вопросах микробиологии, клинической фармакологии и других смежных дисциплинах.
Согласно И.В. Давыдовскому, “врачебные ошибки – род добросовестных заблуждений врача в его суждениях и действиях при исполнении им тех или иных специальных врачебных обязанностей”
Ошибки в антибактериальной терапии инфекции дыхательных путей имеют наибольший удельный вес в структуре всех лечебно-тактических ошибок в пульмонологической практике, оказывая существенное влияние на исход заболевания. Кроме того, ошибки в антибактериальной терапии могут иметь не только чисто медицинские, но и различные социальные, деонтологические, экономические и другие аспекты.*
Наиболее значимые возбудители внебольничных инфекций дыхательных путей *
|
Тонзиллофарингит |
Острый средний отит |
Синусит |
Обострение хронического бронхита |
Пневмония |
|
Streptococcus pyogenes |
Streptococcus pneumoniae |
Streptococcus pneumoniae |
Haemophilus influenzae |
Streptococcus pneumoniae |
|
Haemophilus influenzae |
Haemophilus influenzae |
Streptococcus pneumoniae |
Haemophilus influenzae |
|
|
Moraxella catarrhalis |
Moraxella catarrhalis в ассоциации с анаэробами |
Moraxella catarrhalis, у пожилых + Staphylococcus aureus |
Mycoplasma pneumoniae |
Оптимальными средствами для лечения внебольничных инфекций дыхательных путей в настоящее время могут быть признаны бета-лактамные антибиотики и новые фторхинолоны. Использование макролидов должно быть ограничено – препараты можно назначать при нетяжелой пневмонии у детей или пациентов молодого возраста, особенно при наличии признаков атипичного течения (микоплазменная, хламидийная).
Следует подчеркнуть, что назначение некоторых антибактериальных препаратов, практикующееся в амбулаторной практике при респираторных инфекциях, нельзя признать рациональным. К таким препаратам прежде всего относятся:
Гентамицин – отсутствие активности в отношении наиболее частого возбудителя S.pneumoniae и потенциально высокая токсичность.
Ко-тримоксазол – высокий уровень резистентности S.pneumoniae и H.influenzae.
Ранние фторхинолоны (ципрофлоксацин, офлоксацин, пефлоксацин, ломефлоксацин) – низкая активность против S.pneumoniae.
Пероральные цефалоспорины III поколения – цефтибутен (Ротацеф- парентеральный цефалоспорин прим.) — отсутствие активности против S.pneumoniae.
Ампиокс – нерациональная комбинация, дозы ампициллина и оксациллина (по 0,125 мг) значительно ниже терапевтических.
Частой ошибкой во врачебной практике является не назначение антибактериальной терапии при пневмонии беременным женщинам из-за опасения негативного влияния препаратов на плод. Следует отметить, что перечень антибактериальных препаратов, которые нежелательны во время беременности из-за риска эмбриотоксического действия ограничен – тетрациклины, хлорамфеникол, сульфаниламиды, ко-тримоксазол, фторхинолоны, аминогликозиды. Другие антибиотики, в частности бета-лактамы, макролиды, могут с безопасностью применяться у беременных женщин.*
Одной из распространённых ошибок является и неправильный выбор продолжительности лечения.
Длительность антибактериальной терапии бактериальных респираторных инфекций в амбулаторной практике ***
|
Заболевание |
Рекомендованная длительность терапии, дни |
|
Стрептококковый тонзиллофарингит |
10 |
|
Острый средний отит |
7 # |
|
Синусит |
10—14 |
|
Обострение хронического бронхита |
7—10 ## |
|
Пневмония |
5—7 ### |
|
Примечание. #— показана эффективность цефтриаксона (Ротацефа) (у детей 50 мг/кг/сут внутривенно) и азитромицина в течение 3 дней; ## — показана эффективность фторхинолонов II поколения (левофлоксацин, моксифлоксацин) при 5-дневных курсах; ### — обычно рекомендуемые сроки лечения составляют 3—4 дня после нормализации температуры. При стафилококковой этиологии рекомендуется более длительный курс антибактериальной терапии — 2—3 нед; при атипичной пневмонии (микоплазменная, хламидийная) рекомендуемая длительность антибактериальной терапии составляет 14 дней. |
Устойчивость микроорганизмов – ключевой фактор при выборе антибиотика. Ротацеф устойчив к действию бета-лактамаз и поэтому эффективен на штаммы которые разрушают другие пенициллины и цефалоспорины.
Современные проблемы резистентности наиболее значимых возбудителей внебольничных бактериальных инфекций
|
Микроорганизмы |
Современные проблемы лечения |
|
Streptococcus pneumoniae |
Снижение чувствительности к бета-лактамам; устойчивость в пенициллину в России менее 10%. Бета-лактамы сохраняют клиническую эффективность в отношении пенициллинрезистентных пневмококков Низкая природная активность пероральных цефалоспоринов III поколения (Ротацеф- парентеральный цефалоспорин прим.) Рост устойчивости к макролидам: в Европе от 8 до 35% и выше, в России около 10%; при устойчивости возможен клинический неуспех терапии Высокая частота резистентности в России к ко-тримоксазолу и тетрациклинам (>50%) Низкая природная активность ранних фторхинолонов, в последние годы отмечено увеличение частоты резистентных штаммов; высокая активность новых фторхинолонов — клинически значимой резистентности нет |
|
Haemophilus influenzae |
Продукция бета-лактамаз в 1—40%, в России не превышает 10%; клинически амоксициллин не уступает защищенным пенициллинам Не наблюдается устойчивости к амоксициллин/клавуланату, цефалоспоринам II—IV поколения, фторхинолонам Цефалоспорины I поколения неактивны Природная активность макролидов низкая, риск бактериологического неуспеха лечения высокий Устойчивость к ко-тримоксазолу в России около 20% |
|
Moraxella catarrhalis |
Продукция бета-лактамаз в 90% и выше Незащищенные пенициллины (бензилпенициллин, ампициллин, амоксициллин) неактивны, защищенные пенициллины (амоксициллин/клавуланат) и цефалоспорины активны в 100%. Устойчивость к макролидам, тетрациклинам, ко-тримоксазолу, фторхинолонам незначима |
Как мы видели пневмококк – важнейший возбудитель респираторных инфекций, и Ротацеф имеет по сравнению с рядом других цефалоспоринов и пенициллинов ряд неоспоримых преимуществ. Конечно-же кардинальным является и период времени в течение которого Ротацеф поддерживает концентрации выше МИК 90. Это несомненно отражается на эффективности лечения.
Величина времени, превышающего МИК90 (T>МПК) для S. pneumoniae некоторых b-лактамных антибиотиков **
|
Препарат |
Режим дозирования: доза (мг)/ кратность приема в сутки |
T>МИК в % от интервала дозирования |
|||
|
PSSP |
PISP |
PRSP |
HI |
||
|
Амоксициллин/клавулановая кислота |
875/125дважды в день |
100 |
50 |
32 |
42 |
|
Цефаклор |
500/3 |
46 |
0 |
0 |
0 |
|
Цефуроксим |
500/2 |
73 |
41 |
0 |
35 |
|
Цефподоксим |
200/2 |
62 |
32 |
0 |
82 |
|
Цефиксим |
400/1 |
48 |
0 |
0 |
88 |
|
Цефтриаксон (Ротацеф) |
1 000/1 раз в день |
100 |
72 |
42 |
100 |
|
Примечание. PSSP – S. pneumoniae чувствительны к пенициллину, PISP – S. pneumoniae с промежуточной чувствительностью к пенициллину, PRSP – S. pneumoniae, резистентный к пенициллину, HI – H. influenzae. |
Правильное использование антибиотиков позволит правильно и рационально лечить ваших пациентов. Хотелось-бы отметить, что Ротацеф позволяет решить многие проблемы лечения инфекций дыхательных путей. Компания «Ротафарм» желает Вам и вашим пациентам здоровья!
*(Справочник поликлинического врача Том 03/N 1/2003 Л.И.Дворецкий, С.В.Яковлев ММА им. И.М.Сеченова)
**(Consilium Medicum Том 04/N 12/2002 А.Г.Чучалин – академик РАМН, проф., А.Н.Цой – проф., В.В.Архипов – к.м.н., Москва)
***(Consilium Medicum Том 4/N 1/2002 С.В.Яковлев, Л.И.Дворецкий, М.П.Суворова Московская медицинская академия им. И.М.Сеченова)
К неудачам антибиотикотерапии приводят неправильный выбор препарата, дозы, пути введения. К сожалению, антибиотики нередко назначают, не задумываясь о наиболее вероятном возбудителе, его чувствительности к противомикробным средствам, не учитывая результаты, полученные в контролированных клинических исследованиях.

Проблема резистентности микроорганизмов оказывает пагубное влияние на здравоохранение и всемирную экономику, и главной целью борьбы с этой проблемой является сохранение человечества.
Основная причина развития устойчивости микробов — ненадлежащее применение антимикробных средств:
- в случае заболеваний, при которых они изначально неэффективны;
- при самостоятельном выборе антибиотика пациентом-непрофессионалом;
- при несоблюдении предписанного врачом режима приема антибиотика;
- при излишнем (когда они уже (или еще) не нужны) назначении антибиотиков специалистами.
Итак, выбор антибиотика зависит от инфекционного заболевания. Этиотропная терапия (после микробиологического определения возбудителя и его чувствительности к антибиотикам) обычно назначается лишь при неудаче эмпирической.
В лечении предпочтительны наиболее эффективные, приемлемые по цене и наименее токсичные антибиотики. Выбор зависит от локализации инфекции (антибиотик должен поступать в ее очаг). При наличии энтеральных и парентеральных форм у одного и того же антибиотика выбор диктуется тяжестью заболевания. При более тяжелой инфекции — парентерально, в менее тяжелых случаях достаточно назначения препаратов внутрь (ступенчатая терапия — переход от парентеральных форм к пероральным).
Учитывается состояние организма больного: иммунитет, функция печени, почек, беременность, возраст и др. Предпочтительно назначение антибиотиков максимально узкого спектра, чтобы не подавлять нормальную микрофлору организма. Комбинируются антибиотики для усиления эффекта, профилактики устойчивости с учетом возможности осложнений (аллергия, токсичность, суперинфекции вследствие дисбактериоза).
Необходимо правильно подобрать:
- разовую и курсовую дозы химиотерапевтического средства;
- частоту введения;
- длительность курса (оценивать лечебный эффект следует только после 3–4 дней);
- химиотерапия должна назначаться до полного клинического выздоровления (обычно все дни болезни плюс 1–2 дня после исчезновения симптомов).
Несмотря на то что эмпирический выбор антибиотиков положен в основу их назначения, бактериологическое исследование, когда это представляется возможным, должно обязательно проводиться. Помимо прямой пользы для данного пациента, например, при неэффективности стартовой терапии и необходимости смены антибиотиков, это позволит получать и накапливать эпидемиологические данные о структуре возбудителей и, что наиболее важно, их чувствительности к антибиотикам.
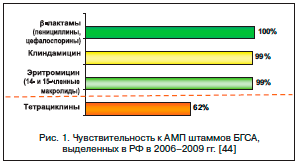
Основными бактериальными возбудителями острых инфекций в оториноларингологии являются пневмококк (Streptococcus pneumoniae) и гемофильная палочка (Haemophilus influenzae). Гораздо реже выделяют моракселлу (Мoraxella catarrhalis), β-гемолитический стрептококк группы А (БГСА, S. pyogenes).
Дети до 2 лет с острым средним отитом, по мнению большинства специалистов, должны получать антибиотики во всех случаях. Если состояние ухудшается через 24 ч, то это может свидетельствовать о развитии гнойных осложнений, требующих немедленного обращения к врачу. При инфекциях лор-органов у детей старше 2 лет без выраженных симптомов интоксикации, болевого синдрома, температуры выше 38 °С в течение суток можно ограничиться симптоматической терапией. Однако при сохранении симптомов или отсутствии улучшения в течение 24 ч необходимо назначить антибиотики.
При использовании местных деконгестантов (МД) более 5 дней развивается медикаментозный ринит. Поэтому западные рекомендации не разрешают использовать МД даже более 3 дней. Отечественные клинические протоколы разрешают (например, при синусите — в течение 5–7 дней).
Также следует учитывать, что попытки заменить прием антибиотиков внутрь местными антибактериальными препаратами или препаратами с иммуностимулирующей активностью, декларируемой производителями, представляются необоснованными, так как нет достоверных клинических данных, показывающих эффективность этих препаратов.
Принимая во внимание важность проблемы рациональной антибиотикотерапии, в Беларуси приняты соответствующие нормативные документы. Это приказ Минздрава «О мерах по снижению антибактериальной резистентности микроорганизмов», который содержит таблицы по эмпирической терапии бактериальных инфекций. Издаются и обновляются стандарты лечения инфекций, относящихся к отдельным врачебным дисциплинам.
Например, по лор-болезням имеется Клинический протокол от 25.05.2018 № 46 «Диагностика и лечение пациентов (детское население) с болезнями уха, горла и носа» и Клинический протокол от 01.06.2017 № 49 «Диагностика и лечение пациентов с оториноларингологическими заболеваниями» (взрослое население). Однако из-за развития резистентности микробов протоколы неминуемо обречены на отставание от реальной жизни, поэтому врачи-специалисты должны вести постоянный мониторинг медицинской литературы.
Эмпирическая антибиотикотерапия острых синуситов
Этиология синусита определяется главным образом пневмококком и гемофильной палочкой (по 1/3 случаев), также присутствуют вирусы (15–18 %), моракселла (9 %), золотистый стафилококк (10 %), анаэробы (6 %), БГСА (2 %). Наиболее часто встречается неинфекционный синусит (воспаление, аллергия) вследствие нарушения оттока из пазух. Лечение — промывание солевым раствором. Критерии для назначения антибиотиков: лихорадка, боль, гнойное отделяемое из носа, отсутствие улучшений без антибиотика в течение 10 дней.
Далее приведены стандарты лечения острых инфекций лор-органов по клиническим протоколам, упомянутым выше. Для большей наглядности после описания лечения из отечественных клинических протоколов в квадратных скобках приведены стандарты лечения соответствующих заболеваний, принятые в США.
Дети. Клинический протокол от 25.05.2018 № 46 рекомендует:
Амоксициллин 40 мг/кг/сут внутрь в 3 приема в течение 7–10 дней [амоксициллин 90 мг/кг/сут в 2 приема в течение 10–14 дней] или амоксициллин/клавулановая кислота 40–45 мг/кг/сут (по амоксициллину) внутрь в 2–3 приема 7–10 дней [амоксициллин/клавулановая кислота 45 мг/кг/сут используется только при уверенности в отсутствии устойчивой флоры, в остальных случаях — 90 мг/кг/сут за 2 приема в течение 10–14 дней].
При аллергии на бета-лактамные антибиотики — пенициллины: азитромицин 10 мг/кг/сут за 1 прием 3–5 дней или кларитромицин15 мг/кг/сут внутрь 2 раза в сутки 5–7 дней [макролидов следует избегать из-за частой резистентности микробной флоры]. Также зарубежные источники указывают, что у детей при аллергии (нафилактоидные реакции) на пенициллины применяют клиндамицин 30–40 мг/кг/сут за 3 приема в течение 10–14 дней.
Однако при подозрении на наличие гемофильной палочки или моракселлы, устойчивой к клиндамицину, надо добавлять второй антибиотик (пероральные цефалоспорины). Если присутствует аллергия на пенициллины, но без симптомов анафилаксии, то детям назначают цефподоксим 10 мг/кг/сут за 2 приема. Вспомогательное лечение — назальные деконгестанты курсом до 3 дней, солевые орошения, в то же время не прослеживается четкого положительного результата от назначения назальных стероидов и антигистаминных средств.
Взрослые. Клинический протокол от 01.06.2017 № 49 рекомендует:
Амоксициллин по 500 мг 3–4 раза в сутки внутрь 7–10 дней [в рекомендациях США он есть только для детей], амоксициллин/клавулановая кислота по 1 г 2 раза в сутки внутрь 7–10 дней [в зарубежных рекомендациях — по 2 г 2 раза в сутки 5–7 дней].
Цефалоспорины 2–3-го поколения: цефуроксим аксетил по 250–500 мг 2 раза в сутки внутрь 7 дней, цефиксим по 400 мг 1 раз в сутки внутрь 7–14 дней [из 3-го поколения цефалоспоринов в зарубежных рекомендациях присутствуют также цефподоксим (200 мг 2 р/сут), цефдинир и цефпрозил].
Макролиды (например, азитромицин по 500 мг 1 раз в сутки внутрь 5 дней, кларитромицин по 0,5–1,0 г 1–2 раза в сутки внутрь 5–7 дней) [из-за очень распространенной резистентности микробов к макролидам в США они не рекомендуются в качестве препаратов выбора].
Хинолоны 3–4-го поколения (левофлоксацин по 0,5 г однократно в сутки, курс от 10 до 14 дней, моксифлоксацин) [хинолоны применяются как препараты резерва (при анафилактоидных реакциях на пенициллины или при отсутствии результатов после 3 дней лечения); левофлоксацин в дозе 750 мг курсом 5 дней эквивалентен левофлоксацину 500 мг 14 дней; хинолоны 4-го поколения: моксифлоксацин 400 мг/сут].
За рубежом возможно также лечение доксициклином 100 мг 2 р/сут и (тяжелого синусита) цефтриаксоном.
Резерв (MRSA) — оксазолидиноны (например, линезолид по 600 мг 2 раза в сутки внутрь 10 дней).
Примечание. Следует особо отметить, что в США на ранних этапах лечения острого синусита придают огромное значение промыванию слизистой оболочки носа солевыми растворами, т. к. это способствует восстановлению оттока из пазух.
Эмпирическая антибиотикотерапия острых тонзиллитов/фарингитов
Дети. По отечественным клиническим протоколам лечение проводится аналогично лечению синуситов, т. е. из пенициллинов используют амоксициллин или амоксициллин/клавуланат, а также макролиды.
Зарубежные рекомендации (при предполагаемой стрептококковой этиологии): пенициллины — амоксициллин 50 мг/кг/д 1 р/д (max 1 000 мг/д) в течение 10 дней или феноксиметилпенициллин — детям до 12 лет 25–50 мг/д за 3–4 приема в течение 10 дней, детям >12 лет — доза взрослых. Макролиды — азитромицин 12 мг/кг 1 р/д 5 дней, кларитромицин 15 мг/д за 2 приема 10 дней. (По отечественным протоколам: азитромицин 10 мг/кг/д, а кларитромицин принимают 5–7 дней).
Пероральные цефалоспорины (зарубежные рекомендации, в отечественных протоколах цефалоспоринов для эмпирической терапии нет) — при остром или рецидивирующем заболевании стрептококковой этиологии: цефдинир (7 мг/кг 2 р/д в течение 5 дней) или цефподоксим (10 мг/кг/д за 2 приема 5 дней).
Взрослые. в отечественных клинических протоколах антибиотики для системного применения не упоминаются. Согласно зарубежным рекомендациям, пенициллины: бензатинпенициллин 1,2 млн ЕД в/м однократно или феноксиметилпенициллин 500 мг 2 р/д в течение 10 дней или макролиды (азитромицин 500 мг 1 р/д 3 дня, кларитромицин 250 мг 2 р/д 10 дней) или цефалоспорины — цефдинир (300 мг 2 р/д 5 дней) либо цефподоксим (100 мг 2 р/д 5 дней).
Примечания.
1. При стрептококковой этиологии у детей и взрослых в США также применяют все пероральные цефалоспорины 2-го поколения. Курс лечения: 4–6 дней.
2. При наличии анаэробной инфекции Fusobacterium necrophorum назначается амоксициллин/клавуланат или клиндамицин (детям — 20–30 мг/д за 3 приема, взрослым — 300 мг 3 р/д 10 дней) либо метронидазол. Макролиды при Fusobacterium necrophorum неэффективны!
3. Важно не спутать острый тонзиллит/фарингит (при нем сохранена чувствительность флоры к пенициллинам, разрушающимся бета-лактамазой) с рецидивирующим.
Эмпирическая антибиотикотерапия острого среднего отита (ОСО)
Взрослые. Клинический протокол от 01.06.2017 № 49 рекомендует:
Амоксициллин/клавулановая кислота по 1 г 2 раза в сутки внутрь 7–10 дней [по 2 г 2 р/д].
Цефалоспорины 2-го и 3-го поколения упоминаются только при хроническом гнойном отите: пероральные (цефуроксим аксетил 250–500 мг 2 раза в сутки 7 дней или цефиксим 400 мг в сутки 7–14 дней). При ОСО детализации выбора цефалоспоринов в клиническом протоколе нет, присутствует фраза «стартовая терапия бета-лактамные антибиотики». [Выбор пероральных цефалоспоринов в США более широкий.
Кроме вышеперечисленных также цефподоксим, цефдинир, цефпрозил. Следует учесть, что пероральные цефалоспорины рекомендуют только при отсутствии приема антибиотиков в предыдущий месяц. В ином случае предпочтителен цефтриаксон в/м. Цефтриаксон в США назначают по 1 г/д 3 дня. Перорально антибиотики принимают 5–7 дней, а при тяжелых формах ОСО и у детей < 2 лет — 10 дней].
Макролиды (например, азитромицин внутрь 500 мг 1 р/сут 5 дней) [в США из-за широкой распространенности резистентных штаммов пневмококка и гемофильной палочки их рекомендуют только при невозможности назначить бета-лактамы].
Хинолоны 3-го поколения (левофлоксацин по 0,5 г однократно в сутки, курс от 10 до 14 дней) [левофлоксацин может применяться в большей дозе (750 мг) и коротким курсом (5 дней); высокоэффективный препарат резерва].
Резерв (MRSA) — оксазолидиноны (например, линезолид по 600 мг 2 раза в сутки внутрь 10 дней).
Дети. Согласно отечественным протоколам, у детей острый средний отит лечится подобно синуситу и тонзиллофарингиту [зарубежные рекомендации — см. лечение ОСО у взрослых].
Выводы. Согласно современной мировой практике, при антибиотикотерапии острых инфекций лор-органов стартовая терапия в большинстве случаев — амоксициллин/клавуланат в высоких дозах. В то же время макролиды постепенно теряют значение при этих инфекциях из-за развития к ним устойчивости микробной флоры. Важную роль в качестве альтернативы стартовой терапии (в т. ч. у детей) играют пероральные цефалоспорины 2-го (цефуроксим аксетил и др.) и 3-го поколения (цефподоксим и др.).
При проведении антибиотикотерапии, согласно зарубежным рекомендациям, прослеживается тенденция увеличения разовой и суточной дозы препаратов (но не длительности курса лечения!). Тяжелые формы острых лор-инфекций успешно лечатся цефтриаксоном и фторхинолонами — хинолонами 3-го (левофлоксацин) или 4-го (моксифлоксацин) поколения.
Пациентка Д., 36 лет, в анамнезе начиная со студенческих лет 5 эпизодов острого синусита (всегда лечилась амоксициллином/клавуланатом), заболела острым средним отитом. Назначение амоксициллина/клавуланата 10-дневным курсом по 1 г 2 р/д оказалось неэффективным — сохранялись субфебрильная температура и болевые ощущения в области правого уха.
Назначение макролида (азитромицин 500 мг 1 р/д в течение 5 дней) также оказалось безуспешным. Тогда ей был рекомендован левофлоксацин (750 мг 1р/д в течение 5 дней). Он оказался эффективен — симптомы отита исчезли уже на второй день лечения.
Из этого случая можно сделать вывод о формировании устойчивости микробной флоры не только к макролидам, но и к амоксициллину/клавуланату при его повторных назначениях у пациентов с лор-инфекциями.
Неправильное назначение антибактериальных препаратов (антибиотиков) может привести к серьезным медицинским последствиям и оказать существенное влияние не только на течение заболевания, но и на формирование антибиотикорезистентности
Антибиотикорезистентность. Современный взгляд на проблему
С расширением арсенала антибактериальных препаратов основной проблемой становится рациональный выбор лекарственного средства, оказывающего наибольшее терапевтическое и наименьшее токсическое действие. Стратегической задачей антибиотикотерапии является уменьшение селекции и распространения резистентных штаммов микроорганизмов в популяции. Развитию антибиотикорезистентности способствуют неадекватный доступ к лекарствам и появление на рынке некачественных, но дешевых препаратов.
Не стоит думать, что антибиотикорезистентность — это современная проблема. Устойчивость к антибиотикам существовала всегда и может быть истинной или приобретенной. Под приобретенной устойчивостью подразумевают свойство отдельных штаммов бактерий сохранять жизнеспособность при минимальных концентрациях антибиотиков, которые подавляют основную часть микробной популяции. Развитие у бактерий приобретенной резистентности не обязательно сопровождается снижением клинической эффективности антибактериальных препаратов. Формирование резистентности во всех случаях обусловлено генетически — приобретением новой генетической информации или изменением уровня экспрессии собственных генов. Известны следующие биохимические механизмы устойчивости бактерий к антибиотикам: модификация мишени действия, инактивация антибиотика, активное выведение его из микробной клетки (эффлюкс), нарушение проницаемости внешних структур микробной клетки, формирование метаболического шунта.
Не допустить ошибок
Серьезной ошибкой при проведении антибактериальной терапии является неправильный выбор антибактериального препарата. Назначая антибиотик, врач должен учитывать спектр его антимикробной активности, региональный уровень резистентности к нему возбудителей, его доказанную эффективность в контролируемых клинических исследованиях и безопасность.
При выборе антибиотика необходимо учитывать уровень резистентности основных возбудителей в популяции. Так, к основным возбудителям инфекций дыхательных путей относятся S. pneumoniae, H. Influenzae и S. pyogenes. Анализ данных клинических исследований с учетом региональной резистентности свидетельствует о том, что в данное время оптимальные средства для лечения внебольничных респираторых инфекций — бета-лактамные антибиотики и фторхинолоны. Даже учитывая тот факт, что S. pyogenes и другие стрептококки не способны вырабатывать бета-лактамазы, амоксициллин является клинически неэффективным препаратом, особенно при хронических воспалениях, так как присутствующие в тканях небных миндалин копатогены, такие как H. Influenzae и S. Aureus, способны вызывать гидролиз пенициллинов. Поэтому при лечении рецидивирующего тонзиллита предпочтение следует отдавать защищенным пенициллинам (амоксициллин/клавуланат). Увеличение частоты встречаемости S. pneumoniae, устойчивых к пенициллину, и бета-лактамазопродуцирующих штаммов H. influenzae ограничивает эффективность традиционно назначаемых в таких случаях антибиотиков первого ряда. С учетом этих обстоятельств все большее внимание при выборе антибактериальных препаратов для лечения воспалительных заболеваний околоносовых пазух и среднего уха в последние годы уделяют современным макролидам, в частности азитромицину, который демонстрирует активность в отношении большинства наиболее вероятных возбудителей инфекций ЛОР-органов (S. рneumoniae, S. pyogenes, M. catarrhalis). В отличие от других макролидов, азитромицин также проявляет клинически значимую активность в отношении Н. Influenzae — одного из основных возбудителей острого среднего отита и острого бактериального синусита.
О различных эффектах антибиотиков, помимо антибактериального, читайте: Побочное действие лекарств — во благо?
Необоснованное назначение антибактериальных препаратов — одна из наиболее распространенных тактических ошибок. Показанием к применению антибиотиков является выявленная или предполагаемая бактериальная инфекция. Частая ошибка в амбулаторной практике, наблюдаемая в 30–70% случаев, — назначение антибактериальных препаратов при вирусных инфекциях. Поэтому при острых заболеваниях верхних дыхательных путей, как правило, вирусной этиологии (ларингит, ринит, трахеит), проведение антибактериальной терапии нецелесообразно. В большинстве случаев назначение антибиотиков не показано при остром бронхите. Их неоправданное применение повышает риск возникновения у пациентов побочных реакций.
Нередко допускают ошибки при выборе оптимальной дозы и кратности приема антибактериального препарата. Низкая доза не обеспечит содержание антибиотика в крови и тканях дыхательных путей, превышающее минимальную подавляющую концентрацию, что не позволит достичь эрадикации соответствующего возбудителя инфекции и создаст реальные предпосылки для формирования резистентности микроорганизмов.
Одной из ошибок антибактериальной терапии респираторных инфекций является необоснованное назначение комбинированных антибиотиков. При наличии широкого арсенала высокоэффективных антибактериальных препаратов широкого спектра действия показания к комбинированному лечению значительно сужены, и приоритет в борьбе со многими инфекциями остается за монотерапией. Основные показания к проведению комбинированной антибактериальной терапии — тяжелое течение пневмонии и наличие у пациента модифицирующих факторов. Частой ошибкой также является неоправданное назначение антибиотиков в комбинации с противогрибковыми средствами с целью профилактики дисбактериоза. Следует учитывать, что при использовании современных антибиотиков у пациентов без серьезных нарушений иммунитета риск развития грибковой суперинфекции минимален.
Ошибки, связанные с длительностью антибактериальной терапии, особенно часто встречаются в педиатрической практике. Прежде всего, это обусловлено непониманием цели самой антибактериальной терапии, которая должна быть направлена на подавление микробной агрессии.
Важные показатели
Основным критерием эффективности лечения больных является уменьшение проявлений интоксикации и снижение температуры тела при отсутствии признаков дыхательной недостаточности через 48–72 часа после начала антибактериальной терапии. При наличии положительной динамики терапию следует продолжать назначенным антибактериальным препаратом. Если интоксикация и лихорадка сохраняются, проводят коррекцию лечения. Антибактериальную терапию прекращают при достижении стойкой нормализации температуры тела в течение 3–5 суток. При этом возможно сохранение у пациента жалоб на общую слабость, потливость, в некоторых случаях субфебрильную температуру тела (обусловлена постинфекционной вегетативной дисфункцией). Остаточные изменения на рентгенограмме — кашель, сухие хрипы, увеличенная СОЭ — могут сохраняться длительное время, но в большинстве случаев не являются показателями персистенции инфекции и не требуют применения антибиотиков.
Александр Шмагин
По материалам статьи Дяченко В.В. Тактические ошибки антибактериальной терапии инфекций дыхательных путей // Therapia. Український медичний вісник. — 2011. — № 10 (62)
«Фармацевт Практик» #07–08′ 2012
Ключевым фактором рационального использования лекарственных средств (ЛС) является качество информации, которой оперируют практические врачи. Грамотное назначение антимикробных препаратов (АМП) – уникального класса ЛС имеет особое значение, поскольку нерациональное применение антибиотиков приводит не только к неблагоприятным последствиям для отдельного пациента, но и представляет угрозу для общества в целом, являясь одной из основных причин возникновения антибиотикорезистентности микроорганизмов [1]. Антибиотикорезистентные микроорганизмы представляют опасность как для пациента, у которого они были выделены, так и для многих других людей, даже разделенных временем и пространством. Устойчивость бактерий к антибиотикам является большим препятствием для лечения инфекционных заболеваний, которое оборачивается не только неудачами в терапии, но и ростом расходов на здравоохранение [2]. В США устойчивость к антибиотикам приводит к дополнительным ежегодным затратам на сумму более чем в 100 млн долларов. Но есть и иные затраты – в человеческом выражении. Инфекции, вызываемые резистентными бактериями, обычно ведут к затяжному течению заболевания, частой и более длительной госпитализации и более высокой смертности [3–5]. Игнорирование проблемы антибиотикорезистентности чревато не только медицинскими, но и серьезными экологическими последствиями [6, 7].
Ключевым фактором рационального использования лекарственных средств (ЛС) является качество информации, которой оперируют практические врачи. Грамотное назначение антимикробных препаратов (АМП) – уникального класса ЛС имеет особое значение, поскольку нерациональное применение антибиотиков приводит не только к неблагоприятным последствиям для отдельного пациента, но и представляет угрозу для общества в целом, являясь одной из основных причин возникновения антибиотикорезистентности микроорганизмов [1]. Антибиотикорезистентные микроорганизмы представляют опасность как для пациента, у которого они были выделены, так и для многих других людей, даже разделенных временем и пространством. Устойчивость бактерий к антибиотикам является большим препятствием для лечения инфекционных заболеваний, которое оборачивается не только неудачами в терапии, но и ростом расходов на здравоохранение [2]. В США устойчивость к антибиотикам приводит к дополнительным ежегодным затратам на сумму более чем в 100 млн долларов. Но есть и иные затраты – в человеческом выражении. Инфекции, вызываемые резистентными бактериями, обычно ведут к затяжному течению заболевания, частой и более длительной госпитализации и более высокой смертности [3–5]. Игнорирование проблемы антибиотикорезистентности чревато не только медицинскими, но и серьезными экологическими последствиями [6, 7].
Согласно определению ВОЗ, рациональное использование ЛС – это правильное, соответствующее и надлежащее использование ЛС. Рациональное использование означает, что пациенты получают надлежащие лекарственные препараты в правильных дозировках, на соответствующий период времени и с наименьшими затратами для себя и общества [8]. Что касается АМП, то ВОЗ определяет разумное применение антибиотиков как «оптимальный выбор АМП с точки зрения соотношения стоимость/эффективность, который обеспечивает максимальный терапевтический эффект, и минимальные токсичность, связанную с применением ЛС, и развитие антимикробной резистентности [9]».
Следует отметить, что именно антибиотики являются практически единственной группой ЛС, которая почти в 50% случаев применяется нерационально и необоснованно [7]. Еще в 1970 г. И.А. Кассирский писал о проблеме резистентности микроорганизмов: «…Антибиотики продолжают действовать. Чаще всего в резистентности виноваты больные или врачи – надо уметь применять антибиотики…» [11].
Действительно, нерациональное и необоснованное назначение АМП может исходить от самих пациентов, когда они применяют антибиотики у себя, своих детей или родственников самостоятельно, без предшествующей врачебной консультации. Нередко в таких случаях пациенты копируют врачебную тактику и применяют АМП по тем же показаниям, по которым их ранее назначал врач. Пациенты в большинстве случаев используют самолечение антибиотиками при состояниях, не требующих их применения, а именно при острых респираторных инфекциях, которые чаще всего имеют вирусную этиологию, при кашле, расстройстве кишечника, в качестве противовоспалительных и жаропонижающих препаратов, при болях в горле и животе и т. д. [12].
Нередко АМП применяются по совету провизоров, когда работники аптек дают рекомендации по приобретению не только безрецептурных препаратов, но и антибиотиков, относящихся к строго рецептурным ЛС [13]. Эта проблема не является исключительно российской. В других странах именно фармацевтические работники – один из основных источников получения пациентами антибиотиков без назначения врача: 31% случаев в исследовании М. McKee [14], 41% случаев в исследовании M.H. Väänänen [16], 53,6% случаев в исследовании F.A. Sawair [15].
Нерациональное и необоснованное назначение АМП может исходить от врачей в тех случаях, когда антибиотики назначаются при отсутствии показаний; когда состояние пациента требует назначения антибактериальной терапии (АБТ), но неправильно выбираются препарат, способ и кратность введения, назначаются некорректные дозы или длительность терапии, не учитываются возможные лекарственные взаимодействия, неправильно оценивается эффективность терапии и т. д. Немаловажное значение имеет отношение населения: врач может грамотно выбрать и препарат, и корректную дозу, и необходимую длительность терапии, но пациенты не следуют этим назначениям врача.
Во многих случаях ошибки при назначении АБТ обусловлены распространенными среди врачей мифами и заблуждениями в отношении АМП в целом.
Приведем некоторые наиболее популярные заблуждения относительно антибиотиков.
Миф 1. Длительность АБ терапии должна составлять не менее 10–14 дней
Современный арсенал АМП включает препараты, используемые короткими курсами и даже однократно (3–5-дневные курсы азитромицина при внебольничных инфекциях дыхательных путей, а именно при остром стрептококковом тонзиллофарингите [17–19], остром среднем отите [20, 21], остром бактериальном риносинусите [23–25], внебольничной пневмонии [26–28]; однократное применение фосфомицина трометамола или использование фторхинолонов в течение 3-х дней при лечении острого неосложненного цистита [32], однократное использование азитромицина для лечения неосложненной хламидийной инфекции [33–35], азитромицина или цефтриаксона при неосложненной гонорее [36], короткие (1–3 дня) курсы цефтриаксона при остром среднем отите [37] и т. д.).
В то же время существуют заболевания и состояния, при которых длительность АБТ значительно превышает стандартные 10–14 дней и может составлять несколько недель и даже месяцев: например, туберкулез, хронический остеомиелит, хронический простатит, гнойный перикардит, бактериальный эндокардит и др. [38].
Не следует продолжать курс АБ терапии до полного купирования симптомов заболевания, нормализации скорости оседания эритроцитов (СОЭ), рентгенологической картины, заживления раны и т. д. Например, при остром неосложненном цистите лейкоцитурия и дизурия сохраняются на 3-й день лечения норфлоксацином у 78 и 52,5% пациенток соответственно. Однако это не является показанием для назначения более длительного курса АМП, поскольку основной критерий эффективности лечения – бактериурия купируется к этому времени у 94% пациенток [39]. СОЭ вообще является неспецифическим показателем, не позволяющим оценивать наличие, выраженность и динамику инфекционного процесса [40]. При внебольничной пневмонии субфебрильная температура (37,0–37,5°С) при отсутствии других признаков бактериальной инфекции может быть проявлением неинфекционного воспаления или постинфекционной астении (вегетативной дисфункции) и не является показанием для продолжения АБТ или замены АМП [31]. Остаточные изменения на рентгенограмме могут сохраняться в течение 1–2 мес., хрипы при аускультации – в течение 3–4 нед., сухой кашель, особенно у курящих, пациентов с хронической обструктивной болезнью легких (ХОБЛ) – в течение 1–2 мес. [31].
Миф 2. АМП необходимо менять каждые 5–7 дней, чтобы у возбудителя не возникла резистентность
Появление и распространение устойчивости микроорганизмов к антибиотикам – антибиотикорезистентности действительно представляет собой серьезную проблему для проведения эффективной АБТ. Оценку клинической эффективности лечения следует проводить через 48–72 ч после назначения АМП [31, 38], и при клинической неэффективности незамедлительно менять антибиотик, не дожидаясь 5–7-го дня терапии. Если препарат эффективен, то в замене его на 5–7-й день нет необходимости, а при такой смене АМП или незавершенном курсе АБТ как раз и повышается риск формирования антибиотикорезистентности у микроорганизмов [41]. Несомненно, существуют и другие показания для замены АМП даже на фоне эффективной терапии, например, развитие тяжелых нежелательных лекарственных реакций, требующих отмены препарата, либо высокая потенциальная токсичность антибиотика, ограничивающая длительность его применения, однако данные ситуации возникают в клинической практике редко и являются скорее исключением, чем правилом.
Миф 3. Есть сильные и слабые антибиотики
Многие врачи полагают, что бесполезно применять пенициллины, поскольку это «устаревшие» и «слабые» АМП, к которым за 60 лет все микроорганизмы стали устойчивыми. Несомненно, проблема антибиотикорезистентности очень актуальна как для России, так и для всего мира. В то же время β-гемолитический стрептококк группы А (БГСА) Streptococcus (S.) pyogenes – возбудитель тонзиллофарингита, скарлатины, рожистого воспаления, стрептодермий отличается высокой чувствительностью к β-лактамам (пенициллинам и цефалоспоринам). Эти антибиотики остаются единственным классом АМП, к которым у S. pyogenes не появилась резистентность. Исходя из этого все руководства по лечению острого стрептококкового тонзиллофарингита в качестве «золотого стандарта» рекомендуют пенициллины (феноксиметилпенициллин или амоксициллин) [18, 19, 42, 43].
По данным многоцентрового проспективного микробиологического исследования ПеГАС «Мониторинг антибиотикорезистентности пневмококков, гемофил и пиогенных стрептококков в различных регионах России» за период с 1999 по 2009 г. [44], все штаммы БГСА обладали высокой чувствительностью к пенициллину. В то же время на протяжении всего этого 10-летнего периода сохранялся высокий уровень резистентности S. pyogenes к тетрациклину (45,8% в 1999–2003 гг. и 33,9% в 2007–2009 гг.) (рис. 1).
Крайне важно учитывать региональные данные по антибиотикорезистентности различных возбудителей. Так, в Европе весьма актуальна проблема резистентности пневмококков (S. pneumoniae) к пенициллину, которая, по данным Европейской системы по надзору за антимикробной резистентностью (European Antimicrobial Resistance Surveillance System – EARSS), в 2012 г. в 9 из 29 стран – участниц данной системы мониторинга варьировала от 10 до 25%, а в 4 странах составляла 25–50% [45]. В то же время, согласно исследованию ПеГАС-III, проведенному в 2006–2009 гг., среди штаммов пневмококка, выделенных на территории РФ за указанный период, изоляты с промежуточным уровнем резистентности к пенициллину составили 9,1%, а с высоким уровнем – 2,1%, т. е. общая доля нечувствительных штаммов достигла 11,2% (рис. 2) [46].
Таким образом, пенициллины и аминопенициллины (пенициллин, амоксициллин, амоксициллин/клавуланат) сохраняют активность в отношении S. pneumoniae и не утратили своего клинического значения.
Необходимо помнить, что неоправданно широкое назначение «новых» АМП при сохранении чувствительности к «старым» препаратам может привести к неблагоприятным последствиям с точки зрения возникновения и распространения антибиотикорезистентности. Так, результаты целого ряда исследований продемонстрировали неодинаковую способность различных АМП вызывать появление и распространение к ним резистентности среди различных возбудителей. В частности, распространение пенициллинорезистентных штаммов S. pneumoniae коррелирует с ростом использования пероральных цефалоспоринов для лечения респираторных инфекций, при этом применение препаратов пенициллинового ряда обычно не вызывает такого эффекта [47].
В Нидерландах преимущественное использование для лечения «старых» препаратов с узким спектром антимикробного действия многие годы тщательно изучалось в нескольких медицинских учреждениях, и данная стратегия стала основой принципов рационального применения антибиотиков [48]. В Дании, являющейся одной из стран с наиболее низким уровнем антибиотикорезистентности, в большинстве случаев предпочтение отдается этим же препаратам [49].
Миф 4. 16-членные макролиды обладают преимуществами с микробиологической точки зрения над 14- и 15-членными макролидами в отношении S. pyogenes и S. pneumoniae
16-членные макролиды действительно могут сохранять активность in vitro против некоторых штаммов S. pyogenes и S. pneumoniae, резистентных к 14- и 15-членным макролидам. Дело в том, что описаны 2 основных механизма приобретенной резистентности данных микроорганизмов к макролидам: 1) модификация (метилирование или мутация) мишени действия (50S-субъединицы бактериальной рибосомы), что нарушает связывание с ней макролидных антибиотиков, и 2) активное выведение (эффлюкс) антибиотика из бактериальной клетки [50, 51].
Первый механизм обусловлен метилированием 23S-рибосомальной РНК под действием особых ферментов – бактериальных метилаз, кодируемых erm-генами, и обозначается как MLSB-тип резистентности. Этот тип резистентности обусловливает устойчивость бактерии ко всем макролидам (14-, 15- и 16-членным) и, кроме того, к линкозамидам. Второй механизм резистентности – эффлюкс, получивший название М-фенотипа, характерен прежде всего для стрептококков (БГСА, пневмококки). Существенно, что выведению из клетки подвергаются только 14- и 15-членные макролиды, а 16-членные сохраняют свою активность. Распространенность различных фенотипов резистентности среди разных видов микроорганизмов может значительно варьировать в различных странах и регионах. В частности, известно, что в США более распространен М-фенотип резистентности (составляет около 60% среди резистентных штаммов), а в большинстве стран Европы – MLSB-тип [52]. Эти механизмы могут встречаться как по отдельности, так и в комбинации, и эти данные следует учитывать при выборе АМП и прогнозировании эффективности лечения.
Если говорить о нашей стране, то, по данным последнего многоцентрового исследования ПеГАС-III (2006–2009 гг.), резистентность штаммов S. pneumoniae к линкозамидам и к 14-, 15-, 16-членным макролидам составляет около 5% [46]. Таким образом, на настоящий момент резистентность пневмококков к макролидам не является проблемой для нашей страны, кроме того, судя по фенотипу резистентности, на территории РФ у S. pneumoniae превалирует MLSB-тип резистентности.
Что касается данных о чувствительности S. pyogenes, то по результатам того же проспективного микробиологического исследования ПеГАС были отмечены достаточно существенные различия в чувствительности S. pyogenes к макролидам в различные временные интервалы (табл. 1). Однако по данным последнего этапа исследования ПеГАС-III (2006–2009 гг.) 99% штаммов БГСА были чувствительны к эритромицину и клиндамицину [44].
Принимая во внимание отсутствие различий в чувствительности к макролидам и линкозамидам в РФ в 2006–2009 гг., можно сделать несколько основных выводов:
1. Резистентность к макролидам у пневмококков и БГСА в РФ не является проблемой.
2. На основании полученных данных и предполагаемых механизмов резистентности линкозамиды и 16-членные макролиды (джозамицин, мидекамицин) не имеют никаких микробиологических преимуществ перед 14- и 15-членными макролидами в отношении S. pneumoniae и S. pyogenes.
Миф 5. Антибиотики очень токсичны,
и их применение требует обязательного назначения «препаратов прикрытия»
Как среди врачей, так и среди населения бытует мнение, что антибиотики токсичны, вызывают аллергию и угнетают иммунитет, поэтому организму требуется несколько месяцев для «восстановления» нормального состояния и необходимо назначение антигистаминных, иммуностимулирующих/иммунокорригирующих, общеукрепляющих, витаминных и ряда других сопутствующих препаратов.
Возможно, данное заблуждение возникло в «раннюю эру» АБТ, когда используемые АМП (хлорамфеникол, аминогликозиды, сульфаниламиды, тетрациклины) действительно были токсичны и нередко вызывали нежелательные лекарственные реакции. В настоящее время в распоряжении врачей имеются эффективные препараты с благоприятным профилем безопасности. Все АМП, способные вызвать иммуносупрессию у человека, отсеиваются еще на стадии доклинических исследований [53]. Более того, у некоторых групп АМП (например, у азитромицина), наоборот, обнаружено благоприятное действие на иммунную систему: воздействие на синтез цитокинов/хемокинов, влияние на нейтрофилы, фагоцитоз, хемотаксис, усиление активности нормальных киллерных клеток, усиление апоптоза и мукоцилиарного клиренса, снижение секреции слизи бокаловидными клетками, уменьшение выраженности бронхиальной обструкции [54–56].
Нередко врачи полагают, что на фоне АБТ необходимо назначение сопутствующих ЛС, а именно так называемых «препаратов прикрытия» – «десенсибилизирующей» терапии (антигистаминных препаратов, тиосульфата натрия, кальция глюконата, кальция хлорида), противогрибковых препаратов (нистатин внутрь для профилактики развития кандидоза) и иммуностимулирующей/иммунокорригирующей терапии. Так, в 5 городах России в 2000 г. были проанкетированы участковые терапевты и пульмонологи городских поликлиник. Отвечая на вопрос о других группах ЛС для лечения пациентов с внебольничной пневмонией, более половины врачей отмечали целесообразным назначение одновременно с антибиотиками витаминов (59%) и антигистаминных препаратов (56%); 48% – противогрибковых ЛС, таких как нистатин, 34,4% – иммуномодуляторов, 11,2% – нестероидных противовоспалительных препаратов [57]. Антигистаминные препараты получали 16,9% пациентов при обострении ХОБЛ (проанализировано 1116 случаев амбулаторного лечения), при остром среднем отите – 44,1% (n=1489), а при остром синусите – 59,2% (n=1529) [58]. В то же время клинических исследований, доказывающих эффективность применения антигистаминных препаратов у пациентов с острым риносинуситом, нет [59, 60]. Антихолинергический эффект антигистаминных препаратов I поколения может нарушать естественный мукоцилиарный клиренс из-за сгущения слизи, вызывать сухость слизистой оболочки полости носа и околоносовых синусов. Антигистаминные препараты II поколения, лишенные антихолинергического эффекта, могут быть рекомендованы для лечения пациентов с аллергией или хроническим синуситом, но не для терапии острого бактериального риносинусита [29, 61]. То же самое касается использования антигистаминных препаратов при обострении ХОБЛ: данные ЛС оказывают скорее негативный, чем позитивный эффект, поскольку повышают вязкость бронхиального секрета и затрудняют его отхождение.
На настоящий момент убедительных доказательств того, что антигистаминные препараты предотвращают развитие аллергических реакций при использовании других ЛС, в частности, антибиотиков, нет, а при совместном назначении нескольких препаратов увеличивается риск неблагоприятного лекарственного взаимодействия, нежелательных лекарственных реакций и существенно возрастает стоимость лечения [62, 63]. Фармакологическая профилактика должна использоваться только для предотвращения развития анафилактоидных реакций в ответ на быстрое в/в введение ванкомицина (используются антигистаминные препараты I поколения в/в) [64] и на рентгеноконтрастные вещества и средства для флюоресцентной ангиографии – в данном случае рекомендуется превентивное назначение глюкокортикоидов и антигистаминных препаратов; во всех других случаях профилактическое назначение антигистаминных препаратов с другими ЛС не показано [65].
Одной из распространенных ошибок при проведении АБТ является назначение одновременно с антибиотиком противогрибковых средств с целью профилактики грибковых осложнений. Следует подчеркнуть, что при недлительном применении современных АМП у иммунокомпетентных пациентов риск грибковой суперинфекции минимален, и одновременное назначение антимикотиков не оправданно [66]. Комбинация антибиотика с противогрибковым средством возможна только у больных, получающих цитостатическую или противоопухолевую терапию, или у ВИЧ-инфицированных пациентов [67–69]. В этих случаях оправданно профилактическое назначение антимикотиков системного действия (кетоконазол, итраконазол, флуконазол), но не нистатина [70, 71]. Последний практически не всасывается в ЖКТ и не способен предотвратить грибковую суперинфекцию иной локализации – полости рта, дыхательных путей, половых органов, грибковый сепсис [72].
Для многих российских врачей характерна особая «привязанность» к назначению общеукрепляющих и иммуностимулирующих препаратов. При этом в России широко применяются такие препараты, как полиоксидоний, глутамил-триптофан, диоксометилтетрагидропиримидин, тилорон и др. Данная группа препаратов отсутствует в международных рекомендациях по терапии инфекционных заболеваний, а эффективность и необходимость их применения не доказаны в контролируемых клинических исследованиях [73].
Миф 6. Антибиотики вызывают дисбактериоз, поэтому после курса антибиотиков необходимо восстанавливать кишечную микрофлору
Действительно, наиболее частыми жалобами у пациентов на фоне применения антибиотиков являются диспепсические расстройства (тошнота, рвота, диарея). Нежелательные лекарственные реакции со стороны ЖКТ могут быть как первичными, обусловленными непосредственным воздействием АМП на структуры пищеварительного тракта, так и опосредованными – в результате нарушения нормального биоценоза (например, нарушения вкуса при орофарингеальном кандидозе или развитие антибиотик-ассоциированной диареи (ААД)). Многие антибиотики могут оказывать влияние на нормальную микрофлору организма, причем в большей степени страдает микрофлора полости рта и кишечника. Однако в подавляющем большинстве случаев при применении антибиотиков изменения количественного и качественного состава микрофлоры клинически не проявляются, не требуют коррекции и проходят самостоятельно.
Частота диареи на фоне приема различных АМП варьирует в широких пределах и составляет 2–6% при применении фторхинолонов [74], около 15% при терапии амоксициллином/клавуланатом [75] и до 25% при назначении эритромицина [76]. Однако среди всех случаев диареи на фоне терапии АМП не более 10–20% связаны с инфекцией Clostridium (С.) difficile. Терапия антибиотиками широкого спектра действия может вызвать подавление нормальной неспорообразующей анаэробной микрофлоры толстого кишечника, что приводит к избыточному росту C. difficile и последующему высвобождению токсинов А и В и развитию ААД. Случаи возникновения псевдомембранозного колита и ААД описаны при применении большинства АМП, однако считается, что наиболее часто эти состояния возникают при применении линкозамидов, пенициллинов, цефалоспоринов и фторхинолонов [77]. Клинические проявления ААД могут варьировать от легкого самокупирующегося диарейного синдрома до тяжелейшего псевдомембранозного колита, токсического мегаколона, перфорации кишечника, сепсиса и даже летального исхода [78]. Развитие псевдомембранозного колита на фоне АБТ – опасное осложнение, требующее постоянной настороженности врачей. У пациентов с легкой ААД отмена причинно-значимого препарата обычно бывает достаточной для купирования симптомов, в то время как при среднетяжелых и тяжелых формах заболевания помимо отмены антибактериальных препаратов (АБП) необходимо назначение метронидазола или ванкомицина внутрь [78].
Остальные случаи поражения ЖКТ вызваны функциональными нарушениями метаболизма углеводов или желчных кислот в кишечнике, аллергическими или токсическими эффектами АБП или фармакологическим действием АБП на моторику ЖКТ. Клавулановая кислота и ее метаболиты усиливают моторику тонкой кишки [76].
Нельзя не подчеркнуть, что диспепсические расстройства при использовании макролидов связаны со стимуляцией перистальтики кишечника из-за активации мотилиновых рецепторов (так называемый прокинетический эффект), которая возникает у значительного числа пациентов при применении в основном эритромицина [79]. «Новые» макролиды, такие как азитромицин (Сумамед®), характеризуются существенно лучшей переносимостью, что связано с менее выраженным прокинетическим эффектом [80]. Таким образом, диарея является очень частой жалобой при терапии макролидами и амоксициллином/клавуланатом, однако она, как правило, не представляет опасности для пациента, а ААД на фоне лечения макролидами развивается крайне редко.
Миф 7. Антибиотики необходимо применять для санации очагов инфекции
Важно знать, что выделение золотистых стафилококков с задней стенки глотки или из полости носа или с кожных покровов не является показанием к назначению антибиотиков [81, 82]. В настоящее время есть единственное показание для лечения носителей данного микроорганизма – в том случае, когда установлено, что носитель метициллинорезистентного штамма S. aureus (пациент или сотрудник специализированного отделения, например, хирургического, реанимации и интенсивной терапии, трансплантологии и др.) явился источником вспышки нозокомиальной инфекции в данном отделении [84, 83]. То же самое относится к бессимптомной бактериурии, которая не требует назначения АБТ (исключение составляют лишь беременные пациентки с бессимптомной бактериурией и пациенты с бактериурией перед инвазивным урологическим вмешательством – им необходимо назначение АМП) [85].
Часто врачи назначают нистатин или другой антимикотик в случае обнаружения в полости рта, моче или вагинальном мазке грибов рода Сandida, ориентируясь при этом лишь на данные микробиологического исследования и не учитывая наличия или отсутствия симптомов кандидоза и факторов риска развития грибковой инфекции (тяжелый иммунодефицит и др.). Выделение грибов рода Сandida из полости рта, влагалища или мочевых путей пациентов в большинстве случаев (у пациентов без факторов риска развития острого диссеминированного кандидоза) отражает бессимптомную колонизацию, не требующую назначения системной противогрибковой терапии, – необходимо лишь устранение или уменьшение влияния факторов риска [66, 86, 87].
Миф 8. Для достижения наилучшего эффекта антибиотик следует доставлять непосредственно в очаг инфекции, используя внутриполостное, интраартериальное, эндолимфатическое введение препарата
Несомненно, при нетяжелых инфекциях во многих случаях нет необходимости в системном применении АМП. Так, местное применение антибиотиков оправданно при поверхностных бактериальных и грибковых инфекциях кожи (например, применение крема с клиндамицином при эритразме или местное использование противогрибковых препаратов при поверхностных микозах), бактериальном вагинозе, кандидозном вульвовагините, конъюнктивите, наружном отите [88–90]. Имеются данные о высокой эффективности местного использования ушных капель с фторхинолонами (офлоксацином) для лечения наружного отита или острого среднего отита с отореей (т. е. при условии наличия перфорации барабанной перепонки, что обеспечивает достаточное проникновение антибиотика в полость среднего уха) [20]. В то же время при более глубоких и тяжелых поражениях, системных инфекционных процессах местной антимикробной терапии будет недостаточно.
Использование антибиотиков местно часто оказывается эффективным при лечении инфицированных ран. Тем не менее комбинация местного и системного применения АМП не обладает большей эффективностью, чем использование только системных или только местных антибиотиков. Более того, изолированное местное применение антибиотиков значительно уступает по эффективности системному применению. При местном использовании антибиотиков следует соблюдать следующие принципы:
1) не применять местно в ране антибиотики, которые в данной ситуации не были бы показаны и для системного применения;
2) не использовать большее число антибиотиков, чем это было бы необходимо при их системном применении в данной ситуации.
При расчете общей дозы следует суммировать дозы препарата, введенного парентерально и использованного местно в ране. Препараты для местного применения, используемые у пациентов с ожоговыми ранами, могут применяться и у отдельных категорий пациентов с обширными открытыми ранами.
Следует помнить, что местное применение АМП, предназначенных для системного введения (обкалывание раны, введение в дренажные трубки, орошение полостей во время операции) с целью профилактики или лечения инфекций в области хирургического вмешательства является нецелесообразным и не может сравниваться по эффективности с парентеральным назначением антибиотиков. В исследованиях установлено, что большинство АМП разрушается в результате взаимодействия с продуктами распада тканей, бактериальными токсинами и ферментами. Местное применение системных антибиотиков не позволяет создать оптимальные бактерицидные концентрации препарата в очаге инфекции и окружающих тканях, что приводит к формированию антибиотикорезистентности у микроорганизмов. Кроме того, при местном применении антибиотиков происходит селекция резистентных штаммов, в связи с чем нежелательно использовать для местной терапии препараты, использующиеся и для системной терапии (например, мазь с гентамицином). Предпочтение следует отдать антисептикам либо антибиотикам, не применяющимся (или редко применяющимся) системно, таким как мупироцин и полимиксин. Таким образом, можно заключить, что местная антибиотикотерапия, безусловно, оправданна, но лишь по определенным показаниям и с использованием определенных препаратов.
Является необоснованным внутриполостное введение антибиотиков, в частности, в полости околоносовых пазух при синусите [92], внутриплевральное введение при наличии плеврита [73], эндолюмбальное введение антибиотиков (хлорамфеникол + пенициллин, стрептомицин) при инфекциях ЦНС [93], применение аминогликозидов внутрь для лечения кишечных инфекций [94].
Еще одна разновидность местного использования антибиотиков – аэрозольный путь введения. Эффективность данного пути введения является крайне сомнительной. Единственное показание для использования этого способа введения – это лечение инфекций дыхательных путей, вызванных Pseudomonas aeruginosa, при муковисцидозе (использование колистиметата натрия ингаляционно) [95]. Аэрозольный путь введения может применяться в качестве дополнительной терапии у пациентов с нозокомиальной пневмонией, вызванной полирезистентными грамотрицательными микроорганизмами в случае недостаточной эффективности системной АБТ; эффективность и безопасность применения некоторых АМП аэрозольно (в частности, аминогликозидов) в настоящее время изучаются в клинических исследованиях [95].
Большинство современных АМП (пенициллины, цефалоспорины, карбапенемы, фторхинолоны и др.) при в/в введении в адекватных дозах и при соответствующей для каждого препарата кратности введения хорошо проникают в органы и ткани и создают в них достаточные терапевтические концентрации, поэтому введения их непосредственно в очаг инфекции не требуется.
Современные макролиды с улучшенными фармакокинетическими свойствами, такие как азитромицин (Сумамед®), обладают уникальной тканевой направленностью и способностью формировать максимальные концентрации в очагах инфекции. К преимуществам фармакокинетики азитромицина относится низкий уровень связывания с белками плазмы (7–51%), что позволяет препарату быстрее перемещаться из сосудистого русла в ткани. Высокая липофильность азитромицина также способствует его хорошему проникновению в ткани и накоплению в них, о чем свидетельствует большой объем распределения – 31,1 л/кг. Все это ведет к тому, что концентрации азитромицина в тканях в десятки и сотни раз превышают сывороточные (например, в слизистой оболочке бронхов – до 240 раз, а в жидкости альвеолярного эпителия – до 80 раз) и поддерживаются на высоком уровне в течение 5–7 дней после его отмены.
Азитромицин хорошо проникает внутрь клеток (включая эпителиоциты, макрофаги, фибробласты и др.) и создает длительно сохраняющиеся высокие внутриклеточные концентрации, до 1200 раз превышающие концентрацию в крови. Наибольшее накопление отмечается в фосфолипидном слое мембран лизосом фагоцитирующих клеток крови (нейтрофилов, моноцитов) и тканей (альвеолярных макрофагов). Фагоциты, насыщенные азитромицином, транспортируют его в очаг инфекционного воспаления за счет миграции под влиянием секретируемых бактериями хемотаксических факторов, создавая в нем концентрацию антибиотика выше, чем в здоровых тканях, причем степень концентрации коррелирует с выраженностью воспалительного отека. Высвобождение из макрофагов, нейтрофилов и моноцитов происходит в процессе фагоцитоза под действием бактериальных стимулов [96, 97]. Такая направленная доставка антибиотика имеет особое значение в случае инфекции в ограниченных локусах. Кроме того, накопление азитромицина в лизосомах фагоцитирующих клеток обеспечивает терапевтические концентрации препаратов в фаголизосомах и цитоплазме, что особенно важно с точки зрения воздействия на внутриклеточных возбудителей (Chlamydophila spp., Legionella spp., Mycoplasma spp.) и обычных патогенов, которые в некоторых ситуациях могут находиться внутри клеток (например, Streptococcus pyogenes).
При внутриполостном или эндолимфатическом введении антибиотиков невозможно прогнозировать их фармакокинетику, и концентрации препарата в очаге инфекции и сыворотке крови оказываются крайне вариабельными у различных пациентов. При этом концентрации могут быть как субтерапевтическими (что приводит к неэффективности терапии и риску развития резистентности у возбудителей), так и токсическими (с развитием тяжелых нежелательных реакций у пациентов). Кроме того, само по себе внутриполостное, интраартериальное и эндолимфатическое введение препаратов является достаточно сложной инвазивной процедурой, способной привести к целому ряду серьезных осложнений у пациента. Принимая во внимание основополагающий принцип медицины «Non nocere» – «Не навреди», от таких методов доставки антибиотиков в очаг инфекции следует отказаться вообще.
Заключение: в данной публикации мы постарались рассмотреть наиболее распространенные заблуждения, касающиеся применения АБП в клинической практике. Вероятно, большинству читателей наши рассуждения покажутся азбучными истинами. В то же время если практическим врачам при назначении АБТ пациентам удастся избежать подобных ошибочных суждений, это приведет к несомненному улучшению качества, повышению эффективности и безопасности лечения пациентов с инфекциями в повседневной клинической практике.
Cтатья подготовлена при поддержке ООО «Тева» Россия, Москва, 119049, ул. Шаболовка,10, корп. 1, бизнес-центр «Конкорд», сектор А, 3 этаж
Литература
1. Решедько Г.К., Козлов Р.С. Состояние резистентности к антиинфекционным химиопрепаратам в России. Практическое руководство по антиинфекционой химиотерапии / под ред. Л.С. Страчунского, Ю.Б. Белоусова, С.Н. Козлова М.: РЦ «Фармединфо», 2007. С. 32–46.
2. Levy S.B. Starting life resistance-free // N Engl J Med. 1990. Vol. 323. Р. 335–337.
3. Rudholm N. Economic implications of antibiotic resistance in a global economy // J Health Econ. 2002. Vol. 21. Р. 1071–1083.
4. Howard D.H., Scott R.D., Packard R., Jones D. The global impact of drug resistance // Clin Infect Dis. 2000. Vol. 36 (Suppl. 1). Р. 4–10.
5. Jacoby G.A., Archer G.L. New mechanisms of bacterial resistance to antimicrobial agents // N Engl J Med. 1991. Vol. 324. Р. 601–612.
6. Hoiby N. Ecological antibiotic policy // J Antimicrob Chemother. 2000. Vol. 46 (Suppl. 1). Р. 59–62.
7. Wenzel R.P., Edmond M.B. Managing antibiotic resistance // N Engl J Med. 2000. Vol. 343. Р. 1961–1963.
8. Лекарственные средства и их рациональное использование. Информационный бюллетень ВОЗ. № 338. Mай 2010 г. Available from: http://www.who.int/mediacentre/factsheets/fs338/ru.
9. World Health Organization. WHO Global Strategy for Containment of Antimicrobial Resistance. 11 September 2001. Available at: http://www.who.int/csr/drugresist/WHO_Global_Strategy_English.pdf.
10. Antibiotics Still Overprescribed for Sore Throats, Bronchitis ID Week 2013: Abstracts 962 and 963. Presented October 3, 2013.
11. Кассирский И.А. О врачевании. М.: Медицина. 1970. 272 с.
12. Страчунский Л. С., Андреева И. В. Самолечение антибиотиками в России // Ремедиум. 2004. № 12. С. 19–25.
13. Андреева И.В., Козлов С.Н., Королев С.В. с соавт. От 2004 до 2009 года: изменились ли за пять лет рекомендации фармацевтов мужчинам с симптомами острого уретрита? // Клиническая микробиология и антимикробная химиотерапия. 2009. № 11 (3). С. 253–263.
14. McKee M., Mills L., Mainous A. Antibiotic use for the treatment of upper respiratory infections in a diverse community // J Fam Pract. 1999. Vol. 48. Р. 993–996.
15. Sawair F.A., Baqain Z.H., Abu Karaky A. et al. Assessment of self-medication of antibiotics in a Jordanian population // Med Princ Pract. 2009. Vol. 18 (1). Р. 21–25.
16. Väänänen M.H., Pietilä K., Airaksinen M. Self-medication with antibiotics — does it really happen in Europe? // Health Policy. 2006. Vol. 77 (2). Р. 166–171.
17. Chiappini E., Regoli M., Bonsignori F. et al. Analysis of different recommendations from international guidelines for the management of acute pharyngitis in adults and children // Clin Ther. 2011. Vol. 33 (1). Р. 48–58.
18. Pelucchi C., Grigoryan L., Galeone C. et al. ESCMID Guideline for the management of acute sore throat // Clin Microbiol Infect. 2012. Vol. 18 (Suppl 1). Р. 1–28.
19. Shulman S.T., Bisno A.L., Clegg H.W. et al. Infectious Diseases Society of America. Clinical practice guideline for the diagnosis and management of group A streptococcal pharyngitis: 2012 update by the Infectious Diseases Society of America // Clin Infect Dis. 2012. Vol. 55 (10). Р. 86–102.
20. Gulani A., Sachdev H.P., Qazi S.A. Efficacy of short course (<4 days) of antibiotics for treatment of acute otitis media in children: a systematic review of randomized controlled trials // Indian Pediatr. 2010. Vol. 47 (1). Р. 74–87.
21. Kozyrskyj A., Klassen T.P., Moffatt M., Harvey K. Short-course antibiotics for acute otitis media. Cochrane Database Syst Rev. 2010. Vol. 9: CD001095.
22. American Academy of Pediatrics and American Academy of Family Physicians. Subcommittee on management of acute otitis media: clinical practice guideline: diagnosis and management of acute otitis media // Pediatrics. 2004. Vol. 113. Р. 1451–1465.
23. Alagić-Smailbegović J., Saracević E., Sutalo K. Azythromicin versus amoxicillin-clavulanate in the treatment of acute sinusitis in children // Bosn J Basic Med Sci. 2006. Vol. 6 (4). Р. 76–78.
24. Ng D.K., Chow P.Y., Leung L. et al. A randomized controlled trial of azithromycin and amoxycillin/ clavulanate in the management of subacute childhood rhinosinusitis // J Paediatr Child Health. 2000. Vol. 36 (4). Р. 378–381.
25. Свистушкин В.М., Андреева И.В., Стецюк О.У. с соавт. Обзор современных рекомендаций по тактике ведения пациентов с острым бактериальным риносинуситом в педиатрической практике // Клиническая микробиология и антимикробная химиотерапия. 2012. № 14 (3). С. 176–190.
26. Bradley J.S., Byington C.L., Shah S.S. et al. The management of community-acquired pneumonia in infants and children older than 3 months of age: clinical practice guidelines by the Pediatric Infectious Diseases Society and the Infectious Diseases Society of America // Clin Infect Dis. 2011. Vol. 53 (7). Р. 25–76.
27. Harris M., Clark J., Coote N. et al. British Thoracic Society Standards of Care Committee. British Thoracic Society guidelines for the management of community acquired pneumonia in children: update 2011 // Thorax. 2011. Vol. 66. Suppl 2. Р. 1–23.
28. Внебольничная пневмония у детей: распространенность, диагностика, лечение и профилактика. М., 2011. 64 с.
29. Scheid D.C., Hamm R.M. Acute bacterial rhinosinusitis in adults: part II. Treatment // Am Fam Physician. 2004. Vol. 70 (9). Р. 1697–1704.
30. Slavin R.G., Spector S.L., Bernstein I.L. et al. American Academy of Allergy, Asthma and Immunology; American College of Allergy, Asthma and Immunology; Joint Council of Allergy, Asthma and Immunology. The diagnosis and management of sinusitis: a practice parameter update // J Allergy Clin Immunol. 2005. Vol. 116 (6 Suppl). Р. 13–47.
31. Чучалин А.Г., Синопальников А.И., Козлов Р.С. с соавт. Внебольничная пневмония у взрослых. Практические рекомендации по диагностике, лечению и профилактике // Клиническая микробиология и антимикробная химиотерапия. 2010. № 12 (3). С. 186–222.
32. Gupta K., Hooton T.M., Naber K.G. et al. Infectious Diseases Society of America; European Society for Microbiology and Infectious Diseases. International clinical practice guidelines for the treatment of acute uncomplicated cystitis and pyelonephritis in women: A 2010 update by the Infectious Diseases Society of America and the European Society for Microbiology and Infectious Diseases // Clin Infect Dis. 2011. Vol. 52 (5). Р. 103–120.
33. Geisler W.M. Diagnosis and management of uncomplicated Chlamydia trachomatis infections in adolescents and adults: summary of evidence reviewed for the 2010 Centers for Disease Control and Prevention Sexually Transmitted Diseases Treatment Guidelines // Clin Infect Dis. 2011. Vol. 53. Suppl 3. Р. 92–98.
34. Lanjouw E., Ossewaarde J.M., Stary A. et al. European guideline for the management of Chlamydia trachomatis infections // Int. J. STD AIDS. 2010. Vol. 21 (11). Р. 729–737.
35. Протокол ведения больных «Инфекции, передаваемые половым путем». «Урогенитальная хламидийная инфекция» / под ред. В.И. Кисиной. М.: Ньюдиамед. 2011. С. 164–191.
36. Centers for Disease Control and Prevention (CDC). Update to CDC’s Sexually transmitted diseases treatment guidelines, 2010: oral cephalosporins no longer a recommended treatment for gonococcal infections. MMWR Morb Mortal Wkly Rep. 2012. Vol. 61 (31). Р. 590–594.
37. Lieberthal A.S., Carroll A.E., Chonmaitree T. et al. The diagnosis and management of acute otitis media // Pediatrics. 2014. Vol. 133 (2). Р. 346–347.
38. Краткий справочник по антимикробной терапии / под ред. Р.С. Козлова. Смоленск, МАКМАХ, 2012. 460 с.
39. Исследование UTIAP-I, 1998–1999 гг., неопубликованные данные.
40. Jurado R.L. Why Shouldn’t We Determine the Erythrocyte Sedimentation Rate? // Clinical Infectious Diseases, 2001. Vol. 33. Р. 548–549.
41. Rubinstein E., Ronald A. Toronto declaration to combat antimicrobial resistance. Proceedings of the Global Resistance Day, 40th Interscience Conference on Antimicrobial Agents and Chemotherapy, September 16, 2000, Toronto, Ontario, Canada.
42. Gerber M.A., Baltimore R.S., Eaton C.B. et al. Prevention of rheumatic fever and diagnosis and treatment of acute streptococcal pharyngitis: A scientific statement from the American Heart Association Rheumatic Fever, Endocarditis and Kawasaki Disease Committee of the Council on Cardiovascular Disease in the Young, the Interdisciplinary Council on Functional Genomics and Translational Biology, and the Interdisciplinary Council on Quality of Care and Outcomes Research: Endorsed by the American Academy of Pediatrics // Circulation. 2009. Vol. 119. Р. 1541–1551.
43. American Academy of Pediatrics, Committee on Infectious Diseases. Red Book: Report of the Committee on Infectious Diseases. 28th ed. Elk Grove Village, Ill: American Academy of Pediatrics; 2009.
44. Азовскова О.В., Иванчик Н.В., Дехнич А.В., Кречикова О.И., Козлов Р.С., исследовательская группа «ПеГАС». Динамика антибиотикорезистентности респираторных штаммов Streptococcus pyogenes в России за период 1999–2009 гг. // Клиническая микробиология и антимикробная химиотерапия. 2012. № 14 (4). С. 309–321.
45. European Centre for Disease Prevention and Control. Antimicrobial resistance surveillance in Europe 2012. Annual Report of the European Antimicrobial Resistance Surveillance Network (EARS-Net). Stockholm: ECDC; 2013.
46. Козлов Р.С., Сивая О.В., Кречикова О.И. и соавт. Динамика резистентности Streptococcus pneumoniae к антибиотикам в России за период 1999–2009 гг. Клиническая микробиология и антимикробная химиотерапия. 2010. № 12 (4). С. 329–341.
47. Granizo J.J., Aguilar L., Casal J. et al. Streptococcus pneumoniae resistance to erythromycin and penicillin in relation to macrolide and beta-lactam consumption in Spain (1979–1997) // J Antimicrob Chemother. 2000. Vol. 46. Р. 767–773.
48. Van der Meer J.W.M., Gyssens I.C. Considerations in providing antibiotic therapy. The APUA Newsletter 1992; winter. Р. 3–5.
49. Frimodt-Moller N., Espersen F., Jacobsen B. et al. Problems with antibiotic resistance in Spain and their relation to antibiotic use in humans elsewhere // Clin Infect Dis. 1997. Vol. 25. Р. 939–941.
50. Bryskier A., Butzler J.-P. Macrolides. In: Antibiotic and Chemotherapy. Finch R.G., e.a.: eds. Churchill Livingstone, 2003. P. 310–325.
51. Robinson D.A., Sutcliffe J.A., Tewodros W. et al. Evolution and global dissemination of macrolide-resistant group A streptococci // Antimicrob. Agents Chemother. 2006. Vol. 50 (9). Р. 2903–2911.
52. Thornsberry C., Brown N.P., Draghi D.C. et al. Antimicrobial activity against multidrug-resistant S.pneumoniae isolated in United States, 2001–2005 // Postgrad Med. 2008. Vol. 120 (Suppl. 3). Р. 32–38.
53. Козлов Р.С., Страчунский Л.С. Общие особенности антиинфекционных химиопрепаратов. Практическое руководство по антиинфекционой химиотерапии / под ред. Л.С. Страчунского, Ю.Б. Белоусова, С.Н. Козлова М.: РЦ «Фармединфо», 2007. С. 64–68.
54. Culic O., Erakovic V., Parnham M.J. Anti-inflammatory effects of macrolide antibiotics // Eur J Pharmacol. 2001. Vol. 429 (1–3). Р. 209–229.
55. Amsden G.W. Anti-inflammatory effects of macrolides — an underappreciated benefit in the treatment of community-acquired respiratory tract infections and chronic inflammatory pulmonary conditions? // J Antimicrob Chemother. 2005. Vol. 55 (1). Р. 10–21.
56. Иммуномодулирующая активность макролидов — фармакологическое свойство или реальный клинический эффект? // Клиническая фармакология и терапия. 2005. № 14 (2). С. 5–9.
57. Рачина С.А., Козлов С.Н., Иделевич Е.А. с соавт. Представления врачей поликлиник об этиологии и тактике лечения внебольничной пневмонии в амбулаторных условиях // Пульмонология. 2004. № 2. С. 6–12.
58. Козлов С.Н. Фармакоэпидемиологические подходы к оптимизации лекарственной терапии внебольничных инфекций в амбулаторных условиях;:
Дис. докт. мед. наук. Смоленск, 2004.
59. Braun J.J., Alabert J.P., Michel F.B. et al. Adjunct effect of loratadine in the treatment of acute sinusitis in patients with allergic rhinitis // Allergy. 1997. Vol. 52. Р. 650–655.
60. McCormick D.P., John S.D., Swischuk L.E. et al. A double-blind, placebo-controlled trial of decongestant-antihistamine for the treatment of sinusitis in children // Clin Pediatr (Phila). 1996. Vol. 35 (9). Р. 457–460.
61. Thomas M., Yawn B.P., Price D. et al. EPOS Primary Care Guidelines: European Position Paper on the Primary Care Diagnosis and Management of Rhinosinusitis and Nasal Polyps 2007 — a summary // Prim Care Respir J. 2008. Vol. 17 (2). Р. 79–89.
62. Patterson R., Grammer L.C., Greenberger P.A. Allergic Diseases: Diagnosis and Management. Lippincott Williams & Wilkins; 5th edition, 1997. 634 p.
63. Babe K.S., Serafin W.E. Histamine bradykinin and their antagonists. In: Hardman J.G., Limbird L.E., Molinoff P.В., Ruddon R.W. eds. Goodman and Gilman’s the pharmacological basis of therapeutics. 9th ed. New York: McGraw-Hill, 1996. Р. 581–600.
64. Renz C.L., Thurn J.D., Finn H.A. et al. Antihistamine prophylaxis permits rapid vancomycin infusion // Crit Care Med. 1999. Vol. 27 (9). Р. 1732–1737.
65. The diagnosis and management of anaphylaxis: an updated practice parameter // J Allergy Clin Immunol. 2005. Vol. 115 (3 Suppl). Р. 483–523.
66. Дворецкий Л.И., Яковлев С.В. Ошибки антибактериальной терапии инфекций дыхательных путей в амбулаторной практике // Инфекции и антимикробная терапия. 2001. № 3 (2). С. 49–54.
67. Cornely O.A., Böhme A., Buchheidt D. et al. Infectious Diseases Working Party (AGIHO) of the German Society of Hematology and Oncology (DGHO). Prophylaxis of invasive fungal infections in patients with hematological malignancies and solid tumors — guidelines of the Infectious Diseases Working Party (AGIHO) of the German Society of Hematology and Oncology (DGHO) // Ann Hematol. 2003. Vol. 82. Suppl 2. Р. 186–200.
68. Ship J.A., Vissink A., Challacom be S.J. Use of prophylactic antifungals in the immunocompromised host // Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2007. Vol. 103.(6). Р. 1–14.
69. Cruciani M., Mengoli C., Malena M. et al. Antifungal prophylaxis in liver transplant patients: a systematic review and meta-analysis // Liver Transpl. 2006. Vol. 12 (5). Р. 850–885.
70. DeGregorio M.W., Lee W.M., Ries C.A. Candida infections in patients with acute leukemia: ineffectiveness of nystatin prophylaxis and relationship between oropharyngeal and systemic candidiasis // Cancer. 1982. Vol. 50 (12). Р. 2780–2784.
71. Philpott-Howard J.N., Wade J.J., Mufti G.J. et al. Randomized comparison of oral fluconazole versus oral polyenes for the prevention of fungal infection in patients at risk of neutropenia // J Antimicrob Chemother. 1993. Vol. 31 (6). Р. 973–984.
72. Климко Н.Н., Веселов А.В. Противогрибковые химиопрепараты. Практическое руководство по антиинфекционой химиотерапии / под ред. Л.С. Страчунского, Ю.Б. Белоусова, С.Н. Козлова. М.: РЦ «Фармединфо», 2007. С. 157–175.
73. Пневмония у детей. Клинические рекомендации / под ред. А.А. Баранова М.: ГЭОТАР-Медиа, 2005. 28 с.
74. Owens R.C. Jr., Ambrose P.G. Antimicrobial safety: focus on fluoroquinolones // Clin Infect Dis. 2005. Vol. 41 (Suppl. 2). Р. 144–157.
75. Salvo F., De Sarro A., Caputi A.P. et al. Amoxicillin and amoxicillin plus clavulanate: a safety review // Expert Opin Drug Saf. 2009. Vol. 8 (1). Р. 111–118.
76. Högenauer C., Hammer H.F., Krejs G.J. et al. Mechanisms and management of antibiotic-associated diarrhea // Clin Infect Dis. 1998. Vol. 27 (4). Р. 702–710.
77. Bartlett J.G. Antibiotic-associated diarrhea // Clin Infect Dis. 1992. Vol. 15. Р. 573–581.
78. Makins R, Ballinger A. Gastrointestinal side effects of drugs // Expert Opin Drug Saf. 2003. Vol. 2 (4). Р. 421–429.
79. Peeters T.L., Matthys G., Depootere I. et al. Erythromycin is a motilin receptor agonist // Am J Physiol. 1989. Vol. 257. Р. 470–474.
80. Caron F., Bouaniche M., Delatour F. et al. B. Effects of two oral erythromycin ethylsuccinate formulations on the motility of the small intestine in human beings // Antimicrob Agents Chemother. 1996. Vol. 40. Р. 1796–1800.
81. Waldvogel F.A. Staphylococcus aureus. In: Mandell G.L., Bennett J.E., Dolin R. Principles and Practice of Infectious Diseases. 5th ed. Philadelphia: Churchill Livingstone, 2000. Р. 2069–2092.
82. Archer G.L. Staphylococcus epidermidis and other coagulase-negative staphylococci. In: Mandell G.L., Bennett J.E., Dolin R. Principles and Practice of Infectious Diseases. 5th ed. Philadelphia: Churchill Livingstone, 2000. Р. 2092–2100.
83. Eltringham I. Mupirocin resistance and methicillin-resistant Staphylococcus aureus (MRSA) // J Hosp Infect. 1997. Vol. 35. Р. 1–8.
84. Reagan D.R., Bradley N., Doebbeling N. et al. Elimination of coincident Staphylococcus aureus nasal and hand carriage with intranasal application of mupirocin calcium ointment // Ann Intern Med. 1991. Vol. 114. Р. 101–106.
85. Nicolle L.E., Bradley S., Colgan R. et al. Infectious Diseases Society of America guidelines for the diagnosis and treatment of asymptomatic bacteriuria in adults // Clin Infect Dis. 2005. Vol. 40. Р. 643–654.
86. Климко Н.Н., Веселов А.В. Выбор антимикробных химиопрепаратов при грибковых инфекциях. Практическое руководство по антиинфекционой химиотерапии. Под ред. Л.С. Страчунского, Ю.Б. Белоусова, С.Н. Козлова М.: РЦ «Фармединфо», 2007. С. 340–355.
87. Рафальский В.В. Клиническое значение и терапия кандидурии // Клиническая микробиология и антимикробная химиотерапия. 2001. № 3(1). С. 22–27.
88. Kaye E.T. Topical antibacterial agents: role in prophylaxis and treatment of bacterial infections. In: Remington J.S., Swartz M.N., editors. Current Clinical Topics in Infectious Diseases. 20th ed. Malden: Blackwell Sciens, 2000. Р. 43–63.
89. Tunkel A. Topical antibacterials. In: Mandell G.L., Bennett J.E., Dolin R., editors. 5th ed. Philadelphia: Churchill Livingstone, 2000. Р. 428–436.
90. Богданович Т.М., Страчунский Л.С. Мупироцин: уникальный антибиотик для местного применения // Клиническая микробиология и антимикробная химиотерапия. 1999. № 1 (1). С. 57–65.
91. Goldblatt E.L. Efficacy of ofloxacin and other otic preparations for acute otitis media in patients with tympanostomy tubes // Pediatr Infect Dis J. 2001. Vol. 20 (1). Р. 116–119.
92. Янов Ю.К., Рязанцев С.В. Острый риносинусит в практике врача-терапевта // Consilium medicum. 2003. № 5 (10). С. 557–563.
93. Лобзин Ю.Б., Пилипенко В.В., Стецюк О.У. Инфекции центральной нервной системы. Практическое руководство по антиинфекционой химиотерапии / под ред. Л.С. Страчунского, Ю.Б. Белоусова, С.Н. Козлова М.: РЦ «Фармединфо», 2007. С. 300–310.
94. Решедько Г.К., Хайкина Е.В. Группа аминогликозидов. Практическое руководство по антиинфекционой химиотерапии. Под ред. Л.С. Страчунского, Ю.Б. Белоусова, С.Н. Козлова М.: РЦ «Фармединфо», 2007. С. 88–93.
95. Чучалин А.Г., Синопальников А.И., Козлов Р.С., Рачина С.А. Инфекции нижних дыхательных путей. Практическое руководство по антиинфекционой химиотерапии / под ред. Л.С. Страчунского, Ю.Б. Белоусова, С.Н. Козлова М.: РЦ «Фармединфо», 2007. С. 258–266.
96. Gladue R.P., Bright G.M., Isaacson R.E., et al. In vitro and in vivo uptake of azithromycin (CP-62,993) by phagocytic cells: possible mechanism of delivery and release at sites of infection // Antimicrob Agents Chemother. 1989. Vol. 33. P. 277–282.
97. Hand W.L., Hand D.L. Characteristics and mechanisms of azithromycin accumulation and efflux in human polymorphonuclear leukocytes // Int Antimicrob Agents. 2001. Vol. 18. P. 419–425.