В онкологии любая врачебная ошибка грозит серьёзными последствиями: некорректно назначенная токсичная химиотерапия может убить пациента так же, как и отсутствие лечения, если у пациента есть рак, но диагноза нет.
Число онкологических диагнозов в России, как и во всём мире, растёт: в прошлом году отечественные врачи выявили 617,2 тысячи новых случаев злокачественных заболеваний – это на 20 тысяч больше, чем в 2017-м. Между тем, по мнению экспертов, как минимум 30% такихдиагнозов требуют корректировки: в уточнении могут нуждаться как вид ибиологические характеристикиопухоли или распространённость процесса, так и самый важный вопрос: злокачественная опухоль или доброкачественная.
Никто не застрахован от ошибок
Диагноз «рак» ставит врач-онколог, опираясь на результаты морфологических исследований. Основное из них – гистологическое, во время которого фрагмент опухоли исследуется под микроскопом: оно позволяет увидеть структурные изменения тканей, понять, идёт ли речь о раке или о доброкачественном новообразовании. Для его выполнения образец ткани, полученный при биопсии или, например, во время операции, направляется в патоморфологическую лабораторию, где его обрабатывают и делают из него парафиновые блоки, а блоки нарезают на гистологические стёкла, которые изучает врач-патоморфолог.
Для уточнения диагноза проводится углублённый иммуногистохимический анализ: его применяют, если первичный очаг заболевания неизвестен или обнаруженные клетки трудно отнести к определённому виду рака. Это исследование основано на использовании антител, которые вступают в реакции с антигенами опухоли. Набор характерных антител существует практически для каждого вида онкологических заболеваний, поэтому при помощи такого исследования можно подтвердить или опровергнуть диагноз, а также получить уточняющую информацию о заболевании. Но иногда и его недостаточно: часть случаев требует дополнительного молекулярно-генетического исследования для того, чтобы предсказать развитие болезни и подобрать эффективную схему лечения.
На всех этапах диагностики рака возможны ошибки: стёкла с образцами могут перепутать, при биопсии могут взять кусочек ткани не с того участка, сам врач, проводящий исследование, может ошибиться. Результаты исследований гистологических стёкол всегда зависят от квалификации врача, который смотрит в микроскоп, и случаев, с которыми ему уже доводилось сталкиваться на практике, ведь ни один патолог не может знать абсолютно все виды рака. Знания и опыт требуются как для выявления изменений, так и для верной трактовки результата. Цена ошибки в этом случае очень высока: если неопытный врач принял особенности строения тканей, характерные для некоторых доброкачественных состояний, за рак, пациента направят на операцию и сложное лечение, которого можно было бы избежать при выполнении исследования высококвалифицированным специалистом. При этом врач, который поставил диагноз, может и не подозревать, что ошибся.
Семь раз проверь
Чтобы избежать неправильного диагноза и, как следствие, некорректного лечения, необходимо показать гистологические блоки второму специалисту, желательно – специализирующемуся на конкретной локализации рака. В 2016 году на базе Лаборатории «Гемотест» – федеральной медицинской сети, которая охватывает 280 городов России, – был создан Независимый экспертный совет в рамках проекта «Онкологическая экспертиза». В совет вошли 30 ведущих специалистов национальных медицинских исследовательских центров, которые проводят пересмотр гистологических и цитологических препаратов, полученных в любых медицинских учреждениях, частных и государственных.
Для получения экспертного заключения достаточно отнести препараты – стёкла или блоки – в любое лабораторное отделение «Гемотест». В большинстве случаев при пересмотре диагноза выявляется клинически значимое расхождение – такое, которое способно существенно повлиять на тактику лечения. «Одно из самых сложных направлений в онкоморфологии – опухоли кроветворной и лимфоидной тканей, опухоли мягких тканей и костей, в которых частота расхождений высокая. В некоторых выборках расхождения могут достигать 50%, то есть из двух входящих случаев в одном диагноз меняется. Иногда процент расхождения выше», – говорит заведующий отделением клинической молекулярной морфологии Северо-Западного государственного медицинского университета имени И. И. Мечникова, консультант Экспертного совета «Гемостест», руководитель направления «Телепатология» Юрий Криволапов.
«Патологоанатом ориентируется на собственный опыт, квалификацию, существующие стандарты диагностики и критерии патологии. Естественно, если доктор не обладает должной практикой диагностики определённой патологии, то он может ошибиться, особенно в переходных моментах. Именно с этим и связано такое количество расхождений, – объясняет руководитель отдела гистологии лаборатории «Гемостест» Сергей Кижаев. – И часто, пересматривая биоматериал пациента, направленный из региональной лаборатории, мы даём заключение, отличное от первоначального. В своей практике мы используем несколько пар глаз, чтобы сойтись в одном мнении».
Опыт лаборатории «Гемотест»: результаты пересмотра диагнозов в рамках проекта «Второе мнение» (3 года, 2500 случаев)
Эффективность лечения рака зависит не только от развития методов терапии — без постановки точного морфологического диагноза врач-онколог не может выбрать подходящий для конкретной опухоли вид лечения. Важным компонентом современной онкологической помощи, который, к сожалению, часто остается в тени достижений технологий разрушения опухолей, является правильная постановка диагноза. А точнее — определение типа опухолевых клеток и, соответственно, их устойчивости к различным видам внешнего воздействия. Решает эту задачу морфологическая диагностика, базовый принцип которой — исследование образцов опухолевых клеток.
С каким образцами опухолевых клеток работает патоморфология?
Базой для морфологической диагностики являются образцы тканей (фрагменты опухолей). Наиболее частым способом забора материала является трепан-биопсия, которая осуществляется при помощи специальной толстой иглы, также используется инцизионная биопсия, которая выполняется при помощи скальпеля и эксцизионная биопсия с тотальным забором пораженного участка (например, биопсия лимфоузла при диагностике лимфом).
После образцы тканей проходят этапы специальной подготовки (фиксации и проводки), после чего пропитываются парафином с формированием блока. Из блоков на специальных устройствах (микротомах) приготавливаются тонкие срезы толщиной 4-5 микрон. Полученные срезы помещаются на стекла, подвергающиеся различным методам окраски с целью выделения различий в клеточных структурах. Эти, так называемые, “стекла”, подлежат тщательному рассмотрению врачом-патоморфологом.
Каждый из этапов подготовки образцов критичен для возможности и точности последующих молекулярных методов исследования, поэтому нарушение технологии подготовки может привезти к неправильному назначению лечения.
Зачем изучать опухоли под микроскопом?
Количество известных разновидностей опухолей — велико. Наиболее полной считается классификация Всемирной организации здравоохранения (ВОЗ), которая в печатном виде представляет собой 11 томов, около 400 страниц в каждом. Итог — ошибки в постановке диагноза неизбежны.
Патоморфологическая классификация опухолей Всемирной организации здравоохранения (ВОЗ) едва уместилась в 11 томов
Показатель ошибок при постановке диагноза поражает: от 5 до 50% всех онкологических диагнозов в мире — неверны. Половина этих ошибок не становятся фатальными — различные виды рака могут одинаково реагировать на определенный подход к лечению. Но значительная часть неточностей приводит к неадекватному лечению рака у пациентов, которое может способствовать прогрессированию заболевания.
Среди объективных причин ошибочных диагнозов, связанных с морфологической диагностикой, лидирует невозможность получения образца опухолевой ткани для ее морфологического исследования ввиду трудности доступа либо тяжелого состояния пациента.
Среди субъективных причин ошибок морфологической диагностики наиболее распространены:
- ошибка при заборе материала (например, при раке простаты следует проводить множественный забор образцов, т.к. опухоль в этом органе может иметь крайне сложную пространственную форму);
- отсутствие возможности конкретного лечебного учреждения провести морфологическую диагностику в необходимом объеме (собственная морфологическая лаборатория — это сложный и дорогой институт);
- нарушения протоколов как в части отказа от забора и морфологического исследования образцов, так и в части стандартов проведения морфологической диагностики опухоли (в том числе и устаревшие методики, отсутствие необходимого оборудования, низкая квалификация специалистов, на повышение которой не выделяется средств).
И только морфологическая диагностика, проведенная с соблюдением всех стандартов взятия материала, подготовки и рассмотрения образцов, способна дать окончательный ответ о типе опухоли и ее особенностях.
Гистология и иммуногистохимия — в чем отличие?
Первоначально, морфологическая диагностика решала задачу определения наличия злокачественного процесса в ткани. Для этого применялся метод, который в современной медицине называется “гистологическое морфологическое исследование”, или, как часто можно услышать от пациентов “гистология”.
С помощью гистологического морфологического исследования может быть проведена дифференциальная диагностика доброкачественных процессов и злокачественной опухоли — т.е. определение наличия измененных (атипичных) клеток в образце тканей. Простое гистологическое исследование в любом случае носит субъективный характер и зависит от профессионализма проводящего его врача. Поэтому, при подозрении на наличие опухоли, второе мнение от ведущих экспертов МИБС в этой области значительно снижает риск ошибочного диагноза.
При подтверждении опухолевого процесса в тканях, пациенту требуется более точная диагностика, которая точно определит тип опухоли и укажет на наиболее эффективный подход к ее лечению — иммуногистохимия.
Зачем нужно иммуногистохимическое исследование?
Основой иммуногистохимии является окрашивание клеток специфическими веществами, которые реагируют на определенные типы опухолевых клеток и “мишени”, специфические свойства и мутации генов конкретного типа рака.
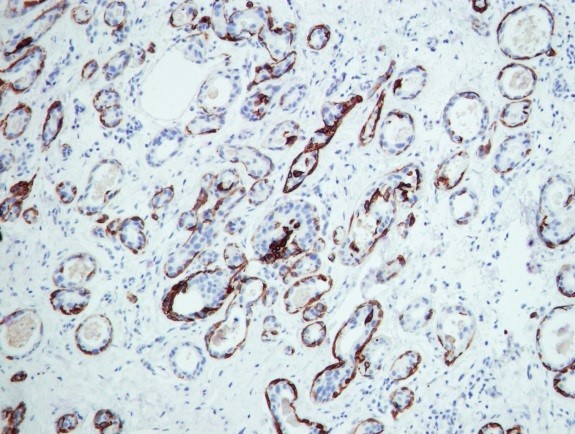
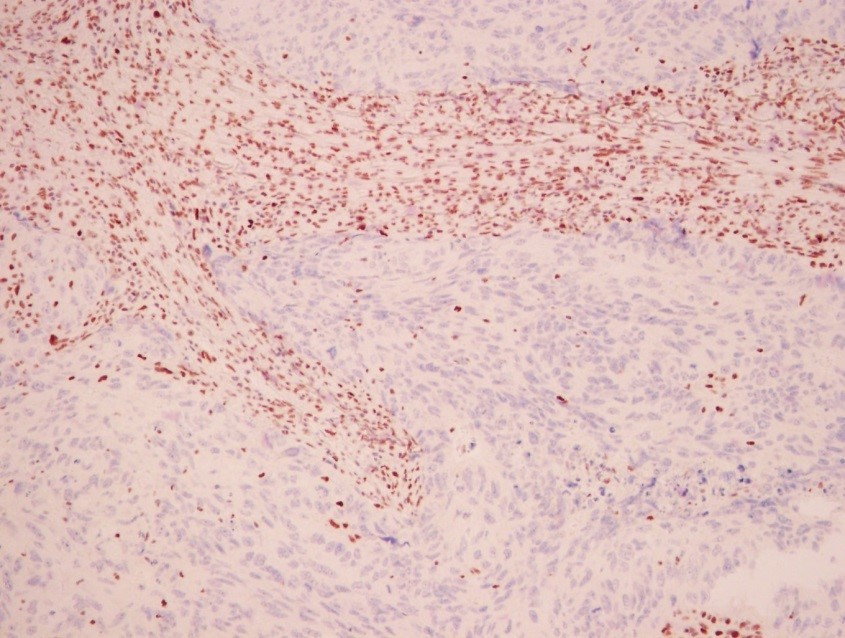
Пример иммуногистохимии в МИБС: Позитивная реакция на СК14 (коричневое окрашивание) вокруг всех подозрительных структур исключает рак молочной железы – дополнительное лечение пациентке не требуется
Таким образом, иммуногистохимия позволяет точно указать нозологию (разновидность) опухоли, что чрезвычайно важно для проведения адекватного лечения, а также – для прогнозирования развития заболевания. Например, некоторые разновидности рака молочной железы (тубулярный, фиброматоз-подобный) не требуют иного лечения, кроме хирургического.
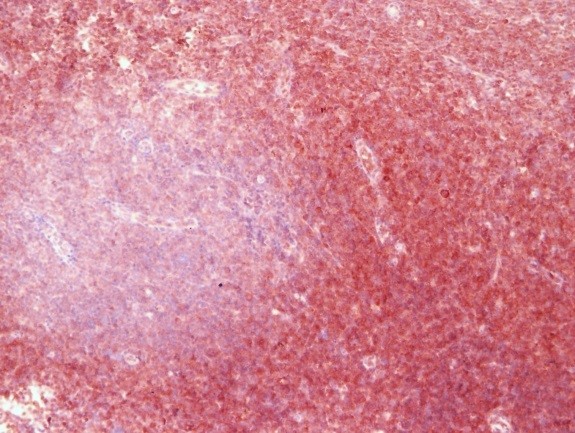
Иммуногистохимия в МИБС: Позитивная реакция на bcl10 в лимфоидных клетках конъюнктивы глаза (коричневое окрашивание вокруг фолликула) подтверждает диагноз MALT-лимфомы, при которой наибольшего эффекта покажет химиотерапия, а не хирургическое лечение
Лечим метастазы. Когда не обойтись без патоморфолога?
Метастазы представляют собой “копию” злокачественных клеток первичной опухоли, точнее, того типа тканей, из которых развилось новообразование. Поэтому тип клеток метастаза может указать на локализацию первичного рака. Это крайне важно, если первичная опухоль не проявляет себя симптомами и не диагностирована. С другой стороны, если первичная опухоль, имеет уязвимость к препаратам таргетной терапии, то ее метастазы могут утратить это свойство. В таком случае иммуногистохимия образца метастазов покажет, что для первичной опухоли лечение будет прежним, а вот для метастазов следует избрать другой подход.
Молекулярные исследования + Таргетная терапия + Иммунотерапия = Эффективное лечение рака
Благодаря развитию методов молекулярной диагностики (иммуногистохимия, ПЦР, секвенирование), лекарственная терапия рака идет большими шагами вперед. Помимо химиотерапии, сейчас активно используются таргетные препараты, целенаправленно воздействующие на мишени в опухолевых клетках (HER2, CD20, c-kit, мутантный b-Raf и др.).
Кроме того, в настоящее время онкология переживает «бум» иммунотерапии, при применении которой лекарственные препараты разрывают порочный механизм, препятствующий уничтожению опухолей собственными иммунными клетками.
Однако для правильного назначения таких препаратов необходимым условием является определение специфических маркеров при помощи иммуногистохимического или молекулярно-генетического исследования опухолевой ткани. Более того, часто маркеры, указывающие на чувствительность к иммунотерапии (MMR, MSI), также говорят о том, что пациенту не следует назначать химиотерапию, в особенности это касается рака толстой кишки и желудка.
Иммуногистохимия показала, что негативная реакция на MSH2 (синее окрашивание ядер опухоли, коричневое окрашивание неопухолевой ткани) свидетельствует о том, что рак тела матки, представленный на данном слайде, чувствителен к иммунотерапии
Какой рак можно вылечить без операции?
Некоторые разновидности опухоли не только не требуют хирургического лечения, но оно им противопоказано, так как может привести к прогрессированию заболевания. Это прежде всего лимфома, опухоль, возникающая из лимфоцитов, которые располагаются как в лимфоузлах, так и в паренхиматозных органах.
Развитие иммуногистохимии и основанных на ее результатах таргетной терапии и иммунотерапии постоянно расширяют спектр видов рака, которые можно вылечить “точечным” воздействием исключительно на опухолевые клетки. Помимо лечения лимфомы, по состоянию на начало 2019 года наибольшее применение методы иммунотерапии и таргетного лечения получили при лечении таких заболеваний, как:
- рак молочной железы;
- рак простаты;
- рак кишечника;
- рак легкого;
- лимфомы;
- рак желудка;
- меланома
при которых современные протоколы лечения требуют выполнение иммуногистохимии. Большинство ошибок в диагностике и лечении данных заболеваний связано либо с не проведением иммуногистохимии, либо с ее неправильной интерпретацией. Цена ошибки, к сожалению, может быть фатальной, так как назначение неправильного лечения может привести к резистентности (устойчивости) опухолевых клеток к лекарственным препаратам, которые при правильном назначении часто приводят к выздоровлению пациента.
Как повысить качество морфологической диагностики в клиниках России?
Выбирайте МИБС как для первого проведения базовой морфологической диагностики либо иммуногистохимического исследования, так и для получения второго мнения от ведущих специалистов нашей медицинской компании относительно имеющихся образцов ткани опухоли (часто называемого пациентами “пересмотр стёкол”), полученных при обследовании в другом онкоцентре.
Почему следует выбрать патоморфологическую лабораторию МИБС?
- исследование и оценка рассматриваемого материала проводится одновременно несколькими ведущими специалистами в центральной патоморфологической лаборатории МИБС в Санкт-Петербурге, сотрудничающей с федеральными онкологическими центрами.
- все вопросы логистики центр МИБС в вашем регионе берет на себя.
- МИБС владеет всеми технологиями, необходимыми для постановки правильного патоморфологического диагноза. От вас не потребуется проводить дополнительные исследования в других лабораториях.
- Иммуногистохимическое исследование может быть проведено в полном объеме за счет средств ОМС (бесплатно для пациента) при наличии направления по форме 14у.
Как заказать морфологическое / иммуногистохимическое исследование в МИБС?
- позвоните в любой центр МИБС в вашем регионе;
- привезите материал (гистологические препараты, парафиновые блоки, копию выписки из истории болезни и прочие документы, описывающие характер заболевания) в центр МИБС вашего города;
- получите заключение через 3-10 дней (в зависимости от вида и объема исследования).
руководитель патоморфологической службы
врач патологоанатом
доктор медицинских наук
Ошибки при диагностике онкозаболеваний, по данным независимых экспертов, происходят почти в 40% случаев. Самые грубые ошибки – это те, когда рак находят там, где его нет, либо, наоборот, пропускают злокачественную опухоль. Самые распространенные ошибки допускаются при морфологическом определении разновидности рака. В итоге – неверно выбранная тактика лечения и печальный итог.
Ошибки при диагностике онкологических заболеваний, по данным независимых экспертов, случаются почти в 40% случаев. Официальной статистики по этому вопросу не ведется. Самые грубые ошибки – это те, когда рак «находят» там, где его нет, либо, наоборот, пропускают злокачественную опухоль. Самые распространенные ошибки допускаются при типировании опухоли – морфологическом определении разновидности рака. В итоге – неверно выбранная тактика лечения и печальный итог.
Цена ошибки
Очень показателен в этом плане пациентский форум на сайте «Движения против рака».Вот некоторые сообщения оттуда. «У меня была ошибка в разновидности рака, а у подруги вообще повторная ИГХ (иммуногистохимия) не подтвердила диагноз. Я пересдавала в Израиле». «В одном месте – один результат ИГХ, в другом – оказался другой. Как понять, в каком месте правильный анализ? Где гарантия того, что и во втором месте не была допущена ошибка?». О том, как обстоят дела с диагностикой, пациенты и их родственники со всей страны рассказывают и координаторам Движения: «Диагноз поставили без установления очага, сейчас обострились симптомы, в другом городе платно установили диагноз и нашли очаг. Вернулся домой – изменили лечение», «ИГХ не делали и биопсию не брали, лечение подобрали наугад».
При этом, чем дальше оказывается пациент от центральных клиник, тем меньше у него шансов на адекватный диагноз. И ситуация эта не меняется десятилетиями. Как рассказала «МедНовостям» ветеран здравоохранения из отдаленного региона, когда еще в середине 70-х годов коллеги поставили ей диагноз «рак молочной железы», она первым же самолетом отвезла стекла в Москву. В итоге, диагноз не подтвердился.
По оценке главного онколога России, академика Михаила Давыдова, сегодня морфологически подтвержденный диагноз имеют лишь 40% онкологических больных. По данным Минздрава за 2014 год, эта цифра вдвое больше. Но даже официальная статистика признает, что, в 20% случаях, когда диагноз не был подтвержден морфологически, у больного могло оказаться все, что угодно – доброкачественная опухоль, паразит и т.п.
По данным занимающейся верификацией (перепроверкой гистологических диагнозов) медико-технологической компании Unim, около 40% диагнозов содержат ошибки – как при определении нозологии, так и при установлении злокачественности в целом. В некоторых видах нозологий этот процент выше. Например, некорректно диагностируются порядка 50% лимфом, а в случае опухолей ЦНС этот показатель достигает примерно 80%. Наиболее проблемные регионы в России – юг страны и Дальний Восток.
«Мы также провели небольшое исследование по диагнозу «рак молочной железы», — рассказал основатель UNIM Алексей Ремез. – В среднем, в региональном онкодиспансере проводится пять операций по удалению груди в день. При этом, по некоторым оценкам, одна операция в неделю по статистике выполнена на основании некорректно поставленного диагноза. То есть около 4% женщин ошибочно удаляют грудь».
Диагностический «конвейер»
Что приводит к ошибочным диагнозам и почему так важно получить «второе мнение» рассказал «МедНовостям» зав. патоморфологическим отделением ФГБУРДКБ, к.м.н.Дмитрий Рогожин.
— Процесс гистологической диагностики должен работать, как хорошо отлаженный конвейер. Каждый его этап должен быть очень хорошо продуман и выполнен по определенным стандартам, чтобы в конечном итоге получить качественный препарат, по которому может быть поставлен диагноз.Если нарушен хоть один из этих этапов, то качественного результата уже не будет. Когда в нашу или другую центральную клинику присылают материал для анализа, у нас часто возникают вопросы к адекватности уже самого этого материала.
зав. патоморфологическим отделением ФГБУ РДКБ, к.м.н. Дмитрий Рогожин
— Расскажите, пожалуйста, подробнее об этапах?
— Прежде всего, нужен нормальный объем материала. Прежде, чем выполнять биопсию (получение гистологического материала в операционной) хирург должен четко представлять себе, как он будет это делать. Если он попадает не в саму опухоль, а в зону реактивных изменений, то результата, естественно, не получится, и придется повторять операцию. Эту работу хирург должен обсуждать и планировать совместно с морфологом и рентгенологом (если речь идет об опухоли костей). Иногда и сама биопсия выполняется под контролем рентгенолога и в присутствии патолога.
Полученный гистологический материал должен быть определенным образом фиксирован в формалине и в кратчайшие сроки доставлен в патологоанатомическое отделение или гистологическую лабораторию, где его описывает патолог. Следующий этап – это гистологическая проводка (специальная химическая обработка тканей). Затем материал заливается в специальную среду, которую упрощенно называют парафин, после чего лаборант делает тонкие срезы и помещает их на специальное стекло. Срезы должным образом окрашиваются и подаются специалистам (патологоанатомам) для оценки.
И тут возможны два варианта. Либо нам достаточно данных, чтобы поставить окончательный диагноз, являющийся основанием для назначения соответствующего лечения. Либо, мы не можем сформулировать диагноз и должны провести дифференциальную диагностику между другими, имеющими сходное строение опухолями. В таких случаях применяется дополнительное исследование – иммуногистохимия (ИГХ). В зависимости от определенного набора антигенов на клетках самой опухоли, которое показывает это исследование, мы снова все оцениваем и формулируем окончательное заключение, которое также является руководством к действию. Это достаточно рутинный метод. Но, к сожалению, в регионах он используется далеко не везде.
— И в этом основная причина неверной диагностики? Или есть и другие проблемы?
— Есть и другие. В каждом регионе, конечно, свои особенности, но есть несколько общих основных проблем. Во-первых, это недостаточное финансирование. И, как следствие, отсутствие нормального оснащения – определенного оборудования и расходных материалов.
Вторая причина – нехватка опыта у специалистов и проблема с их координацией. Я уже говорил о взаимодействии хирурга, патолога и рентгенолога, которое уже на этапе планирования биопсии может сузить круг диагнозов и предварительно решить, с какой патологией мы имеем дело. В регионах зачастую такого междисциплинарного взаимодействия нет.
Другая серьезная проблема, с которой сталкиваются и крупные центральные учреждения, и региональные клиники – это редкие диагнозы. Можно проработать всю жизнь и не встретиться с каким-то видом опухоли. И тут уже дело не в низкой квалификации врача, а в специализации. У каждого врача патологоанатома есть сертификат. И он должен смотреть весь материал, любую биопсию. А это не совсем правильно. Не зря же существуют различные специальности внутри медицины и подразделения внутри самих специальностей, когда человек занимается узким спектром проблем.
Также и патологоанатом должен специализироваться на чем-то определенном. Если он сталкивается с опухолью, с которой никогда не имел дела, он может сделать ошибочное заключение. Правильно диагностированная опухоль, это и определенная программа лечения именно этой опухоли, а следовательно и прогноз. Если вследствие ошибки патологоанатома был применен не тот протокол лечения, то цена такой ошибки может быть очень высока.
— И что же делать?
— Очень важно получать второе мнение, для чего и существуют референсные центры в крупных клиниках в зависимости от их специализации. Если в регионе патолог видит опухоль в первый раз, то он должен выступить в роли стрелочника: если, например, это опухоль костей – предложить отправить ее в РДКБ, если опухоль лимфатических узлов – в ДГОИ им. Рогачева, где есть специалисты, которые занимаются только лимфомами и лейкозами. Они таких опухолей видят десятки в день, у них колоссальный опыт.
Система, при которой требуется получить независимое второе мнение, существует во всем цивилизованном мире. И если диагнозы совпадают, вероятность ошибки сводится к минимуму, и больше уверенности, что лечение будет назначено правильно. В центральных российских клиниках также имеется такая практика. В РДКБ у нас есть онкологическое отделение, куда поступают дети с редкими заболеваниями, опухолями костей и мягких тканей. Мы выставляем свой диагноз и, как правило, материал направляется в другое центральное лечебное учреждение, чтобы получить второе заключение. Это может быть РОНЦ имени Блохина, либо ДГОИ им. Рогачева, либо какое-то другое лечебное учреждение. Бывает, что диагнозы не совпадают, и тогда желательно получить третье заключение, скажем у зарубежных коллег.
Сейчас появилась возможность консультироваться у зарубежных экспертов, не отправляя им сам материал – российская компания UNIM разработала программу Digital Pathology для дистанционной диагностики. Мы загружаем в эту систему оцифрованные с помощью специального сканирующего микроскопа гистологические препараты, и зарубежный эксперт может их рассматривать на экране компьютера так же, как смотрел бы под микроскопом. Он может их увеличивать, уменьшать, рассматривать любые поля зрения, ставить метки, что-то измерять.
Кроме того, должным образом отсортированные препараты составляют электронный архив, к которому при необходимости можно вернуться в любое время. Такая необходимость возникает, например, когда спустя несколько лет после лечения у больного возникает рецидив заболевания. Мы должны вернуться к старому материалу, сравнить и установить причинно-следственную связь. Теоретически, парафиновые блоки, из которых можно заново изготовить гистологические препараты, могут храниться практически вечно (при наличии определенных условий). Но их качество с годами все равно снижается, и если для уточнения диагноза требуются дополнительные исследования – иммунохимические или цитогенетические – с этим материалом работать уже намного сложнее. С электронным архивом таких проблем нет.
— А внутри страны используются такие технологии?
— Да, такая система хорошо работает и внутри страны. Заключаются контракты с лечебными учреждениями в регионах. И там, где это позволяет качество и оборудование, гистологические препараты сканируют и присылают к нам на референс. Это абсолютно логичное и прогрессивное решение проблемы.
В нашей клинике лечатся дети изо всех регионов России. У нас есть телемедицинский центр, позволяющий проводить дистанционные консультации. Наши и региональные специалисты могут собраться и вместе определить какие-то моменты в лечении ребенка. А теперь еще мы можем проконсультировать и гистологические препараты. Это очень здорово!
Но и тут главная проблема – дефицит финансирования в регионах. А зачастую, еще и отсутствие понимания этой проблемы – это сразу же исключает возможность использования новых технологий. Конечно, не все регионы находятся в равном положении. Например, в Ростове и Ростовской области, которые привлекают к себе всю южную территорию страны, работа поставлена очень хорошо. Там понимают и соблюдают все этапы получения гистологических препаратов и предоставляют нам качественные материалы. Но есть регионы, которые не обращаются к нам совсем. И пациентам, которые хотят получить второе мнение, приходится решать эту проблему в частном порядке и по старинке – самим везти свой материал в Москву или передавать с курьером.
О Втором мнении (second opinion) в медицине говорят тогда, когда результаты диагностических исследований отправляются на повторную консультацию к специалисту узкого профиля — эксперту в определенной области медицины. Такая консультация помогает подтвердить или опровергнуть первичный диагноз, сделать его более точным и детально разобраться в состоянии пациента. Чаще всего ко Второму мнению прибегают, когда у пациента выявляется онкологическое заболевание.
В развитых странах получение Второго мнения врача при раке довольно распространено. Ведь любой человек, оказавшись один на один с тяжелым заболеванием, прежде всего захочет получить консультацию опытного специалиста, который даст надежду на выздоровление и предложит наиболее современные способы лечения.
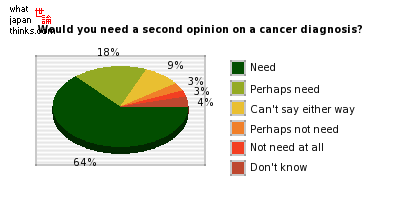
Социологический опрос в Японии: «Понадобилось бы вам второе мнение для диагностики рака?» Ответ в 64 % — ДА.
В России диагностика онкологических заболеваний зависит и от уровня оснащенности больниц, и от опыта врачей. Как правило, ошибки диагностики рака в маленьких городах связаны с общим невысоким уровнем медицинской помощи. Поэтому, если врач ставит неправильный диагноз — не спешите обвинять его во всех грехах. Лучше подумайте над тем, где получить консультацию более опытного и квалифицированного специалиста.
КТ и МРТ при раке — как повысить точность диагностики?
В наше время диагностика почти всех форм рака не обходится без современных лучевых методов, таких как компьютерная или магнитно-резонансная томография, маммография или ПЭТ. Эти методы позволяют выявить опухоль на ранних стадиях, точно определить ее размеры, положение, прорастание окружающих органов и другие важные детали. Но проблема состоит в том, что не все врачи одинаково хорошо владеют методикой анализа, чтения снимков. Разумеется, хороший специалист может оказаться в любой больнице, но нередко «обычные» рентгенологи слабо знают специфику онкологических болезней, и могут допустить ошибку. Поэтому, чтобы снизить риск врачебной ошибки, необходимо получить Второе мнение врача, который давно работает с онкологическими пациентами и хорошо разбирается в особенностях рентгенологической картины различных опухолевых заболеваний
Пересмотр КТ, МРТ и ПЭТ-КТ в онкологии
Врачи-онкологи уже привыкли к тому, что для правильной диагностики рака необходим пересмотр гистологических исследований (результатов биопсии). Ведь нужно точно ответить на вопрос, есть или нет признаков злокачественной опухоли на полученных гистологических срезах.
Аналогичным образом завоевывает популярность повторный анализ результатов КТ, МРТ или ПЭТ-КТ. Ведь правильная расшифровка снимков КТ или МРТ зачастую имеет решающее значение: с ее помощью точно устанавливается стадия рака, принимается решение о необходимости операции, планируется вид химиотерапии и т.п. Если онколог принимает ответственные решения, ему не обойтись без грамотного и четкого анализа снимков.
Зачем нужно второе мнение по КТ и МРТ?
Пересмотр снимков КТ, МРТ или ПЭТ узким специалистом-радиологом помогает решить следующие задачи:
- Достоверно выявить или исключить опухоль, правильно интерпретировать рентгенологические признаки
- Выявить объективные признаки доброкачественности или злокачественности опухоли
- Помочь онкологам правильно диагностировать стадию опухоли. Лучевые методы диагностики выявляют важные признаки, позволяющие уже на дооперационном этапе с большой долей уверенностью сказать, какую стадию имеет рак. Например, компьютерная томография при раке легкого выявляет размеры опухоли и прорастание бронхов, ПЭТ-КТ при раке молочной железы выявляет пораженные метастазами лимфоузлы. Точная оценка всех важных деталей невозможна без опытного взгляда диагноста, который специализируется на онкологических заболеваниях.
- Точно установить состояние окружающих органов, исключить прорастание опухоли в прилежащие сосуды, лимфатические узлы и другие структуры. Все эти подробности влияют на выбор вида операции, химио- и лучевой терапии
Как получить второе мнение по снимкам?
Заказать экспертную расшифровку КТ, МРТ или ПЭТ-КТ при подозрении на онкологическое заболевание можно в Национальной телерадиологической сети (НТРС) — системе удаленных консультаций врачей-радиологов, куда стекаются сложные случаи со всей России. Достаточно иметь запись исследования на диске. Консультация по снимкам МРТ или КТ осуществляется дистанционно: вы загружаете снимки с любого компьютера через сайт НТРС, и через 24 часа получаете заключение врача-рентгенолога с его подписью и печатью, с подробным описанием снимков и рекомендациями по дальнейшему обследованию. Консультируют специалисты из известных профильных центров: Институт хирургии Вишневского, Военно-медицинская академия, Институт мозга человека и т.п.
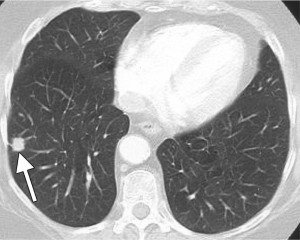
Компьютерная томография легких выявила очаговое образование нижней доли. Что оно собой представляет — рак, туберкулому, туберкулез или доброкачественную опухоль? Второе мнение с расшифровкой КТ опытным врачом-рентгенологом помогает решить эту проблему.
Что делать, если диагнозы не совпадают?
Нужно понимать, что окончательный диагноз ставится не рентгенологом, а лечащим врачом (хирургом, терапевтом, неврологом и т.д.). Однако зачастую результаты лучевых исследований (рентгена, КТ, МРТ, ПЭТ-КТ) очень часто играют ключевую роль при постановке диагноза. Получив заключение опытного рентгенолога, лечащий врач получит ценную информацию, которая поможет ему в определении формы и стадии рака, планирования операции, назначения химиотерапии и т.д.
Читать подробнее о Втором мнении
Читать подробнее о телемедицине
Кандидат медицинских наук, член Европейского общества радиологов
Как часто женщине нужно проверяться на рак груди?
Здесь нет однозначного ответа. Никто точно не скажет, как часто молодой здоровой женщине до 40 лет нужно ходить к врачу. Когда врач сидит на 10-минутном приеме, ему легче сказать: «Приходите раз в год. Все, до свидания, следующий, заходите». У меня прием длится полчаса, и я специально оставляю хотя бы пять минут в конце, чтобы объяснить, что нет универсальных рекомендаций. Нужно уделять внимание своей груди, осматривать ее, но как часто это делать — тоже никто не знает. Самообследование не приводит к снижению смертности от болезни, но при этом каждую четвертую опухоль женщины находят сами. На сегодня мы еще не изобрели таких диагностических методов, которые нам до биопсии скажут: с грудью все ок или не ок.
После 40 лет все более-менее понятно: с этого возраста риск заболеть раком молочной железы достоверно увеличивается. Одни медицинские организации говорят, что скрининг (Обследование здоровых людей с целью выявить у них заболевание, которое пока никак себя не проявляет. — Прим. ред.) пора делать с 40 лет, другие — с 45 лет. Частота обследований тоже отличается. Рекомендации немного расходятся в зависимости от системы здравоохранения. В Америке есть как минимум две организации, которые занимаются разработкой программы скрининга: Рабочая группа по профилактике заболеваний (USPSTF) и Американское онкологическое общество. У них разные рекомендации, потому что в некоторых штатах преобладает афроамериканское население, которое болеет тяжелее. В Великобритании проверяют с 50 лет раз в три года.
Сам скрининг проводят до 75 лет, это связано с продолжительностью жизни. Нет смысла проводить скрининговое обследование, если ожидаемая продолжительность жизни менее 10 лет. Потому что, скорее всего, то, что мы обнаружим, не сократит жизнь этого человека, а медицинской системе обойдется дорого.
В России насчет скринингов все говорят разное. Например, некоторые гинекологи считают, что после 40 лет маммографию нужно делать ежегодно или хотя бы раз в два года, а после 50 лет — ежегодно. Но на самом деле мы не знаем, как часто нужно проходить маммографию. Поэтому пропагандировать, что это надо делать раз в год, без объяснения того, что это за исследование и что делать с его результатами, — неправильно.
И каждый раз думаю: боже, сколько неправильных действий могут повлечь за собой какие-либо рекомендации. Из-за этого я завела свой блог. Мне кажется, что основная проблема не в том, делаем мы маммографию или не делаем, а в том, что мы не общаемся с пациентами. У меня много пациенток, которые приходят с болью или находят у себя уплотнение, и тогда мы с ними прицельно разбираемся, что боль в молочной железе — это не спутник онкологического заболевания, что уплотнение — это просто локальный фиброаденоматоз, так ведет себя железистая ткань. Мы можем сходить с пациенткой на УЗИ и уточнить это или понаблюдать динамику.
Рекомендации — это такая штука, которая нас может поддержать. Но принимаем решение мы сами: врач и пациент. У меня была молодая пациентка, которая прошла химиотерапию, операцию и была вынуждена принимать препарат, вызывающий искусственную менопаузу. В какой-то момент она сказала, что больше не может, мы обсудили все риски и приняли решение отказаться от лекарства, тем самым повысив вероятность рецидива. Но это было общее решение. Без желания пациента его лечить никто не будет.
Кому-то дают странную рекомендацию ходить каждые полгода на УЗИ. Вот пациентка ходит, делает очередное УЗИ, ей говорят, что все нормально, проходит два месяца, и она приходит ко мне с шишкой. А там рак. И она сидит в слезах на приеме: «Я ходила каждые полгода, потому что мне так сказали». Скрининг направлен на то, чтобы поймать рак, когда еще нет симптомов. Но не всех можно поймать.
Есть такая фраза, что мы скринингом пытаемся поймать «орлов» и «зайцев» — это быстрые, стремительные, очень внезапные раки, а ловим «черепашек», потому что они ползут-ползут и вот в какой-то момент мы находим их на маммографии.
«Черепашек» нужно лечить или можно их не трогать?
«Черепашки» — это не камни, которые не двигаются. Они все равно прогрессируют. Мы никогда не узнаем, как они себя поведут, потому что неэтично не лечить рак. Нет критериев, которые бы сказали, можно злокачественную опухоль наблюдать или ее нужно сразу же лечить. Вот есть карцинома in situ, это неинвазивный рак. После того, как его обнаружили, у женщины в восемь раз увеличивается риск инвазивного рака.
Инвазивный рак — один из основных раков молочной железы, это порядка 70% случаев. Пока опухоль внутри молочного протока — это нулевая стадия рака, он не может метастазировать. Инвазивный рак — это уже опухоль, которая вышла за пределы протока и у нее появляется шанс дать метастазы. И вот, казалось бы, что карциномы in situ можно наблюдать без вмешательства, но нет, потому что они могут развиваться в инвазивную опухоль.
А вот дольковая карцинома in situ не является злокачественной опухолью. Это стало понятно совсем недавно — в 2017 году, до этого к ней относились так же, как к внутрипротоковой карциноме. А теперь стало понятно, что она доброкачественная и ее не нужно оперировать. На сегодня нет таких форм рака молочной железы, которые этично наблюдать, в отличие например от некоторых видов рака предстательной железы.
Как врач определяет, рак перед ним или не рак?
В тот момент, когда мы ловим что-то в груди, мы не знаем, что это. Это кот в мешке. Биопсия все решает, и без нее лечение от рака никто не начнет. Даже пункция (Подвид биопсии, когда берут взвесь клеток, а не кусочек ткани. — Прим. ред.) не является основанием для лечения.
Решение о том, проводить биопсию или нет, принимают согласно критериям BI-RADS — Breast Imaging Reporting and Data System. Это шкала от нуля до шести, по которой рентгенолог ставит балл на основании маммографии, УЗИ или МРТ. BI-RADS 0 означает, что нужен дополнительный анализ, BI-RADS 2 — что опухоль доброкачественная, BI-RADS 4 — что есть подозрение на рак. С этим результатом пациентка приходит к онкологу или клиническому рентгенологу, и он принимает решение, делать биопсию или нет.
Рентгенолог может поставить BI-RADS 3. Это меньше 2% вероятности того, что есть рак молочной железы. Если BI-RADS больше, то нужно будет принять решение о биопсии, но образование совершенно не обязательно окажется раком. На биопсии рак уже нельзя перепутать с чем-то. Если это опухоль, это опухоль.
Если посмотреть на графики заболеваемости раком груди и смертности от него в России, видно, что заболеваемость растет, а смертность нет. Как это можно объяснить, по-вашему?
Это реально так. Проблема в том, что мы не можем понять достоверно: это потому, что мы делаем скрининг и лечим лучше, чем раньше, или только потому, что просто лечим лучше? Прерывать то или другое для того, чтобы выяснить причину, — неэтично, потому что от рака умирают.
Основной плюс маммографии не только в том, чтобы держать смертность под контролем. Маммография сильно влияет на объем лечения. Когда мы обнаруживаем опухоль на первой стадии, без симптомов, у нас есть возможность пролечить минимально: прооперировать и назначить профилактические таблетки. Когда этот же рак доходит до стадии клинических симптомов, мы уже не можем только этим обойтись. Тогда мы должны прооперировать еще подмышку, что увеличивает риски лимфатического отека, провести химиотерапию, которая снижает качество жизни, и так далее.
Может ли врач пропустить рак?
Конечно, это огромная проблема. В трети случаев рак может быть не найден при маммографии. Есть, во-первых, рентгенонегативные раки, которые на рентгене не видны. Именно поэтому очень важно сначала осмотреть пациента, а потом назначать исследования. А то может прийти 45-летняя женщина на маммографию, и ей напишут по результатам снимка: все ок. И она думает: ага, значит, эта шишечка — ничего страшного.
Да, бывает, что доктор ошибается, считает, что в анализах нет ничего страшного и не надо делать биопсию, или получает неинформативную биопсию и назначает какую-нибудь травку, просто чтобы пациента не оставлять без наблюдения. Хорошо, если пациент придет на следующее обследование пораньше.
А может врач, наоборот, перестраховаться там, где не надо?
У меня сейчас наблюдается пациентка. Что-то ее забеспокоило, закололо, и она пришла. Ей сделали маммографию, рентгенолог написал, что все нормально, а я вижу на снимке скопление кальцинатов (солей кальция) и тень в этом месте. То есть то ли он не видел, то ли он просто копипаст сделал, не понятно. И вот здесь начинаются минусы гипердиагностики.
Я говорю: «Вы знаете, тут что-то подозрительное, надо идти и делать не скрининговую маммографию, а прицельную, на которой сомнительное место фотографируют при увеличении». Естественно, пациентка волнуется. Она записывается на процедуру, ждет. По результатам снимка ей пишут BI-RADS 4, то есть нужно делать биопсию. Я тоже нервничаю, потому что недавно в том же самом месте писали, что все нормально, BI-RADS 2, а теперь когда я отправила эту пациентку досмотреть, пишут 4.
Потом мы идем на УЗИ, там ничего нет. Она записывается на МРТ — опять ожидание, ведь МРТ делают в определенный день цикла, а он у нее скачет. Она получает результат МРТ, там все нормально, но я прошу коллегу пересмотреть.
Мультимодальных диагностов молочной железы, которые владеют всеми методами диагностики, у нас в стране немного. Мне говорят: «Тут ничего нет, это нормальные кальцинаты, не подозрительные. Понятно, почему они тебя заинтересовали, но на прицельном снимке все ок». Я отвечаю: «Но рентгенологи BI-RADS 4 ставят, что они там видят-то?» Пациентка все это время была как на пороховой бочке.
Вот что происходит из-за гипердиагностики. Биопсию ей мы делать не стали. Но через полгода все нужно повторять, потому что я не могу отпустить ее на два года до следующего осмотра.
Это проблема интерпретации снимков?
Да, это проблема чтения снимков. Не знаю, может, я запустила эту волну и коллеги напугались, может, смотрел кто-то не совсем опытный. Проблема в том, что у нас нет метода диагностики до биопсии, который отвечает на вопрос: да-да, нет-нет.
В скандинавских странах одна из образцовых систем скрининга: там сидят два опытных рентгенолога и отсматривают снимки. Если их мнение совпадает, пациентке выдают диагноз. А если у них мнение не совпадает, то с ними проводят работу над ошибками. А у нас на скрининге, наоборот, сидят люди, которые вчера выпустились, потому что опытным интереснее где-нибудь еще.
Маммограмму еще нужно качественно отснять. Даже с прицельной маммограммой можно ошибиться. Но, каким бы ни было качество снимка, если человек не умеет интерпретировать, у него недостаточно опыта или он перестраховывается — от ошибок не уйти.
Еще надо понимать, что у одного доктора может быть этих маммограмм тридцать штук за день. Это же нереально. Человек может принять до семи, максимум девяти взвешенных решений, если он себя круто прокачал. А у нас люди продолжают сидеть, принимать по тридцать человек и отсматривать по тридцать снимков.
Какие еще есть минусы у гипердиагностики помимо лишних обследований и волнений?
Человек может проходить ненужную биопсию, ведь кто-то сделал бы биопсию в случае с моей пациенткой, о котором я рассказывала выше. Рентгенолог же поставил BI-RADS 4. Каждый рентгенолог может ошибиться, не только неграмотный или тот, который перестраховался.
Бывают более неоднозначные случаи. У меня была пациентка из государственной поликлиники, которая пришла с заключением BI-RADS 4 с обеих сторон груди. Я смотрю ее на УЗИ — там ничего. Смотрю маммограмму — ну да, есть скопление кальцинатов, но даже я вижу, что ничего страшного, хотя я не рентгенолог.
Ей вполне могли сделать биопсию, лечить бы не лечили, но понервничать заставили. Гипердиагностика неприятна именно из-за ненужных процедур, ненужных биопсий и больших переживаний по этому поводу.
Еще есть проблема в том, что в некоторых клиниках просто так назначают обследования. До «Чайки» я работала в клинике, где после каждого пациента меня вызывали на ковер и спрашивали: «Почему вы не назначили пациентке анализ крови, мочи, кала, где УЗИ?» Я говорю: «Без симптомов УЗИ делать не надо». А они ссылаются на рекомендации акушеров-гинекологов, на внутренние протоколы, которых никто никогда не видел. Онкомаркеры — это вообще любимейшая тема. «Почему вы ей не назначили онкомаркеры?» — говорят. Потому что их никому не надо назначать.
Так что я представляю себе этот кошмар, с которым пациентки могут встретиться. Поэтому лучше идти в клинику и к врачу, которому доверяешь
Цитологический метод в диагностике опухолей и опухолеподобных процессов
Цитопатология, клиническая или диагностическая цитология, изучает клеточный состав патологических процессов. В качестве отдельной медицинской специальности официально признана в 1941 г. после работ Папаниколау Г. и Траута Н. К чести нашей страны разработка цитологического метода диагностики начата в 1938 г. в клинико-диагностической лаборатории Московского научно-исследовательского онкологического института им. П.А. Герцена. В 1941 г. профессор Н.Н. Шиллер-Волкова на сессии института доложила о первых результатах по исследованию выделений из влагалища, мокроты и пунктатов. В развитии цитологии можно выделить три основных этапа: эксфолиативная, в основном гинекологическая цитопатология; аспирационная цитология, бурный расцвет которой начинается с 80-х годов и связан с внедрением ультразвуковой диагностики, и современный этап развития определяется применением иммуноцитохимических и молекулярных методов исследования, а также автоматизированного скрининга в гинекологической цитологии.
Цитологический метод технически прост, быстр, сравнительно дешев, малотравматичен. Однако «легкость» цитологического метода обманчива, так как цитологическое исследование должно заканчиваться формулировкой заключения, основываясь на котором разрабатывается тактика лечения.
По способу получения материала цитологию можно подразделить на дооперационную (эксфолиативную, абразивную, аспирационную) и интраоперационную. Эксфолиативная цитология включает в себя исследование вагинальных мазков, мокроты, мочи, плевральной, перитонеальной, перикардиальной, цереброспинальной, синовиальной жидкости и т.д. Этот раздел цитологии отличается простотой техники получения большого количества различного типа клеток, в том числе воспалительного ряда. Клеточный материал может быть не очень хорошо сохранен. Для получения информативного материала с поверхности патологического очага удаляют гноевидные массы, корочки, некротический налет. Если полученный материал представляет жидкость, то в нее добавляется цитрат натрия, чтобы жидкость не свернулась.
Абразивная цитология получает материал из определенного участка внутренних органов, в том числе исследуются субэпителиальные поражения с помощью фиброоптических инструментов. При таком взятии материала клетки хорошо сохраняются, и препараты легко интерпретировать. Материал получают из шейки матки, вагины, эндометрия, респираторного, желудочно-кишечного, мочеполового тракта.
Тонкоигольная биопсия в настоящее время позволяет получить материал практически из любого органа. Метод постоянно совершенствуется и дает оптимальные результаты, что делает его в плане диагностики высокоэффективным и экономичным.
Взятый для цитологического исследования материал помещают на край предметного стекла и другим предметным или покровным стеклом равномерно, сильно не надавливая, тонким слоем распределяют по всей поверхности препарата.
В последние годы помимо рутинных цитологических мазков для получения качественных монослойных цитологических препаратов используется жидкостная система: пунктаты вносятся в специальную среду накопления, после чего центрифугируются в режиме 1000 оборотов в течение 5 минут при среднем ускорении на центрифуге (Суtospin-3, Суtospin-4). Применение методики жидкостной цитологии имеет ряд преимуществ: обеспечивает сохранность клеточных структур, уменьшает фон, клетки сосредотачиваются в одном месте – «окошке», что сокращает время просмотра препарата и значительно экономит дорогие сыворотки при проведении иммуноцитохимического исследова-
ния. Для создания архива и возможности последующего исследования материала используется методика Cell-block, при которой получаются препараты, занимающие промежуточное положение между цитологическими и гистологическими.
Влажная фиксация препарата в спирте сразу после взятия мазков применяется при окраске по Папаниколау. В остальных случаях мазки высушивают на воздухе, а затем фиксируют уже в лаборатории. Наиболее распространенный способ фиксации – в равных объемах спирта и эфира (смесь Никифорова). Для иммуноцитохимического исследования применяют фиксацию ацетоном. При окраске мазков используют панхромную окраску азур-эозином по методу Романовского – Гимза в различных модификациях (Лейшмана, Паппенгейма), а также окраска гематоксилином и эозином, особенно при исследовании гинекологического материала используется окраска по Папаниколау. Возможно при рутинном исследовании или специальной окраске выявление бактериальной флоры, в том числе бацилл Коха, лепры, хеликобактера, трихомонад и т.д.
Цитологическая диагностика основана на следующих принципах:
- Разница клеточного состава в норме и патологии.
- Оценка не одной отдельно взятой клетки, а совокупности клеток, большое значение придается фону препарата.
- Цитолог должен иметь патологоанатомический базис.
- Каждое исследование завершается формулировкой заключения.
Критерии цитологической диагностики злокачественных новообразований составляются из оценки клетки, ядра и ядрышка.
Клетка:
– увеличена в размере, иногда гигантская, редко размер близок к норме, что затрудняет цитологическую диагностику, например, при коллоидном, тубулярном раке, маститоподобном варианте долькового рака молочной железы, фолликулярном раке щитовидной железы, карциноиде, почечноклеточном светлоклеточном раке, высокодифференцированных веретеноклеточных саркомах;
– изменение формы и полиморфизм клеточных элементов;
– нарушение соотношения ядра и цитоплазмы в сторону увеличения доли ядра;
– диссоциация степени зрелости ядра и цитоплазмы, например, молодое ядро в ороговевшей цитоплазме при высокодифференцированном плоскоклеточном раке.
Ядро:
– увеличение размера, полиморфизм, бугристость, неравномерный рисунок хроматина, наиболее постоянный признак – неровность контуров, гиперхромия, фигуры клеточного деления в цитологических препаратах сравнительно редки.
Ядрышко:
– число ядрышек больше, чем в нормальной клетке, ядрышки увеличены в размере, неправильной формы.
Несмотря на присутствие критериев злокачественности у подавляющего большинства клеток, в некоторых клетках рака эти критерии могут отсутствовать или быть выражены в неполном объеме. Необходимо обращать внимание на особенности взаимного расположения клеток, характер межклеточных связей. Заключение формулируют по совокупности признаков при достаточном количестве клеточного материала. Попытка оценить мазок по неадекватно взятому материалу – наиболее частая причина ошибочных заключений.
Основные задачи цитологической диагностики состоят в следующем:
- Формулировка заключения до лечения.
- Интраоперационная срочная диагностика.
- Контроль эффективности лечения.
- Оценка важнейших факторов прогноза течения заболевания.
Цитологическое заключение до лечения включает:
- определение гистогенеза новообразований;
- установление степени дифференцировки опухолевого процесса;
- уточнение степени распространенности опухоли;
- изучение фоновых изменений;
- определение некоторых факторов прогноза;
- возможность исследования бактериальной флоры.
Современное цитологическое заключение не только констатирует наличие рака, но и указывает гистологический тип опухоли и степень дифференцировки согласно общепринятым международным классификациям (МКБ-О и ВОЗ).
Критериями достоверности цитологического метода являются результаты сопоставления с плановым гистологическим исследованием. Наибольший процент совпадений цитологического заключения с окончательным гистологическим заключением наблюдается при исследовании образований кожи, молочной, щитовидной железы, при метастатическом поражении лимфатических узлов. Результаты исследования гиперпластических процессов в эндометрии неудовлетворительны (достоверность 30–50%) и заставляют искать пути совершенствования диагностики. Достоверность цитологической диагностики патологии шейки матки составляет 75–90%. 3–24% исследований, в зависимости от локализации и способа получения материала, оказываются неудачными из-за неадекватно полученного, неинформативного материала.
Таблица 1. Достоверность цитологических исследований
опухолей различных локализаций.
| Локализация | % совпадения цитологического и гистологического диагноза | % совпадения по данным литературы | % неудавшихся пункций |
|---|---|---|---|
| Легкое | 95,5-97 | 79-98 | 2,9-3,0 |
| Молочная железа | 95,8-97,4 | 90-96 | 2,6-8,3 |
| Лимфатические узлы | 98,4-98,7 | 90 | 1,6-10,7 |
| Кожа | 91,2-92,7 | 90-98 | 2,4-12,5 |
| Мягкие ткани (без указания гистологического типа опухоли) |
90,2-93,8 | 65-93,4 | 5-12,3 |
| Желудочно-кишечный тракт | 92,3-97,5 | 73-93,6 | 2,5-4,4 |
| Щитовидная железа | 85,5-93,2 | 57-94 | 1,6-4,2 |
| Шейка матки | 89,5-93,2 | 65-90 | 3,5-4,5 |
| Эндометрий | 78,9-84,8 | 30-90 | 3,8-15,4 |
| Почка | 86,2-89,3 | 76,4-91,3 | 7,1-11,5 |
| Экссудаты | 95,7-100 | – | 1,2-2,7 |
Уверенное цитологическое заключение о наличии злокачественного новообразования, совпадающее с клиническими симптомами и данными других диагностических исследований, расценивается как морфологическое подтверждение диагноза злокачественной опухоли. Это предъявляет к цитологическому методу высокие требования и заставляет искать пути предупреждения возможных ошибок. По характеру ошибки цитологов можно разделить на две большие группы: ложноотрицательные и ложноположительные. Ложноотрицательные заключения преобладают и приводят к гиподиагностике опухолевого процесса, чаще всего из-за небольшого количества информативного материала в пунктате. Имеются и объективные трудности в оценке изменений, связанные чаще с высокой дифференцировкой опухоли, например, практически невозможно диагностировать фолликулярный рак щитовидной железы с минимальной инвазией, трудно диагностируется тубулярный, маститоподобная форма долькового рака молочной железы.
Гипердиагностика опухолей на нашем материале многие годы не превышает 1%, однако может служить причиной ненужного, а иногда и калечащего лечения. Истинная гипердиагностика, то есть ложное цитологическое заключение о наличии опухоли, объясняется несколькими наиболее типичными причинами.
Выраженная пролиферация клеточных элементов является наиболее частой причиной гипердиагностики рака. Например, пролиферация эпителия протоков и долек молочной железы при фиброаденоме и пролиферирующем аденозе, особенно при укрупнении ядер, наиболее часто приводит к гипердиагностике рака молочной железы. Правильной диагностике помогает анализ ядерных характеристик клеток опухоли: наличие ровных контуров ядра и равномерное распределение хроматина.
Реактивные изменения эпителия служат также нередкой причиной неадекватной цитологической диагностики. Наиболее тяжелые ошибки встречаются при ангиомиолипоме почки, при которой реактивные изменения почечного эпителия с укрупнением и полиморфизмом ядер приводят к ошибочному диагнозу высокодифференцированного почечноклеточного светлоклеточного рака. Диагностике ангиомиолипомы помогает обнаружение сосудистых структур и веретенообразных клеток, экспрессирующих виментин, десмин, НМВ-45.
Хронический аутоиммунный тиреоидит типа Хашимото сопровождается образованием сосочковоподобных структур, к оценке которых необходимо подходить осторожно и помнить, что при этом процессе реактивные изменения эпителия можно ошибочно принять за папиллярный рак щитовидной железы. Для хронических дерматитов, язв характерны атипические реактивные разрастания многослойного плоского эпителия, нередко представляющие непреодолимые трудности в дифференциальной диагностике с высокодифференцированным плоскоклеточным раком.
Выраженные дистрофические изменения клеток являются также одной из причин ошибочной цитологической диагностики. Например, выраженная жировая дистрофия гепатоцитов может привести к гипердиагностике метастаза почечноклеточного светлоклеточного рака, особенно при уже состоявшемся диагнозе рака почки.
Большую проблему цитологии представляет дифференциальная диагностика различных степеней диспластических изменений эпителия и внутриэпителиального рака. Присутствие при тяжелой дисплазии полиморфных крупных клеток с большими неправильно округлыми ядрами, иногда с увеличенными ядрышками, двуядерных клеток с тяжистым рисунком хроматина может быть неверно расценено как рак. При диспластических изменениях плоского эпителия необходимо учесть, что большинство клеток сходны с клетками глубоких слоев, крупные атипические клетки находятся в тесной связи с клетками без признаков атипии, имеются клетки стромы. Для объективизации дифференциальной диагностики различных степеней дисплазии и внутриэпителиального рака желательно проведение морфометрии клеток и ядер, что позволяет значительно снизить процент ошибочных заключений.
Нередко причиной гипердиагностики метастатического поражения в лимфатических узлах являются комплексы клеток укрупненного эндотелия и гистиоцитов, образующих эпителиоподобные структуры, а также наличие макрофагов с содержанием бурого пигмента. При затруднениях диагностики помогает иммуноцитохимическое исследование с небольшим набором антител (VIII фактор, цитокератины, ЭМА, НМВ-45), позволяющее подтвердить или отвергнуть наличие метастазов рака или меланомы.
Во избежание ошибок морфологической диагностики большое значение имеет четкое указание на характер проведенного лечения. Например, прием довольно распространенного антибиотика тетрациклина приводит к накоплению в клетках щитовидной железы бурого пигмента и ошибочному диагнозу метастаза меланомы. Прием мерказолила при зобе сопровождается резким полиморфизмом фолликулярного эпителия, что служит причиной цитологической и даже гистологической гипердиагностики фолликулярного рака. Проведение лучевой терапии вызывает выраженные изменения не только опухолевых клеток, но и нормального эпителия: укрупнение, полиморфизм клеток, патологическое ороговение, что является причиной гипердиагностики рака.
Имеются и объективные диагностические проблемы, например, в дифференциальной диагностике между эндометриоидной высокодифференцированной аденокарциномой и атипической гиперплазией эндометрия, себоррейной (базальноклеточной) кератомой и базально-клеточным раком, инфекционным мононуклеозом и болезнью Ходжкина, где достаточно высокий процент ошибочных заключений и требуется дальнейшая разработка цитологических критериев диагностики.
Знание клинической картины, характера проведенного лечения, применение современных методик морфологической диагностики с использованием иммуноцитохимии и морфометрии способствует сведению случаев гипердиагностики к нулю.
Вместе с истинной цитологической гипердиагностикой существует ложная гипердиагностика, когда цитолог дает уверенное заключение о злокачественном процессе, а при гистологическом исследовании опухоли не обнаруживается, то есть фактически имеет место гистологическая гиподиагностика. Пересмотр цитологических препаратов несколькими высококвалифицированными специалистами, повторное взятие биопсии, клиническое течение заболевания в дальнейшем подтверждают результаты цитологического исследования. Больше всего ложной цитологической гипердиагностики относится к исследованию биопсийного материала из бронхов и гортани, а также при исследовании лимфатическиих узлов, когда при цитологическом исследовании выявлялись единичные комплексы анаплазированных клеток, несомненно принадлежащих раку. При приготовлении гистологических препаратов эти комплексы теряются в готовых гистологических препаратах. Реальная потеря немногочисленных опухолевых клеток при приготовлении гистологических препаратов не допускает игнорирования клиницистом данных цитологического исследования и приводит к «золотому» стандарту – совместному цитологическому и гистологическому исследованию биоптата.
Интраоперационная цитологическая диагностика – одно из основных направлений цитологического метода исследования. Во время операции, используя цитологический метод, уточняется характер патологического процесса, степень распространенности с выявлением метастазов в лимфатические узлы, печень и другие органы, производится контроль радикальности выполненной операции с исследованием краев резекции. Роль цитологии возрастает при разработке показаний к расширенным лимфоаденэктомиям и при определении так называемых «сторожевых», или «сигнальных», лимфатических узлов, которых может быть шесть, и применение гистологического метода невозможно из-за длительности исследования. По данным ведущих клиник, ошибка срочного гистологического исследования «сторожевых» лимфатических узлов составляет 25%, поэтому они рекомендуют использовать интраоперационное цитологическое исследование отпечатков с поверхности разрезанного лимфатического узла. По нашим данным, достоверность срочного цитологического исследования по выявлению метастатического поражения лимфатических узлов составляет 97-99%.
Надо отметить, что к срочному морфологическому исследованию могут быть противопоказания. Срочное интраоперационное морфологическое исследование не рекомендуется выполнять при подозрении на внутриэпителиальный рак с ограниченным очагом поражения из-за того, что не останется материала для планового гистологического исследования. Цитологические критерии внутриэпителиального рака только разрабатываются, и цитолог может дать заключение о раке, не указывая, что это Carcinoma in situ. При внутрипротоковых папилломах небольшого размера срочное гистологическое исследование лучше не выполнять, а цитологическое исследование достоверно поможет установить характер процесса.
При срочной морфологической диагностике существенно помогает макроскопическое исследование операционного материала. Опытный морфолог при визуальном исследовании уже может поставить диагноз, но для подтверждения диагноза необходимо микроскопическое исследование. Например, опухолевый узел классической звездчатой формы может быть при трех совершенно разных процессах: при раке, склерозирующем аденозе с центром Семба и липогранулеме. И только микроскопическое исследование позволяет правильно поставить диагноз.
Цитологический метод позволяет в динамике, не травмируя пациента, изучать лечебный патоморфоз при химиолучевой и фотодинамической терапии.
XX столетие названо в медицинских кругах веком цитопатологии. Оценивая возможности цитологического метода, можно сказать, что есть еще возможности его развития в комбинации с другими дисциплинами и методами.
Иммуноцитохимическое исследование нередко является решающим в дифференциальной диагностике новообразований, когда при рутинном исследовании возникают непреодолимые трудности для установления гистогенеза отдельных опухолей, определения источника метастазирования, трактовки первично-множественных поражений.
За последние годы достигнут огромный прогресс в клиническом использовании различных биологических маркеров. В отличие от сывороточных маркеров, клеточные маркеры определяются непосредственно в опухолевых клетках ИЦХ исследованием, в основе которого лежит реакция антиген-антитело. В их числе онкогены, рецепторы эстрогенов и прогестерона, молекулы, опосредующие апоптоз, рецепторы факторов роста и т. д. Все эти показатели позволяют более детально изучить молекулярно-биологические особенности опухолевых клеток, ассоциированные со степенью дифференцировки, способностью к инвазии и метастазированию, чувствительностью к химиотерапии, и, следовательно, с особенностями течения и прогнозом заболевания в каждом конкретном случае.
Специфических маркеров дифференциальной диагностики злокачественных и доброкачественных опухолевых процессов не существует, но на сегодняшний день активно ведутся научные изыскания в решении этой проблемы. Так, равномерное окрашивание герминативных центров лимфоидных фолликулов с использованием антител bcl-2 указывает на фолликулярную лимфосаркому, в то время как негативная реакция свидетельствует о доброкачественном гиперпластическом процессе; реакция с антителами HBME-1 при ИЦХ исследовании опухолей щитовидной железы часто положительная в злокачественных новообразованиях и практически отсутствует при доброкачественных, в дифференциальной диагностике широко применяют галектин-3, экспрессирующийся карциномами щитовидной железы из А-клеток (папиллярный, фолликулярный) с отсутствием экспрессии в фолликулярных аденомах, зобах и нормальной ткани щитовидной железы.
Для установления гистогенеза и дифференциальной диагностики опухолей разработаны и постоянно совершенствуются, схемы C.R.Taylor и R.J. Cote (1994 г.). Разнообразие моноклональных антител, используемых в иммуноцитохимических исследованиях тонкоигольных пунктатов, в каждом конкретном случае позволяет ответить на вопрос, имеет ли данная опухоль эпителиальное происхождение или является саркомой, меланомой, лимфомой. Иммуноцитохимия широко применяется для иммунофенотипирования злокачественных лимфом, без чего, по современным канонам, невозможно начать лечение.
Иммуноцитохимическое исследование помогает в определении источника метастазирования при невыявленном первичном очаге. К сожалению, органоспецифических маркеров не так уж и много. К их числу могут быть отнесены специфический антиген предстательной железы (ПСA), позволяющий идентифицировать метастазы рака простаты более чем в 95% случаев; тиреоглобулин, экспрессирующийся в 92–98% фолликулярного и папиллярного рака щитовидной железы, и кальцитонин, экпрессирующийся в 80% медуллярных раков щитовидной железы В некоторых случаях рак щитовидной железы может экспрессировать и кальцитонин, и тиреоглобулин, что только с помощью иммуноферментной диагностики позволяет диагностировать диморфные А-С-клеточные раки.
Одним из первых показателей, вошедших в практику лечения больных раком молочной железы (РМЖ), и относящихся к категории клеточных маркеров, были рецепторы стероидных гормонов. Рецепторы стероидных гормонов – это белки, специфически и избирательно связывающие соответствующие стероиды после их проникновения в клетку.
По данным ВОЗ (2003 г.), экспрессия рецепторов эстрогенов (РЭ+) и прогестерона (РП+) в инвазивных протоковых раках составляет 70-80%; инвазивный дольковый рак в 70-95% экспрессирует РЭ, в 60-70% -РП, 100% экспрессия РЭ отмечена в инвазивном криброзном, муцинозных опухолях молочной железы. Эдокринная терапия наиболее эффективна у больных с первичными опухолями с высоким уровнем рецепторов стероидов. При метастатических поражениях степень реакции на эндокринную терапию также зависит от наличия РЭ и РП в опухоли: её эффективность составляет около 10–15% при гормонотрицательных опухолях, 27% при опухоли с РЭ+ и РП-, 46% при статусе РЭ- и РП+ и 75% при опухолях, содержащих РЭ+ и РП+. Рецепторположительные опухоли молочной железы имеют более высокую дифференцировку и более благоприятный прогноз.
Необходимо отметить, что рецепторы гормонов в доброкачественных образованиях молочной железы еще мало изучены. Отмечено повышение числа РЭ+ клеток в нормальной ткани молочной железы с увеличением возраста, а также при склерозирующем аденозе, папилломах, фиброаденомах и листовидных опухолях. Коэкспрессия РЭ+/Ki-67+ с разной степенью выраженности и соотношения большей частью выявлялась в патологии, связанной с риском развития РМЖ.
Рецепторы эстрогенов экспрессируются в клетках рака эндометрия, яичников, шейки матки, щитовидной железы, кишечника, нейроэндокринных опухолей, в том числе карциноидов.
Иммуноцитохимическое исследование позволяет на дооперационном этапе установить важнейшие факторы прогноза опухолевого процесса и скоррегировать схемы лечения. Пролиферативная активность многих новообразований оценивается с помощью антител Ki-67 в злокачественных лимфомах, опухолях молочной, предстательной, поджелудочной железы, легких, гипофиза, толстой кишки. Обнаружена связь между значениями индекса пролиферации и степенью гистологической дифференцировки опухоли и клиническим прогнозом при раке эндометрия, яичников, легкого, молочной железы, мочевого пузыря, лимфомах, опухолях нервной системы.
Гиперэкспрессия онкопротеина C-erbB-2(HER2/neu), являющегося рецептором эпидермального фактора роста 2-го типа, придающего клеткам свойство неограниченного деления, служит фактором риска рецидива заболевания для ряда опухолей: рака молочной железы, толстой кишки, лёгкого и др. Экспрессия онкобелка C-erbB-2 при ИГХ исследовании обнаруживается в 15–40% РМЖ. Выявление онкопротеина C-erbB-2, по мнению некоторых авторов, ассоциируется с высокой степенью злокачественности опухоли, отсутствием РЭ и РП, высокой митотической активностью, устойчивостью к химиотерапии и требует назначение герцептина.
Наличие метастазов в лимфатических узлах при опухолевом поражении является главным дискриминирующим прогностическим признаком. С помощью иммуноцитохимического исследования можно выявить единичные циркулирующие кератин-положительные клетки РМЖ в костном мозге и периферической крови. Применение ИЦХ исследования повышает выявляемость микрометастазов в лимфатических узлах на 3,2–24%.
Иммуноцитохимические реакции оцениваются как качественно при уточнении гистогенеза опухоли, наличии метастаза в лимфатическом узле или другом органе, иммунофенотипировании лимфом, так и количественно – при оценке пролиферативной активности, экспрессии рецепторов гормонов в опухоли, онкопротеина С-erbB-2 и т.д. Иммуноцитохимическая реакция может быть ядерной, цитоплазменной и мембранной. Ядерная реакция проявляется интенсивным окрашиванием ядра и бывает при определении РЭ и РП, Ki–67, PCNA, p53 и т.д. Цитоплазменная реакция характеризуется диффузным окрашиванием цитоплазмы или отложением гранул в виде грубых пятен и зерен. Цитоплазменное окрашивание дают хромогранин, синаптофизин, белок S-100, виментин, десмин, тиреоглобулин, кальцитонин, цитокератины, bcl-2 и т.д. Оценка этой реакции требует большой осторожности и контроля, так как фоновое окрашивание цитоплазмы клеток может быть принято за истинную реакцию. Мембранное окрашивание наблюдается при проведении реакции с онкопротеином C-erbB-2 и ЭМА (эпителиальным мембранным антигеном). Окрашивание в таких случаях только цитоплазмы не должно учитываться как экспрессия антигена. Маркер крупноклеточной анаплазированной лимфомы CD-30 может экспрессироваться как в цитоплазме, так и на мембране клетки.
Для количественной оценки экспрессии маркера Мс. Carthy и соавторы разработали систему подсчета Histo score (H.S.). Система подсчета включает интенсивность иммуноцитохимической окраски, оцениваемую по 4-балльной шкале, и долю окрашенных клеток и представляет собой сумму произведений процентов, отражающих долю клеток с различной интенсивностью окраски на балл, соответствующий интенсивности реакции. Интенсивность окраски в баллах: 0 – нет окрашивания, 1 – слабое окрашивание, 2 – умеренное окрашивание, 3 – сильное, 4 – очень сильное окрашивание. Формула подсчета:
Histochemical score = ∑ P(i)×i (гистосчет),
где i – интенсивность окрашивания, выраженная в баллах от 0 – 4,
Р(i) – процент клеток, окрашенных с разной интенсивностью.
Максимальное количество Histo score соответственно должно быть 400. Подсчет проводится в трех когортах по 100 опухолевых клеток в различных полях зрения (объектив х 40).
В практической работе допустимо использование полуколичественной оценки. Реакция считается отрицательной при полном отсутствии или экспрессии антигена менее 5%–10% опухолевых клеток, слабоположительной – от 5%–10% до 24% клеток, умеренно положительной – в 25%–75%, выраженной – более чем в 75% клеток. При оценке иммуноферментной реакции принимают во внимание интенсивность и полноту окрашивания цитолеммы клеток в центре опухолевого очага. Так, яркая, мембранная, беспрерывная по контуру клетки реакция обозначает выраженную экспрессию белка С-erbB-2 (+++), что в 95% случаев подтверждается амплификацией гена С-erbB-2, выявляемой с помощью FISH (флуоресцентной гибридизацией in situ).
Сопоставляя данные иммуноцитохимических исследований различных опухолей с целью уточнения гистогенетической принадлежности и результатов послеоперационных морфологических заключений, получены следующие результаты: 89% совпадений при анализе опухолей щитовидной железы, 83% при уточнении гистогенеза первичной опухоли и метастазах в лимфатических узлах, 89% – при опухолях мягких тканей и кожи и 100% – при исследовании биологических жидкостей. При определении гормонального статуса РМЖ процент совпадения ИЦХ и ИГХ исследований составляет 88,3%, при исследовании пролиферативной активности – 83%, при определении онкопротеина C-erbB-2 – 93,2%.
При сравнении возможностей ИЦХ исследования при выполнении пункционной биопсии и ИГХ исследования при трепанобиопсии преимущества ИЦХ, на наш взгляд, несомненны. Пункционная биопсия – более простая процедура, не сопровождается такими осложнениями, как воспаление, кровотечение, и позволяет получить полноценный клеточный материал. При неудачной пункции и попадании в некроз, строму опухоли, окружающие ткани можно практически безболезненно повторить процедуру. Кроме того, отсутствует потеря и маскировка антигенов при проводке и депарафинизации материала с использованием агрессивных химических реагентов.
Использование иммуноцитохимического исследования позволяет расширить возможности морфологических методов и на дооперационном этапе уточнить гистогенез, диагностировать первично-множественные поражения, степень распространения и оценить некоторые показатели прогноза и чувствительность опухоли к химиогормонотерапии.
На современном этапе развития в цитологии используются методы молекулярной и генной диагностики: гибридизация in situ, Southern Blotting, Nothern Blooting, Western Blotting, DNK Microarray и т.д) В научной и практической работе цитологи применяют проточную цитофотометрию.
Одним из путей совершенствования цитологического метода исследования является применение морфометрии, что позволяет получать объективные количественные параметры. Например, при обработке на компьютере выделены наиболее информативные морфометрические признаки, относящиеся к параметрам ядра с использованием основных диагностических морфометрических признаков: площадь, периметр, оптической плотности, коэффициент поляризации ядер, числа ядрышек, их площади и периметра. Разработаны объективные морфометрические признаки различных степеней дисплазии при дисгормонально-гиперпластических процессах молочной железы, шейки матки, что уменьшило долю субъективизма в определении различных степеней дисплазии.
Развиваются новые методы микроскопии: фазово-контрастная, флюоресцентная, конфокальная и т.д. Создание компьютерных систем обучения, развитие метода телеконсультации также предъявляют новые требования и, несомненно, будут способствовать развитию и совершенствованию цитологического метода диагностики.
Волченко Надежда Николаевна
д.м.н., профессор, руководитель отделения
онкоцитологии МНИОИ им.П.А.Герцена