Кафедра общей хирургии ФГБОУ ВО «Рязанский государственный медицинский университет им. акад. И.П. Павлова» Минздрава РФ, Рязань, Россия
Андреева Ю.Ю.
ГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России
- SPIN РИНЦ:
6504-2551 - ORCID:
0000-0003-4749-6608
Новикова Е.Г.
Московский научно-исследовательский онкологический институт им. П.А. Герцена
Шевчук А.С.
ФГБУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена» Минздрава России
Завалишина Л.Э.
ФГБУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена» Минздравсоцразвития России
Франк Г.А.
Московский научно-исследовательский онкологический институт им. П.А. Герцена Росмедтехнологий, Москва
Клинико-морфологические факторы прогноза при пограничных опухолях яичников
Авторы:
Виноградов И.И., Андреева Ю.Ю., Новикова Е.Г., Шевчук А.С., Завалишина Л.Э., Франк Г.А.
Журнал:
Онкология. Журнал им. П.А. Герцена. 2014;3(3): 22‑25
Как цитировать:
Виноградов И.И., Андреева Ю.Ю., Новикова Е.Г., Шевчук А.С., Завалишина Л.Э., Франк Г.А.
Клинико-морфологические факторы прогноза при пограничных опухолях яичников. Онкология. Журнал им. П.А. Герцена.
2014;3(3):22‑25.
Vinogradov II, Andreeva YuYu, Novikova EG, Shevchuk AS, Zavalishina LÉ, Frank GA. Clinical and morphological predictors in borderline ovarian tumors. P.A. Herzen Journal of Oncology. 2014;3(3):22‑25. (In Russ.).

?>
История изучения пограничных опухолей яичников (ПОЯ) насчитывает уже около 100 лет, однако многие вопросы до настоящего времени не находят своего ответа. Впервые ПОЯ были описаны в 1929 г. гинекологом из США Говардом Тэйлором [1]. Он назвал эти опухоли «полузлокачественными», подчеркивая тем самым особенности их клинического течения, существенно отличающегося как от классического рака яичников, так и от доброкачественных образований.
В структуре неоплазий яичников доля пограничных опухолей составляет около 10—15%, показатели заболеваемости варьируют в различных странах от 1,8 до 4,8‰. ПОЯ развиваются из поверхностного эпителия яичников и кист-включений. С морфологических позиций эти новообразования характеризуются умеренно выраженными пролиферативной и митотической активностью, стратификацией эпителия, ядерной и клеточной атипией. Принципиальным отличием пограничных опухолей от рака яичников является отсутствие стромальной инвазии и характерного для аденокарцином инфильтративного деструктивного роста. Именно эти морфологические характеристики ПОЯ предопределяют их особенное положение в спектре биологической агрессивности опухолей яичников [2, 3].
Соответственно различным видам эпителия, представленного в женской половой системе, выделяют следующие гистологические типы пограничных опухолей: серозные, муцинозные, эндометриоидные, опухоли Бреннера, светлоклеточные и смешанные. Наиболее часто встречаются серозная (50—55%) и муцинозная формы (40—45%), на долю остальных типов ПОЯ приходится 4—5% наблюдений [4, 5]. Характерной особенностью серозных ПОЯ является высокая частота двустороннего поражения яичников, варьирующая от 28 до 66%. Билатеральные муцинозные опухоли наблюдаются не более чем в 10% наблюдений [6, 7].
Экстраовариальные очаги пограничных опухолей на брюшине получили название «имплантов», которые классифицируют на неинвазивные и инвазивные. Чаще выявляют неинвазивные импланты (75%), характеризующиеся торпидным доброкачественным течением. К особенностям этих имплантов следует отнести возможность злокачественной трансформации, способность формировать обширные очаги фиброза в брюшной полости в результате десмоплазии, нередко приводящие к развитию кишечной непроходимости и, как это ни парадоксально, возможность спонтанной регрессии после удаления первичного очага. Инвазивные импланты обнаруживаются в 25% наблюдений и только при серозном варианте ПОЯ. Клинические и морфологические особенности инвазивных имплантов аналогичны таковым при метастазах рака яичников. Учитывая эти обстоятельства, многие патоморфологи предлагают рассматривать серозные пограничные опухоли с инвазивными имплантами как высокодифференцированные серозные аденокарциномы. В целом, перитонеальная диссеминация на момент установки диагноза определяется у 35—38% пациенток с серозными ПОЯ и у 10—15% с муцинозными [8].
Благодаря длительному торпидному течению, ПОЯ в большинстве случаев (60—85%) диагностируют в I стадии процесса. Частота выявления III стадии заболевания составляет 10—35%, при раке яичников — 60—70%. Особенности биологии ПОЯ и преобладание начальных форм заболевания предопределяют хороший прогноз для больных. Если в течение последних десятилетий в результате применения новейших схем лечения удалось приблизить показатели общей 5-летней выживаемости пациенток с раком яичников к 50%, то выживаемость больных с пограничными опухолями остается достаточно стабильной и превышает 90% [7].
Поскольку удельный вес женщин репродуктивного возраста в структуре заболеваемости ПОЯ достаточно высок (более 30%), вопросы сохранения фертильности занимают центральное место в лечении этой категории больных. Благоприятный прогноз, низкая частота рецидивирования и впечатляющие показатели выживаемости, безусловно, создают предпосылки для более широкого применения органосохраняющих и репродуктивных технологий при ПОЯ, чем при раке яичников [9].
Несмотря на высокие показатели выживаемости, поиск новых и оценка существующих прогностических факторов при ПОЯ имеют существенное значение, особенно при планировании органосохраняющего лечения у молодых пациенток.
Как и при раке яичников, при ПОЯ стадия опухолевого процесса является наиболее важным прогностическим фактором. Известно, что у больных с начальными формами болезни рецидивы развиваются в среднем у 5%, при распространенных стадиях — в 25% случаев, а 5-летняя выживаемость при I—II и III—IV стадиях составляет 98 и 82—90% соответственно [7].
Наличие перитонеальных имплантов, особенно инвазивных, является вторым по значимости фактором прогноза. По своему строению и клиническому течению инвазивные импланты очень схожи с метастазами рака яичников и могут служить маркером злокачественной трансформации пограничной опухоли. По данным P. Morice [10], рецидивы при инвазивных имплантах наблюдаются в 2 (45% против 24%) раза чаще, чем при неинвазивных. Десятилетняя выживаемость пациенток с неинвазивными имплантами пограничных опухолей составляет 90—95%, с инвазивными — 60—70%.
В настоящее время в литературе активно обсуждается прогностическая значимость некоторых морфологических особенностей пограничных опухолей. Так, в серозных пограничных опухолях могут быть обнаружены очаги хрупкой микропапиллярной архитектуры (рис. 1, 2,). Результаты проведенных исследований показали, что рост по поверхности яичника и наличие имплантов больше характерны для микрососочковых серозных пограничных опухолей, чем для типичных [11, 12]. Помимо этого, имеются данные об увеличении частоты рецидивов (до 36%) при микрососочковой структуре пограничной опухоли, выявляемой у 12—18% больных [7].
Много споров ведется вокруг присутствия в ПОЯ кальцификатов, именуемых псаммомными тельцами. Предпринятые попытки определить их возможное прогностическое значение пока не принесли конкретных результатов. Ряд авторов [13] предполагают, что наличие псаммомных телец в высокодифференцированных аденокарциномах обусловлено хорошим прогнозом, объясняя этот факт тем, что их образование связано с повышенным апоптозом в опухоли. Другие [14] считают, что псаммомные тельца не имеют прогностической значимости.
Некоторые авторы [6, 15] связывают высокую частоту рецидивов с наличием микроинвазии, имеющей место у 10—13% больных, и рассматривают фокусы микроинвазии в качестве мелких очагов инвазивного серозного рака, развивающегося на фоне пограничной опухоли. Считается, что это обстоятельство должно служить поводом к изменению диагноза в пользу рака яичников с применением более агрессивной лечебной тактики.
Определенное прогностическое значение при ПОЯ может иметь ДНК-плоидность опухоли. Так, в работах J. Kaern (1993, 2009) было показано, что при анеуплоидии риск умереть от пограничной опухоли в 19 раз выше, чем при диплоидных образованиях [8].
Убедительных данных о том, что гистологический тип опухоли или вовлечение в опухолевый процесс лимфатических узлов является независимым прогностическим фактором, получено не было. Так, проведенный метаанализ 97 исследований, включавший более 4000 больных с ПОЯ, показал, что 6-летняя выживаемость больных с поражением лимфатических узлов составила 98% [16].
Цель настоящего ретроспективного исследования — оценка влияния на развитие рецидива таких морфологических факторов, как гистологический тип, наличие имплантов, псаммомных телец и микрососочковых структур в пограничной опухоли яичников.
Материал и методы
Материалом для исследования служили гистологические препараты пациенток, проходивших лечение или консультированных в МНИОИ им. П.А. Герцена с диагнозом: пограничная опухоль яичников. Исследованы образцы опухолей 101 женщины в возрасте от 18 до 63 лет (средний возраст 32,14 года).
Пациентки были разделены на две группы: 1-я — больные без рецидивов ПОЯ (83 человека — 82,2%); 2-я — больные с рецидивами ПОЯ (18 человек — 17,8%).
Материал фиксировали в 10% забуференном формалине в течение 24 ч, обрабатывали по стандартной методике с использованием ксилола и заливали в парафин. Из блоков изготавливали срезы толщиной 4 мкм, окрашивали гематоксилином и эозином.
Препараты изучали при помощи светового микроскопа Axioskop «OPTON» со стандартным набором оптики. Анализ результатов проводили при помощи пакета программ Statistica 6.0, используя метод процентилей описательной статистики, U-тест Манна—Уитни. Уровень значимости (р) принимали равным 0,05.
Результаты и обсуждение
Нами было выявлено, что подавляющее большинство (78,2%) исследованных ПОЯ были представлены серозным типом. Муцинозные опухоли имели место в 13,8% случаев, смешанные — в 5%, эндометриоидные — в 3%. Однако при изучении распределения типов ПОЯ в исследуемых группах статистически значимых различий обнаружено не было (р>0,05).
Неинвазивные импланты в группе больных без рецидивов отмечены в 15,7% случаев, а в группе с рецидивами — в 77,8%. При этом были выявлены статистически значимые различия по частоте встречаемости имплантов в исследуемых группах (р<0,05). Случаи с наличием инвазивных имплантов в исследование не включали, так как, по данным некоторых авторов [6, 17], при тщательном исследовании первичного очага обнаруживаются структуры инвазивной высокодифференцированной аденокарциномы.
Было установлено увеличение частоты обнаружения имплантов у пациенток с наличием рецидивов ПОЯ. Возможно, это обусловлено тем, что при наличии перитонеальных имплантов в брюшной полости могут оставаться не выявленные при ревизии микроскопические очаги ПОЯ, которые и являются субстратом развития рецидива.
Известно, что импланты встречаются гораздо чаще при серозном типе ПОЯ, что предопределяет более благоприятное течение других пограничных опухолей и сниженный риск рецидивов. Однако в нашем исследовании не выявлено значимых различий при развитии рецидива в зависимости от гистологического типа опухоли.
Псаммомные тельца обнаружены у 30 (29,7%) из 101 больной. У пациенток с рецидивами они были выявлены в 50% случаев, а у пациенток без рецидивов — в 25,3%. При этом зафиксированы статистически значимые различия между исследуемыми группами (р<0,05).
Микрососочковая архитектура в опухоли отмечена в 8 (7,9%) случаях. При этом все наблюдения были представлены рецидивными ПОЯ. В пограничных опухолях без рецидива микрососочковые структуры не выявляли. Статистические различия между исследуемыми группами оказались значимыми (р<0,05).
Таким образом, хрупкая микрососочковая архитектура чаще ассоциирована с наличием перитонеальных имплантов и с развитием рецидивов ПОЯ, что подтверждается результатами проведенного исследования.
Наличие псаммомных телец в опухолях яичника связывают с усиленным апоптозом в опухолевых клетках. Имеются данные о повышенном содержании коллагена IV типа в псаммомных тельцах, что может послужить причиной активизации металлопротеиназ, задействованных в процессах миграции, и инвазии опухолевых клеток. В результате проведенного исследования мы выявили, что псаммомные тельца чаще встречаются в рецидивных опухолях (50% против 25,3%).
Существенно изменившиеся за последние 20 лет представления о природе ПОЯ, их течении и прогнозе позволили в значительной степени расширить показания к применению органосохраняющих хирургических технологий при этих заболеваниях. Эффективность стандартных органосохраняющих операций при начальных стадиях опухолевого процесса высока как с онкологических позиций, так и в аспекте сохранения репродуктивной функции и качества жизни. Показатели 5-летней выживаемости больных приближаются к 100%. Однако рецидивы после органосохраняющего лечения ПОЯ наблюдаются в 2—4 раза чаще, чем после радикальных операций (10—20% против 5%), при этом наиболее характерная локализация рецидива (75%) — сохраненный яичник. Большинство рецидивов имеют неинвазивный характер, риск злокачественной трансформации опухоли при возникновении рецидива составляет 3—20%, и лечение в этих ситуациях должно соответствовать таковому при раке яичников [8, 9].
Проблема консервативного лечения больных с ПОЯ является одной из наиболее актуальных и дискутируемых в вопросах определения границ и возможностей реализации органосохраняющих технологий и обеспечения их онкологической безопасности для пациенток. Планирование органосохраняющего лечения у больных с ПОЯ в каждом конкретном случае требует от клиницистов и патоморфологов совместной и тщательной оценки прогностических факторов. Особое значение последнее обстоятельство приобретает при выполнении ультраконсервативных операций у пациенток с билатеральным поражением яичников, суть которых состоит в сохранении неизмененной части яичника, пораженного пограничной опухолью, путем выполнения его резекции или цистэктомии. В различных публикациях частота рецидивов после цистэктомий варьирует от 12 до 64% (в среднем 30—35%), что существенно превышает аналогичные показатели после типичных органосохраняющих операций, заключающихся в выполнении аднексэктомии с проведением хирургического стадирования. В качестве основных причин продолженного роста рассматриваются мультицентричность опухолевых зачатков, разрыв капсулы кистозных образований с имплантацией опухолевых клеток на поверхности сохраняемого яичника и наличие элементов опухоли в крае резекции [6]. Результаты проведенного нами исследования свидетельствуют, что микрососочковая структура опухоли и обилие псаммомных телец при морфологическом исследовании могут быть дополнительными факторами риска развития рецидива и должны быть учтены при принятии решения о выполнении органосохраняющей операции, особенно ультраконсервативной.
Мировой опыт консервативных операций при ПОЯ с наличием перитонеальных имплантов в целом невелик, количество проведенных исследований и общее число наблюдений малы. Однако у данных больных авторы отмечают увеличение частоты рецидивов, в том числе в случаях полного удаления имплантов, по сравнению с органосохраняющими операциями у пациенток при I стадии заболевания [18]. Эти данные согласуются с полученными нами результатами в отношении прогностической ценности имплантов и развития рецидива болезни. Тем не менее характер имплантов (инвазивные или неинвазивные) в этих случаях имеет ведущее значение.
В настоящее время проводятся многочисленные исследования, направленные на изучение молекулярно-биологических факторов, влияющих на прогноз ПОЯ. Большое внимание уделяется изучению мутации важных регуляторных генов B-Raf, K-ras, р53, PTEN и исследованию микросателлитной нестабильности. Исследуется экспрессия белка р53, так как сейчас доказана широкая вовлеченность р53 в развитие разных типов опухолей, поскольку выполнение этим белком ряда функций ведет к предотвращению и/или ингибированию опухолевого роста. В то же время прогностическая роль р53 для различных опухолей неравнозначна [19]. Так же изучается прогностическая значимость экспрессии белков р21 и р27 (ингибиторы циклинзависимых киназ), являющихся важнейшими медиаторами ингибирующего эффекта р53 на клеточный цикл. В качестве прогностических критериев проводится исследование экспрессии белков, участвующих в регуляции пролиферации (Ki-67, циклины и др.) и апоптоза (bcl-2, bcl-x, bak, bax, сурвивин). Важными прогностическими факторами для ПОЯ, возможно, могут быть некоторые металлопротеиназы (протеазы, участвующие в ремоделировании внеклеточного матрикса и определяющие инвазивный и метастатический потенциал неопластических клеток) и их тканевые ингибиторы. Необходимо изучение мутаций гена β-катенина (CTNNB1), играющего ключевую роль в особом Wnt-пути сигнальной трансдукции, а также ядерной экспрессии белка β-катенина, связанного с биологической агрессивностью различных опухолей [20]. Таким образом, требуется дальнейшее исследование молекулярно-биологических характеристик пограничных опухолей на большом количестве материала с тщательным сопоставлением полученных результатов и клинических данных. Возможно, полученные результаты позволят выделить совокупность факторов, определяющих биологическую агрессивность этих опухолей, и окажут существенную помощь клиницистам в принятии решений.
Участие авторов:
Концепция и дизайн исследования: Ю.Ю.А., Л.Э.З.
Сбор и обработка материала: А.С.Ш.
Написание текста: И.И.В., А.С.Ш.
Статистическая обработка материала: И.И.В.
Редактирование: Е.Г.Н., Г. А.Ф.
Новообразования яичников — достаточно распространенное явление среди женщин. Они бывают как доброкачественные, так и злокачественные, но есть и отдельная группа – пограничные, которые имеют признаки, не позволяющие их отнести ни в одну из выше перечисленных групп.
Диагностируют пограничные опухоли у женщин в возрасте от тридцати до сорока пяти лет, и именно они выступают причиной, из-за которой пациентки не могут забеременеть.
Высокая вероятность рецидива в случае не радикального лечения не дает отнести их к доброкачественным новообразованиям, но и к злокачественным отнести их не представляет возможным. Более чем в шестидесяти процентов случаев диагностируют пограничные опухоли яичников на начальной стадии, а это один из залогов благоприятного прогноза.
Проблема пограничной опухоли яичника состоит как раз в том, что женщины хотят сберечь фертильную функцию, а органосохраняющие методы лечения несут высокую вероятность рецидивирования.
Специалисты Юсуповской больницы разрабатывают план лечения для каждой пациентки индивидуально и максимально учитывают ее потребности. Врачи следят за новинками в медицине, внедряют новые методы и технологии. За годы работы в Юсуповской больнице диагностика и лечение пограничных опухолей яичников проводилась тысячам женщин, и каждая из них выбрала оптимальный для себя метод.
Лучшая больница Москвы с удобным расположением, ведущими специалистами разных отраслей медицины, современным оборудованием, компетентным персоналом и комфортабельными палатами оказывает помощь населению в круглосуточном режиме. Диагностику можно пройти амбулаторно, без очередей и заминок. Лечение подбирается с учетом особенностей каждой пациентки, а также разрабатывается курс реабилитации и в благоприятных условиях восстановление происходит в максимально короткие сроки. Записаться на консультацию необходимо в онлайн режиме и по телефону. Во время личного разговора с врачом можно получить ответы на вопросы о этиологии, патогенезе, диагностике, лечению и реабилитации данного заболевания, решить вопросы госпитализации и дальнейшей тактики.
В случае пограничных опухолей яичников очень важно в начальной стадии правильно расставить приоритеты и не допустить распространению заболевания. На сайте Юсуповской больницы большое количество информации, касающееся данной патологии, а также многих других. Сайт по праву считается одним из лучших информационных сайтов сети.
Причины пограничных опухолей яичников
Пограничные опухоли яичников по морфологическим, клиническим и прогностическим критериям занимают некое срединное положение между злокачественными и доброкачественными новообразованиями. Но, как и в их случае, достоверных причин их возникновения на данное время не установлено. Многочисленные проведенные исследования свидетельствуют о том, что значительно повышают вероятность возникновения пограничных опухолей яичников следующие факторы:
- Повышенная масса тела (индекс массы тела выше 25кг/м2);
- Стимулированная овуляция;
- Отягощенная наследственность;
- Иммунодефицитные состояния;
- Длительные гормональные нарушения;
- Врожденные аномалии развития органов мочеполовой системы, надпочечников, гипофиза и гипоталамуса;
- Канцерогенные вещества;
- Ультрафиолетовое и ионизирующее излучения;
- Прием эстрогенов;
- Отсутствие беременности и родов в анамнезе;
- Метаболические заболевания;
- Заболевания эндокринной системы, в частности сахарный диабет;
- Оральная контрацепция;
- Вредные привычки – алкоголь, курение, наркомания и т.д.
Не опровергается также и инфекционно-вирусная теория возникновения пограничных опухолей яичников.
Достоверным считается тот факт, что беременность, роды и кормление грудью значительно снижают риски возникновения пограничных опухолей яичников.
Классификация пограничных опухолей яичников
От злокачественных новообразований пограничные опухоли яичников отличаются тем, что для них нехарактерна стромальная деструктивная инвазия. Согласно цитологической классификации, пограничные опухоли яичников разделяют на наиболее распространённые – серозная и муцинозная, и более редкие – эндометриоидные, опухоль Бреннера, метанефроидные и смешанные формы.
Также их принято разделять на инвазивные и неинвазивные. Опухоли, которые имеют форму узла и располагаются на ножке, называют поверхностными, а кистовидные злокачественные новообразования – внутрияичниковыми.
Метастазы пограничных опухолей яичников могут располагаться как в толще, так и на поверхности малого и большого сальников.
Симптомы пограничных опухолей яичников
На ранних стадиях пограничные опухоли яичников не имеют не то что специфических признаков, а не дают клиники вообще. Очень часто их диагностируют случайно во время профилактических осмотров или проведения ультразвукового исследования.
Также заподозрить пограничную опухоль яичника может специалист в случае проблемы первичного бесплодия, ведь именно данная опухоль является причиной невозможности забеременеть. Если беременность все-таки наступает, пограничная опухоль яичника может выступить причиной невынашивания.
Хоть в начале заболевания клинических симптомов практически нет, но в дальнейшем могут возникнуть тянущие боли внизу живота и дискомфорт в пояснице, который вначале носит односторонний характер, но вскоре охватывает и вторую сторону. Эти симптомы неинтенсивные и редко становятся причиной обращения к специалисту.
Увеличение размера пограничной опухоли яичника к увеличению живота, что очень часто пациентки объясняют себе набором веса или беременностью.
В дальнейшем присоединяются симптомы, связанные с прогрессированием процесса:
- Плохой аппетит или его отсутствие;
- Диспепсические явления;
- Чрезмерная усталость, вялость, сонливость;
- Повышается температура тела до субфебрильных цифр;
- Снижается масса тела и т.д.
Диагностика пограничных опухолей яичников
Сбор жалоб и анамнеза дополняется гинекологическим осмотром, а также лабораторными и инструментальными методами исследования.
Лабораторные методы включают следующие анализы:
- общий анализ крови. Специфических признаков нет, но в нем есть признаки анемии разной степени тяжести, уменьшение количества лейкоцитов и увеличение скорости оседания эритроцитов;
- Исследование уровня эстрогенов, прогестерона и тестостерона в крови;
- Определение концентрации CA-125, ХГТ, РЭА, АФП;
- Цитологическое и гистологическое исследование биоптата;
- Определение группы крови, кровь на вирусные гепатиты и сифилис;
- Молекулярное исследование и т.д.
Из инструментальных методов могут быть использованы следующие:
- ультразвуковое исследование, которое дает обнаружить опухоль маленьких размеров, которую во время гинекологического исследования пропальпировать не удалось. Так же дает возможность получить информацию о локализацию новообразования, прорастание в близлежащие органы;
- компьютерная или магнитно-резонансная томография выполняется для исключения или подтверждения метастазов;
- пункционная биопсия с последующим микроскопическим исследованием биоптата;
- диагностическая лапароскопия, а при невозможности ее проведения — диагностическая лапаротомия.
Проведение данных физикальных, лабораторных и инструментальных методов позволит не только определить доброкачественное, пограничное или злокачественное новообразование, а и даст представление о локализации, стадии и распространенности, а также поможет определиться с дальнейшей тактикой ведения пациентки.
Лечение пограничных опухолей яичников
Поскольку основная масса пациенток – женщины репродуктивного возраста, вполне обоснованным их желанием является сохранение матки как органа и, хотя бы, части яичника, которая бы и продолжала функционировать.
Эффективным и оправданным методом лечения пограничных опухолей яичников является хирургический метод.
Щадящая операция подразумевающая одностороннее удаление яичника и брюшины с сохранением второго яичника и матки несет за собой определенный риск. Каждая женщина должна понимать, что пограничная опухоль яичника после такой операции может, а как показывает практика скорее всего и будет, рецидивировать.
Если пациентка все-таки настаивает на органосохраняющей операции, она должна понимать серьезность ситуации и наблюдаться у гинеколога, регулярно обследоваться.
Важно знать, что есть возможность сохранить яйцеклетки путем криоконсервации, таки образом сохраняется возможность выполнения репродуктивной функции даже после двухстороннего удаления яичников.
Женщинам в менопаузе наиболее правильным считается обширное оперативное вмешательство, которое подразумевает удаление матки с придатками, большим сальником с последующей множественной биопсией брюшины. Такой объем вмешательства оправдан значительным улучшением прогноза при пограничной опухоли яичника после операции.
Многочисленные исследования свидетельствуют в пользу неэффективности применения химиотерапевтических препаратов для профилактики рецидивов.
Важно понимать, что несвоевременное лечение, или вовсе отказ от него несет за собой тяжелые последствия в виде перехода в злокачественную форму, так называемая малигнизация, сдавление соседних органов и структур, нарушение репродукции, некроз, перфорация, пенетрация, кровотечение и др.
Юсуповская больница – это не просто рядовая больница Москвы. Она изначально создавалась, чтоб каждый пациент мог в комфортных условиях, в окружении тепла и заботы, получить все необходимые медицинские услуги.
Диагностика и лечение в Юсуповской больнице выполняются с использованием современной техники. Все оборудование высокоточное, качественное. Доктора, которые работают в Юсуповской больнице, обладают не только наивысшими профессиональными, но и прекрасными человеческими качествами, такими как сочувствие и поддержка.
Персонал Юсуповской больницы работает двадцать четыре часа в сутки, чтобы каждый пациент мог получить высокопрофессиональную помощь в любое время суток.
Пограничные опухоли яичников хоть и очень часто долгое время не приносят никакого дискомфорта пациенткам, но требуют обязательного лечения. Опыт наших специалистов, современные технологии и совместная работа врачей Юсуповской больницы помогают найти подход к каждой пациентке, выбрать наиболее эффективную тактику лечения, обезопасить женщину от рецидива и дают возможность вновь почувствовать себя здоровой.
Не стоит откладывать проблему, необходимо немедленно ее решить. Обсудить и объяснить то, что раньше казалось пациенту недостижимым – важная часть работы хорошего специалиста. Вылеченная на ранней стадии пограничная опухоль яичника, не несет за собой никаких последствий для здоровья женщины. Записаться на консультацию можно по телефону или в онлайн режиме в любое время дня и ночи. В Юсуповской больнице всегда рады помочь пациенту.
- Case Report
- Open Access
- Published: 02 December 2017
European Journal of Medical Research
volume 22, Article number: 52 (2017)
Cite this article
-
1728 Accesses
-
2 Citations
-
1 Altmetric
-
Metrics details
Abstract
Objectives
To report an extremely rare case of ovarian borderline mucinous cystic tumor accompanied by low-grade endometrial stromal sarcoma (LGESS) with myxoid change.
Case presentation
A 42-year-old woman complained of lower left abdominal fullness. Her serum carcinoembryonic antigen, cancer antigen (CA) 125, and CA19-9 levels were normal. Magnetic resonance imaging showed a 10-cm cystic mass with a 5-cm nodule in its wall, and a laparoscopy indicated a cystic mass at the left adnexa. Histology indicated a cystic lesion consisting of proliferative gastrointestinal-type epithelium; the mural nodule had a characteristic of striking myxoid change, preservation of arteriolar pattern, and a “tongue-like” infiltration.
Conclusions
The diagnosis of ovarian mucinous borderline tumor accompanied by LGESS with myxoid change was appropriate.
Background
Mucinous cystic tumors of the ovary, whether benign, borderline, or malignant, may be associated with mural nodules of various types, including sarcomas, sarcoma-like mural nodules, foci of anaplastic carcinoma, carcinosarcoma, mixed nodules, and leiomyomas [1, 2]. The subject of this report is a mural nodule with features of a low-grade endometrial stromal sarcoma (LGESS) with myxoid change arising in an ovarian mucinous borderline tumor. To our knowledge, there are no reports of mucinous ovarian tumors accompanied by LGESS with myxoid change.
Case report
A 42-year-old woman complained of lower left abdominal fullness. Her serum carcinoembryonic antigen (CEA), cancer antigen (CA) 125, and CA19-9 levels were within normal limits. Magnetic resonance imaging (MRI) showed a 10-cm cystic mass at the pelvic cavity with a 5-cm nodule in its wall. The laparoscopy showed a 10-cm cystic mass at the left adnexa. The right ovary and uterus were grossly normal. The patient underwent left salpingo-oophorectomy and adhesiolysis. The patient was symptom free 10 months after surgery.
On macroscopic examination, the cyst measured 10 cm in maximal diameter and had a thickness of 0.2–0.5 cm. This cystic tumor focally adhered to the peritoneum. The inner side was slightly uneven and attached with clot-like material in some area. The cyst had a solid mural nodule protruding from the wall into the lumen measuring up to 5 × 4 × 4 cm in size (Fig. 1a). The mass was found penetrating the surface of the cyst and invading to the tubal fimbria. The cut surface was fleshy and gray with the area of hemorrhage and necrosis (Fig. 1b).
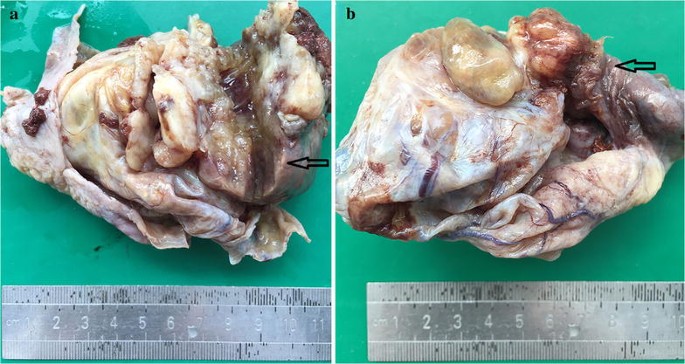
Gross specimen of ovarian cystic mass with mural nodule: a solid mural nodule protruding into the cyst indicated with black arrows (a). Penetrating the surface of the cyst and invading to the tubal fimbria indicated with black arrows (b)
Full size image
Microscopic observation showed that the cystic walls were lined mainly by single-layered tall mucinous columnar epithelium (Fig. 2a). Some epithelium of cystic walls showed slightly atypical proliferation with glandular budding and stratification. The cells exhibited mild to moderate nuclear enlargement and hyperchromasia. Acellular pools of mucin in the stroma were present in some areas (Fig. 2b). Old hemorrhage can be found in the cystic wall (Fig. 2c). In addition, there was a proliferation of large mononucleated cells and scattered multinucleated giant cells in an area of the cyst wall without forming a true nodule (Fig. 2d).
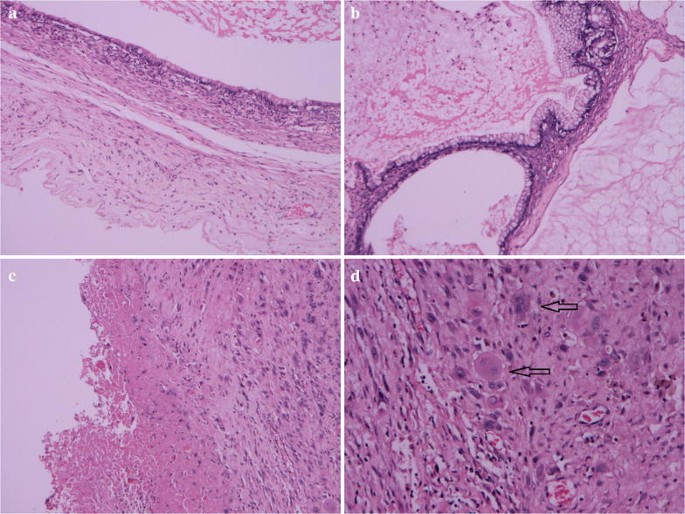
Histological findings (H&E). a Ovarian mucinous cystadenoma (×10). b Borderline malignant mucinous cystadenoma and acellular pools of mucin (×10). c Old hemorrhage in the cystic wall (×10). d Proliferation of large mononucleated cells and scattered multinucleated giant cells indicated with black arrows (×20)
Full size image
A 5-cm mural nodule was identified in the hysterectomy specimen protruding into the cystic cavity, extending onto the serosal, and involving the tubal fimbria. The mural nodule had a characteristic of striking myxoid change, preservation of arteriolar pattern, and a “tonguelike” infiltration (Fig. 3a). There was a sharp demarcation between epithelial and sarcomatous components (Fig. 3b). The mural nodule consisted of sheets of small cells with oval to spindle nuclei, whorling around spiral arteriole-like vessels (Fig. 3c). There was mild to moderate nuclear atypia and the mitosis was 4/10 HPF (Fig. 3d).
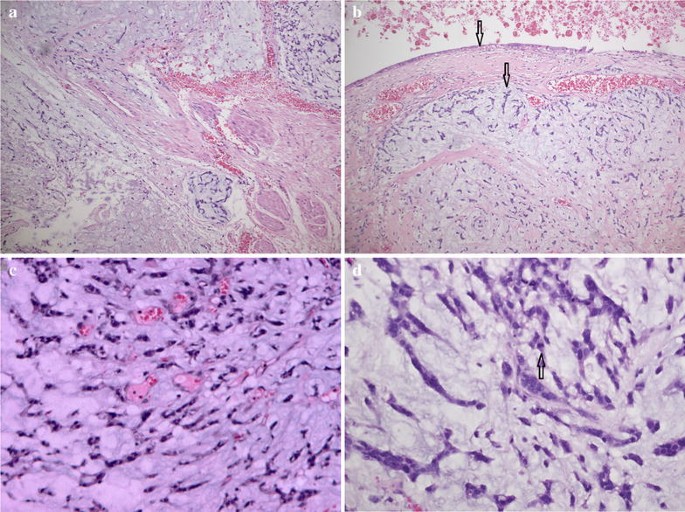
Histological findings (H&E). a Tongue-like processes extending into the edematous stroma (×10). b Sharp demarcation between epithelial and sarcomatous components indicated with black arrows (×10). c Preservation of arteriolar pattern (×20). d Nuclear atypia and the mitosis indicated with black arrows (×40)
Full size image
Immunohistochemical staining is shown in Fig. 4. The tumor cells of the mural nodule were strongly positive for cluster of differentiation 10 (CD10) and progesterone receptor (PR) and was negative for cytokeratin 7 (CK7), CK20, estrogen receptor (ER), a-inhibin, calretinin, caldesmon, and smooth muscle actin (SMA), which is a typical feature of endometrial stromal sarcoma. The tumor cells had a high index of Ki67. The epithelium of cystic wall was locally positive for CK7 and CK20.
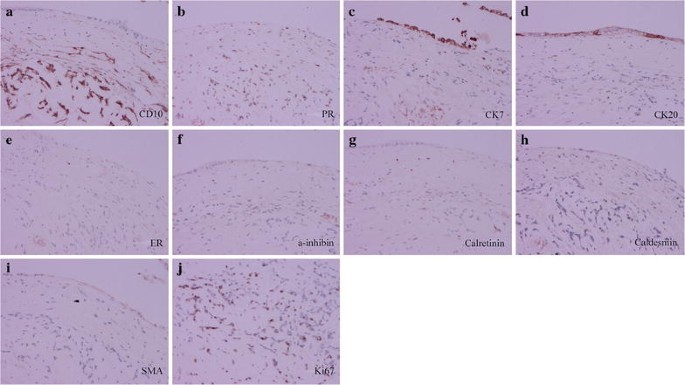
Immunochemical photograph of the ovarian tumors: CD10 (a, ×20), PR (b, ×20), CK7 (c, ×20), CK20 (d, ×20), ER (e, ×20), a-inhibin (f, ×20) calretinin (g, ×20), caldesmon (h, ×20), SMA (i, ×20), and Ki67 (j, ×20)
Full size image
Taking into account the above features, we made the diagnosis as ovarian mucinous borderline tumor accompanied by LGESS with myxoid change involving the tubal fimbria.
Discussion
In 1979, Prat and Scully [3] described in detail the clinicopathologic features of mural nodules emphasizing their broad morphologic spectrum and varying biological behavior. Since then, the scope of ovarian mural nodules has been classified into sarcoma-like, sarcoma, and anaplastic carcinoma [4]. The present case is quite interesting because of the presence of LGESS with myxoid change.
Mural nodules can develop in benign, borderline, or malignant ovarian tumors. These mural nodules are seen as solid lesions on the wall of the tumor or protrude into the cyst lumen. The diagnosis of mural nodules in the residual ovary is based on the size and characteristic gross and microscopic features [5, 6]. The benign and reactive mural nodules, also called sarcoma-like mural nodules (SLMNs), occur in younger females and are usually sharply demarcated small lesions. Malignant mural nodules are large solid tumors; as sarcoma and anaplastic carcinomas, they tend to occur in older females.
A review of the literature revealed only five mucinous ovarian tumors with sarcomas, with most of the mural nodules measured > 5 cm in the greatest dimension. In these five cases, they were fibrosarcomatous mural nodule in an ovarian mucinous cystadenoma [7], fibrosarcoma arising in a mucinous cystadenocarcinoma [8], fibrosarcoma associated with a mucinous cystadenoma [9], undifferentiated sarcoma in a mucinous cystadenocarcinoma [9], and rhabdomyosarcoma coexistent with ovarian mucinous cystadenocarcinoma [10], respectively. Ovarian mucinous borderline tumor accompanied by LGESS with myxoid change in our case was rather unique. The clinical and pathological features are summarized in Table 1.
Full size table
The differential diagnosis for extrauterine LGESS depends on the location of the tumor. In case of ovarian location, ovarian sex cord–stromal tumors should be excluded. The pathological and morphological characteristics and immunohistochemical findings in the present case do not favor ovarian sex cord–stromal tumors. LGESS with myxoid change can be confused with myxoid smooth muscle lesions, but the “tonguelike” infiltration and small arterioles, along with the CD10 immunostaining and muscle marker negativity, will usually resolve the diagnosis.
Tumors with a combination of different histology are divided into two clinicopathologic groups, collision or composite tumors [11]. The collision tumor has more than two juxtaposed masses and each mass displays a different histology. In contrast, the intermingling of more than two different components in one tumor mass is designated as a composite tumor. The well-known example is a malignant mixed Müllerian tumor (MMMT). It was noted that there was a sharp demarcation between epithelial and sarcomatous components in this case.
In this case, there was a region of proliferation of large mononucleated cells just beneath the epithelium without forming a true nodule, which may help explain the occurrence of malignant mural nodules. We hypothesize the forming process of this sarcoma as follows. The submesothelial mesenchymal cells reacted to the intramural hemorrhage or the mucinous content of the cyst, which eventually became a hyperplastic nodule, probably corresponding to the earlier stage of the SLMNs. Then the proliferation of mesenchymal cells resulted in the sustained expansion of the lesion. The nodule enlarged gradually and became SLMNs. Some of the SLMNs could possibly evolve into a true sarcoma with the proliferation and differentiation of mesenchymal cells.
Conclusions
We have presented a rare case of sarcoma-like mural nodule. Based on the ample evidence of the previous reports, and the immunohistochemical analysis of our case, we believe that this is a collision tumor with two different elements and may be formed by SLMN malignant change. Nevertheless, further molecular and genetic evidence is needed to support such a conclusion.
Abbreviations
- LGESS:
-
low-grade endometrial stromal sarcoma
- CEA:
-
carcinoembryonic antigen
- CA125:
-
cancer antigen 125
- CA19-9:
-
cancer antigen 19-9
- MRI:
-
magnetic resonance imaging
- CD10:
-
cluster of differentiation 10
- PR:
-
progesterone receptor
- CK7:
-
cytokeratin 7
- CK20:
-
cytokeratin 20
- ER:
-
estrogen receptor
- SMA:
-
smooth muscle actin
- SLMN:
-
sarcoma-like mural nodules
- MMMT:
-
malignant mixed Müllerian tumor
References
-
Park TC, Lee HN, Shin OR, Lee KH. A case of a borderline mucinous tumor of the ovary with sarcoma-like mural nodules producing granulocyte colony-stimulating factor. Eur J Gynaecol Oncol. 2012;33:526–7.
CAS
PubMedGoogle Scholar
-
Bague S, Rodriguez IM, Prat J. Sarcoma-like mural nodules in mucinous cystic tumors of the ovary revisited: a clinicopathologic analysis of 10 additional cases. Am J Surg Pathol. 2002;26:1467–76.
Article
PubMedGoogle Scholar
-
Prat J, Scully RE. Ovarian mucinous tumors with sarcoma-like mural nodules: a report of seven cases. Cancer. 1979;44:1332–44.
Article
CAS
PubMedGoogle Scholar
-
Gungor T, Altinkaya SO, Akbay S, Bilge U, Mollamahmutoglu L. Malign mural nodules associated with serous ovarian tumor of borderline malignancy: a case report and literature review. Arch Gynecol Obstet. 2010;281:485–90.
Article
PubMedGoogle Scholar
-
Bague S, Rodriguez IM, Prat J. Sarcoma-like mural nodules in mucinous cystic tumors of the ovary revisited—a clinicopathologic analysis of 10 additional cases. Am J Surg Pathol. 2002;26(11):1467–76.
Article
PubMedGoogle Scholar
-
Chang JS, Chua CC, Lee CC. Borderline mucinous cystic ovarian tumor with mural nodules (carcinosarcoma). Ann Saudi Med. 2012;32(4):415–20.
Article
PubMedGoogle Scholar
-
De Nictolis M, Di Loreto C, Cinti S, Prat J. Fibrosarcomatous mural nodule in an ovarian mucinous cystadenoma: report of a case. Surg Pathol. 1990;3:309–15.
Google Scholar
-
Rahilly MA, Candlish W, Al-Nafussi A. Fibrosarcoma arising in an ovarian mucinous tumor: a case report. Int J Gynecol Cancer. 1994;4(3):211–4.
Article
PubMedGoogle Scholar
-
Prat J, Scully RE. Sarcomas in ovarian mucinous tumors: a report of two cases. Cancer. 1979;44:1327–31.
Article
CAS
PubMedGoogle Scholar
-
Tsujimura T, Kawano K. Rhabdomyosarcoma coexistent with ovarian mucinous cystadenocarcinoma: a case report. Int J Gynecol Pathol. 1992;11:58–62.
Article
CAS
PubMedGoogle Scholar
-
Lewin K. Carcinoid tumors and the mixed (composite) glandular-endocrine cell carcinomas. Am J Surg Pathol. 1987;11:71–86.
Article
PubMedGoogle Scholar
Download references
Authors’ contributions
All authors made substantial contributions to conception and design, or acquisition of data, or analysis and interpretation of data; WW and ZY were involved in drafting the manuscript and revising it critically for important intellectual content; ZF gave final approval to the version to be published. All authors read and approved the final manuscript.
Acknowledgements
Not applicable.
Competing interests
The authors declare that they have no competing interests.
Availability of data and materials
The datasets generated during and/or analyzed during the current study are available from the corresponding author on reasonable request.
Consent for publication
Written informed consent was obtained from the patient for publication of this case report and any accompanying images.
Ethics approval and consent to participate
This study was approved by the ethics committee of the Women’s Hospital, School of Medicine Zhejiang University.
Funding
This work was supported by the program for Zhejiang Provincial Natural Science Foundation, P. R. China (No. LY12H04011).
Publisher’s Note
Springer Nature remains neutral with regard to jurisdictional claims in published maps and institutional affiliations.
Author information
Authors and Affiliations
-
Department of Obstetrics and Gynecology, Women’s Hospital, School of Medicine, Zhejiang University, Hangzhou, Zhejiang, China
Wen Wang, Yalin Zhuang & Lili Huang
-
Department of Pathology, Women’s Hospital, School of Medicine, Zhejiang University, 1 Xueshi Road, Hangzhou, 310006, Zhejiang, People’s Republic of China
Feng Zhou
Authors
- Wen Wang
You can also search for this author in
PubMed Google Scholar - Yalin Zhuang
You can also search for this author in
PubMed Google Scholar - Feng Zhou
You can also search for this author in
PubMed Google Scholar - Lili Huang
You can also search for this author in
PubMed Google Scholar
Corresponding author
Correspondence to
Feng Zhou.
Rights and permissions
Open Access This article is distributed under the terms of the Creative Commons Attribution 4.0 International License (http://creativecommons.org/licenses/by/4.0/), which permits unrestricted use, distribution, and reproduction in any medium, provided you give appropriate credit to the original author(s) and the source, provide a link to the Creative Commons license, and indicate if changes were made. The Creative Commons Public Domain Dedication waiver (http://creativecommons.org/publicdomain/zero/1.0/) applies to the data made available in this article, unless otherwise stated.
Reprints and Permissions
About this article
Cite this article
Wang, W., Zhuang, Y., Zhou, F. et al. Ovarian mucinous borderline tumor accompanied by LGESS with myxoid change: a case report and literature review.
Eur J Med Res 22, 52 (2017). https://doi.org/10.1186/s40001-017-0295-4
Download citation
-
Received: 22 November 2016
-
Accepted: 22 November 2017
-
Published: 02 December 2017
-
DOI: https://doi.org/10.1186/s40001-017-0295-4
Keywords
- Mucinous borderline tumor
- Mural nodules
- LGESS
- Myxoid change
- Case Report
- Open Access
- Published: 02 December 2017
European Journal of Medical Research
volume 22, Article number: 52 (2017)
Cite this article
-
1728 Accesses
-
2 Citations
-
1 Altmetric
-
Metrics details
Abstract
Objectives
To report an extremely rare case of ovarian borderline mucinous cystic tumor accompanied by low-grade endometrial stromal sarcoma (LGESS) with myxoid change.
Case presentation
A 42-year-old woman complained of lower left abdominal fullness. Her serum carcinoembryonic antigen, cancer antigen (CA) 125, and CA19-9 levels were normal. Magnetic resonance imaging showed a 10-cm cystic mass with a 5-cm nodule in its wall, and a laparoscopy indicated a cystic mass at the left adnexa. Histology indicated a cystic lesion consisting of proliferative gastrointestinal-type epithelium; the mural nodule had a characteristic of striking myxoid change, preservation of arteriolar pattern, and a “tongue-like” infiltration.
Conclusions
The diagnosis of ovarian mucinous borderline tumor accompanied by LGESS with myxoid change was appropriate.
Background
Mucinous cystic tumors of the ovary, whether benign, borderline, or malignant, may be associated with mural nodules of various types, including sarcomas, sarcoma-like mural nodules, foci of anaplastic carcinoma, carcinosarcoma, mixed nodules, and leiomyomas [1, 2]. The subject of this report is a mural nodule with features of a low-grade endometrial stromal sarcoma (LGESS) with myxoid change arising in an ovarian mucinous borderline tumor. To our knowledge, there are no reports of mucinous ovarian tumors accompanied by LGESS with myxoid change.
Case report
A 42-year-old woman complained of lower left abdominal fullness. Her serum carcinoembryonic antigen (CEA), cancer antigen (CA) 125, and CA19-9 levels were within normal limits. Magnetic resonance imaging (MRI) showed a 10-cm cystic mass at the pelvic cavity with a 5-cm nodule in its wall. The laparoscopy showed a 10-cm cystic mass at the left adnexa. The right ovary and uterus were grossly normal. The patient underwent left salpingo-oophorectomy and adhesiolysis. The patient was symptom free 10 months after surgery.
On macroscopic examination, the cyst measured 10 cm in maximal diameter and had a thickness of 0.2–0.5 cm. This cystic tumor focally adhered to the peritoneum. The inner side was slightly uneven and attached with clot-like material in some area. The cyst had a solid mural nodule protruding from the wall into the lumen measuring up to 5 × 4 × 4 cm in size (Fig. 1a). The mass was found penetrating the surface of the cyst and invading to the tubal fimbria. The cut surface was fleshy and gray with the area of hemorrhage and necrosis (Fig. 1b).

Gross specimen of ovarian cystic mass with mural nodule: a solid mural nodule protruding into the cyst indicated with black arrows (a). Penetrating the surface of the cyst and invading to the tubal fimbria indicated with black arrows (b)
Full size image
Microscopic observation showed that the cystic walls were lined mainly by single-layered tall mucinous columnar epithelium (Fig. 2a). Some epithelium of cystic walls showed slightly atypical proliferation with glandular budding and stratification. The cells exhibited mild to moderate nuclear enlargement and hyperchromasia. Acellular pools of mucin in the stroma were present in some areas (Fig. 2b). Old hemorrhage can be found in the cystic wall (Fig. 2c). In addition, there was a proliferation of large mononucleated cells and scattered multinucleated giant cells in an area of the cyst wall without forming a true nodule (Fig. 2d).

Histological findings (H&E). a Ovarian mucinous cystadenoma (×10). b Borderline malignant mucinous cystadenoma and acellular pools of mucin (×10). c Old hemorrhage in the cystic wall (×10). d Proliferation of large mononucleated cells and scattered multinucleated giant cells indicated with black arrows (×20)
Full size image
A 5-cm mural nodule was identified in the hysterectomy specimen protruding into the cystic cavity, extending onto the serosal, and involving the tubal fimbria. The mural nodule had a characteristic of striking myxoid change, preservation of arteriolar pattern, and a “tonguelike” infiltration (Fig. 3a). There was a sharp demarcation between epithelial and sarcomatous components (Fig. 3b). The mural nodule consisted of sheets of small cells with oval to spindle nuclei, whorling around spiral arteriole-like vessels (Fig. 3c). There was mild to moderate nuclear atypia and the mitosis was 4/10 HPF (Fig. 3d).

Histological findings (H&E). a Tongue-like processes extending into the edematous stroma (×10). b Sharp demarcation between epithelial and sarcomatous components indicated with black arrows (×10). c Preservation of arteriolar pattern (×20). d Nuclear atypia and the mitosis indicated with black arrows (×40)
Full size image
Immunohistochemical staining is shown in Fig. 4. The tumor cells of the mural nodule were strongly positive for cluster of differentiation 10 (CD10) and progesterone receptor (PR) and was negative for cytokeratin 7 (CK7), CK20, estrogen receptor (ER), a-inhibin, calretinin, caldesmon, and smooth muscle actin (SMA), which is a typical feature of endometrial stromal sarcoma. The tumor cells had a high index of Ki67. The epithelium of cystic wall was locally positive for CK7 and CK20.

Immunochemical photograph of the ovarian tumors: CD10 (a, ×20), PR (b, ×20), CK7 (c, ×20), CK20 (d, ×20), ER (e, ×20), a-inhibin (f, ×20) calretinin (g, ×20), caldesmon (h, ×20), SMA (i, ×20), and Ki67 (j, ×20)
Full size image
Taking into account the above features, we made the diagnosis as ovarian mucinous borderline tumor accompanied by LGESS with myxoid change involving the tubal fimbria.
Discussion
In 1979, Prat and Scully [3] described in detail the clinicopathologic features of mural nodules emphasizing their broad morphologic spectrum and varying biological behavior. Since then, the scope of ovarian mural nodules has been classified into sarcoma-like, sarcoma, and anaplastic carcinoma [4]. The present case is quite interesting because of the presence of LGESS with myxoid change.
Mural nodules can develop in benign, borderline, or malignant ovarian tumors. These mural nodules are seen as solid lesions on the wall of the tumor or protrude into the cyst lumen. The diagnosis of mural nodules in the residual ovary is based on the size and characteristic gross and microscopic features [5, 6]. The benign and reactive mural nodules, also called sarcoma-like mural nodules (SLMNs), occur in younger females and are usually sharply demarcated small lesions. Malignant mural nodules are large solid tumors; as sarcoma and anaplastic carcinomas, they tend to occur in older females.
A review of the literature revealed only five mucinous ovarian tumors with sarcomas, with most of the mural nodules measured > 5 cm in the greatest dimension. In these five cases, they were fibrosarcomatous mural nodule in an ovarian mucinous cystadenoma [7], fibrosarcoma arising in a mucinous cystadenocarcinoma [8], fibrosarcoma associated with a mucinous cystadenoma [9], undifferentiated sarcoma in a mucinous cystadenocarcinoma [9], and rhabdomyosarcoma coexistent with ovarian mucinous cystadenocarcinoma [10], respectively. Ovarian mucinous borderline tumor accompanied by LGESS with myxoid change in our case was rather unique. The clinical and pathological features are summarized in Table 1.
Full size table
The differential diagnosis for extrauterine LGESS depends on the location of the tumor. In case of ovarian location, ovarian sex cord–stromal tumors should be excluded. The pathological and morphological characteristics and immunohistochemical findings in the present case do not favor ovarian sex cord–stromal tumors. LGESS with myxoid change can be confused with myxoid smooth muscle lesions, but the “tonguelike” infiltration and small arterioles, along with the CD10 immunostaining and muscle marker negativity, will usually resolve the diagnosis.
Tumors with a combination of different histology are divided into two clinicopathologic groups, collision or composite tumors [11]. The collision tumor has more than two juxtaposed masses and each mass displays a different histology. In contrast, the intermingling of more than two different components in one tumor mass is designated as a composite tumor. The well-known example is a malignant mixed Müllerian tumor (MMMT). It was noted that there was a sharp demarcation between epithelial and sarcomatous components in this case.
In this case, there was a region of proliferation of large mononucleated cells just beneath the epithelium without forming a true nodule, which may help explain the occurrence of malignant mural nodules. We hypothesize the forming process of this sarcoma as follows. The submesothelial mesenchymal cells reacted to the intramural hemorrhage or the mucinous content of the cyst, which eventually became a hyperplastic nodule, probably corresponding to the earlier stage of the SLMNs. Then the proliferation of mesenchymal cells resulted in the sustained expansion of the lesion. The nodule enlarged gradually and became SLMNs. Some of the SLMNs could possibly evolve into a true sarcoma with the proliferation and differentiation of mesenchymal cells.
Conclusions
We have presented a rare case of sarcoma-like mural nodule. Based on the ample evidence of the previous reports, and the immunohistochemical analysis of our case, we believe that this is a collision tumor with two different elements and may be formed by SLMN malignant change. Nevertheless, further molecular and genetic evidence is needed to support such a conclusion.
Abbreviations
- LGESS:
-
low-grade endometrial stromal sarcoma
- CEA:
-
carcinoembryonic antigen
- CA125:
-
cancer antigen 125
- CA19-9:
-
cancer antigen 19-9
- MRI:
-
magnetic resonance imaging
- CD10:
-
cluster of differentiation 10
- PR:
-
progesterone receptor
- CK7:
-
cytokeratin 7
- CK20:
-
cytokeratin 20
- ER:
-
estrogen receptor
- SMA:
-
smooth muscle actin
- SLMN:
-
sarcoma-like mural nodules
- MMMT:
-
malignant mixed Müllerian tumor
References
-
Park TC, Lee HN, Shin OR, Lee KH. A case of a borderline mucinous tumor of the ovary with sarcoma-like mural nodules producing granulocyte colony-stimulating factor. Eur J Gynaecol Oncol. 2012;33:526–7.
CAS
PubMedGoogle Scholar
-
Bague S, Rodriguez IM, Prat J. Sarcoma-like mural nodules in mucinous cystic tumors of the ovary revisited: a clinicopathologic analysis of 10 additional cases. Am J Surg Pathol. 2002;26:1467–76.
Article
PubMedGoogle Scholar
-
Prat J, Scully RE. Ovarian mucinous tumors with sarcoma-like mural nodules: a report of seven cases. Cancer. 1979;44:1332–44.
Article
CAS
PubMedGoogle Scholar
-
Gungor T, Altinkaya SO, Akbay S, Bilge U, Mollamahmutoglu L. Malign mural nodules associated with serous ovarian tumor of borderline malignancy: a case report and literature review. Arch Gynecol Obstet. 2010;281:485–90.
Article
PubMedGoogle Scholar
-
Bague S, Rodriguez IM, Prat J. Sarcoma-like mural nodules in mucinous cystic tumors of the ovary revisited—a clinicopathologic analysis of 10 additional cases. Am J Surg Pathol. 2002;26(11):1467–76.
Article
PubMedGoogle Scholar
-
Chang JS, Chua CC, Lee CC. Borderline mucinous cystic ovarian tumor with mural nodules (carcinosarcoma). Ann Saudi Med. 2012;32(4):415–20.
Article
PubMedGoogle Scholar
-
De Nictolis M, Di Loreto C, Cinti S, Prat J. Fibrosarcomatous mural nodule in an ovarian mucinous cystadenoma: report of a case. Surg Pathol. 1990;3:309–15.
Google Scholar
-
Rahilly MA, Candlish W, Al-Nafussi A. Fibrosarcoma arising in an ovarian mucinous tumor: a case report. Int J Gynecol Cancer. 1994;4(3):211–4.
Article
PubMedGoogle Scholar
-
Prat J, Scully RE. Sarcomas in ovarian mucinous tumors: a report of two cases. Cancer. 1979;44:1327–31.
Article
CAS
PubMedGoogle Scholar
-
Tsujimura T, Kawano K. Rhabdomyosarcoma coexistent with ovarian mucinous cystadenocarcinoma: a case report. Int J Gynecol Pathol. 1992;11:58–62.
Article
CAS
PubMedGoogle Scholar
-
Lewin K. Carcinoid tumors and the mixed (composite) glandular-endocrine cell carcinomas. Am J Surg Pathol. 1987;11:71–86.
Article
PubMedGoogle Scholar
Download references
Authors’ contributions
All authors made substantial contributions to conception and design, or acquisition of data, or analysis and interpretation of data; WW and ZY were involved in drafting the manuscript and revising it critically for important intellectual content; ZF gave final approval to the version to be published. All authors read and approved the final manuscript.
Acknowledgements
Not applicable.
Competing interests
The authors declare that they have no competing interests.
Availability of data and materials
The datasets generated during and/or analyzed during the current study are available from the corresponding author on reasonable request.
Consent for publication
Written informed consent was obtained from the patient for publication of this case report and any accompanying images.
Ethics approval and consent to participate
This study was approved by the ethics committee of the Women’s Hospital, School of Medicine Zhejiang University.
Funding
This work was supported by the program for Zhejiang Provincial Natural Science Foundation, P. R. China (No. LY12H04011).
Publisher’s Note
Springer Nature remains neutral with regard to jurisdictional claims in published maps and institutional affiliations.
Author information
Authors and Affiliations
-
Department of Obstetrics and Gynecology, Women’s Hospital, School of Medicine, Zhejiang University, Hangzhou, Zhejiang, China
Wen Wang, Yalin Zhuang & Lili Huang
-
Department of Pathology, Women’s Hospital, School of Medicine, Zhejiang University, 1 Xueshi Road, Hangzhou, 310006, Zhejiang, People’s Republic of China
Feng Zhou
Authors
- Wen Wang
You can also search for this author in
PubMed Google Scholar - Yalin Zhuang
You can also search for this author in
PubMed Google Scholar - Feng Zhou
You can also search for this author in
PubMed Google Scholar - Lili Huang
You can also search for this author in
PubMed Google Scholar
Corresponding author
Correspondence to
Feng Zhou.
Rights and permissions
Open Access This article is distributed under the terms of the Creative Commons Attribution 4.0 International License (http://creativecommons.org/licenses/by/4.0/), which permits unrestricted use, distribution, and reproduction in any medium, provided you give appropriate credit to the original author(s) and the source, provide a link to the Creative Commons license, and indicate if changes were made. The Creative Commons Public Domain Dedication waiver (http://creativecommons.org/publicdomain/zero/1.0/) applies to the data made available in this article, unless otherwise stated.
Reprints and Permissions
About this article
Cite this article
Wang, W., Zhuang, Y., Zhou, F. et al. Ovarian mucinous borderline tumor accompanied by LGESS with myxoid change: a case report and literature review.
Eur J Med Res 22, 52 (2017). https://doi.org/10.1186/s40001-017-0295-4
Download citation
-
Received: 22 November 2016
-
Accepted: 22 November 2017
-
Published: 02 December 2017
-
DOI: https://doi.org/10.1186/s40001-017-0295-4
Keywords
- Mucinous borderline tumor
- Mural nodules
- LGESS
- Myxoid change



